重金属胁迫对蚕豆根系生命活动的影响
古红梅,温晓晓,王 哲,谷喜乐
(周口师范学院 生命科学与农学学院,河南 周口 466001)
近几年,重金属污染问题越来越严重,导致生态环境持续恶化.因此重金属污染已引起世界各地人们的广泛关注[1-4].在农业生产中,适量的重金属离子可能会对植物有一定的益处,但当环境中重金属离子超过某一临界值时,就会对植物的生理生化特性产生很大的影响[5].本实验所用到的重金属铜,是植物生长发育所需的一种微量元素,是一些蛋白质和氧化还原酶如超氧化物歧化酶等关键组成成分,因为它会储存在叶绿体中,所以可以进行光合作用,又是氧化还原酶的组成成分,也可以影响氧化还原过程[6-8].蚕豆因为其体细胞染色体共有六对,且染色体比较大,是很好的细胞遗传学研究材料,并且蚕豆根尖细胞含有较多的分裂细胞,制片比较简单,容易观察,因此想要测知污染物的环境毒理效应可以借用蚕豆根尖分裂细胞的细胞学实验来观测[9-11].利用蚕豆作材料来研究有丝分裂、无丝分裂、染色体形态结构也是国内外环境监测常用的遗传毒理学检测技术[12-13].本实验以蚕豆为材料,利用不同浓度的氯化铜对蚕豆萌发和生长过程进行胁迫处理,以此来探究氯化铜的处理浓度和处理时间对蚕豆种子萌发、根系生长及根尖细胞的细胞核和染色体的影响,在理论上揭示重金属胁迫对蚕豆的损伤机理,在生产应用上为防治重金属危害植物提供科学依据.
1 材料与方法
1.1 实验材料
市售普通蚕豆.
1.2 实验方法
1.2.1实验试剂制备
氯化铜胁迫液的制备:首先称取5 mg氯化铜(优级纯)放入烧杯中,加入少量水,然后全部溶解后移入500 mL容量瓶中,加水定容至刻度,即配成10 mg/L的氯化铜溶液.用相同的方法配制浓度分别为20,40,80,120,240 mg/L的氯化铜溶液.
固定液的制备:无水乙醇∶冰乙酸=3∶1.
解离液的制备[11]:量取质量分数为36%的盐酸43 mL,倒入烧杯中,玻璃棒引流至500 mL容量瓶中,加入蒸馏水定容,此溶液即为1 mol/L的盐酸.
染色液的制备:制备改良的苯酚品红染色液.
1.2.2蚕豆种子萌发前处理
挑选无病虫害、饱满的蚕豆种子,用蒸馏水漂洗2次,再用2%的H2O2浸泡消毒10 min,洗净后用蒸馏水浸种1 d,一部分种子用于萌发实验,另一部分种子用于细胞学观察实验.
1.2.3蚕豆种子萌发实验
将浸泡1 d后的蚕豆种子分组放在小烧杯里,每组10颗蚕豆.第一组为对照,蒸馏水浸泡,第二至七组分别用10,20,40,80,120,240 mg/L的氯化铜溶液浸泡,浸种1 d后,放入大培养皿中进行暗培养,培养温度(25±1) ℃,培养期间每天补充各组对应的处理液.每天记录萌发情况(发芽率、芽长、根长),连续统计4 d.发芽率=(萌发粒数/总粒数)×100%;芽长、根长分别取10粒的平均值.若芽和根弯曲,则可先用细线测量,再将细线拉直,用毫米刻度尺测出细线长度.
1.2.4蚕豆主根根尖细胞学观察实验
将浸泡1 d后的蚕豆种子放入大培养皿中进行培养,每天补充水分,待主根长至1~2 cm时,分组处理主根.第1组为对照组,不做铜离子胁迫处理;第2组为10 mg/L氯化铜溶液处理;第3组为20 mg/L氯化铜溶液处理;第4组为40 mg/L氯化铜溶液处理;第5组为80 mg/L氯化铜溶液处理;第6组为120 mg/L氯化铜溶液处理;第7组为240 mg/L氯化铜溶液处理.处理时间为4 d,处理结束后,根尖恢复培养1 d,取材制作装片,观察染色体畸变情况及产生微核情况.染色体畸变率=(染色体畸变细胞总数/有丝分裂细胞总数)×100%[13];微核率=(观察到的微核数目/观察到的细胞数目)×1 000‰.
1.2.5蚕豆侧根根尖细胞学观察实验
将浸泡1 d后的蚕豆种子放入大培养皿中进行培养,每天补充水分,待主根长至1~2 cm时,切去部分主根,使侧根充分发育,待侧根长至1~2 cm时,分组处理侧根.处理方法同主根.取材制作装片后进行细胞学观察.
取材时间设定:蚕豆根尖细胞在细胞分裂时期分裂细胞并不同步,所以不管何时处于分裂期的细胞只有一小部分.在一天中,细胞分裂有一定规律,蚕豆一般上午9~10时、下午14~17时才处于分裂高峰期,因此本实验取材时间设定为上午9~10时,以便可以观察到更多分裂期的细胞.
2 结果与分析
2.1 氯化铜胁迫对蚕豆种子发芽率的影响
表1显示了不同浓度氯化铜胁迫对蚕豆种子发芽率的影响.随着处理天数的增加,对照组及氯化铜胁迫组发芽率均呈增加趋势,但氯化铜胁迫组发芽率基本上总低于对照组发芽率;相同处理天数下,氯化铜处理浓度越高,发芽率越低.这说明氯化铜对蚕豆种子的萌发有抑制作用,氯化铜处理浓度越高,抑制程度越强.

表1 不同浓度氯化铜胁迫下蚕豆种子发芽率/%
2.2 氯化铜胁迫对蚕豆种子根长的影响

表2 不同浓度氯化铜胁迫下蚕豆种子根长/cm
不同浓度氯化铜胁迫对蚕豆种子根长的影响结果见表2.由表2可知,同一浓度下,随着处理时间的延长,无论对照组还是胁迫组均呈增加趋势,但对照组根长增加幅度相对较大.相同处理天数下,氯化铜处理浓度与根长成反比,即氯化铜浓度越高,根生长越慢.从表2还可以看出,低浓度(≤10 mg/L)氯化铜胁迫1 d和2 d时,蚕豆根生长速度要快于对照,但胁迫3 d和4 d后,蚕豆根生长速度与对照比较明显减慢,并且氯化铜浓度越高,根长增加幅度越小.以上分析说明低浓度氯化铜处理短时间内有利于蚕豆根的生长,但随着处理天数延长,其作用发生逆转,会抑制蚕豆根的生长,而高浓度氯化铜处理会抑制甚至阻碍蚕豆根的生长.
2.3 氯化铜胁迫对蚕豆种子芽长的影响
不同浓度的氯化铜胁迫对蚕豆种子芽长的影响结果见表3.如表3所示,随着处理天数延长,对照组及氯化铜胁迫组芽长逐渐增长,但对照组增长速度及增长幅度明显大于氯化铜胁迫组.同样处理天数下,氯化铜处理浓度与芽长成反比.从表3还可以看出,较高浓度(≥40 mg/L)的氯化铜处理下,第3 d才长芽.这说明重金属铜会抑制蚕豆出芽,并且铜离子浓度越大,对蚕豆的出芽抑制作用越强.

表3 不同浓度氯化铜胁迫下蚕豆种子芽长/cm
2.4 氯化铜胁迫对蚕豆根尖细胞染色体的影响
不同浓度氯化铜胁迫对蚕豆根尖细胞染色体畸变率的影响见表4.如表4所示,无论取材部位是主根根尖还是侧根根尖,其根尖细胞染色体畸变率均随着氯化铜浓度的增大而增加,表4还显示,在氯化铜浓度较小时(<40 mg/L),染色体畸变率变化不大,而氯化铜浓度较高时(>40 mg/L),染色体畸变率增加幅度明显变大.这说明较低浓度的重金属铜对蚕豆根尖细胞染色体影响不明显,而较高浓度的重金属铜对蚕豆根尖细胞染色体影响明显.

表4 不同浓度氯化铜胁迫下
2.5 氯化铜胁迫对蚕豆根尖细胞微核率的影响
不同浓度氯化铜胁迫对蚕豆根尖细胞微核率的影响见表5.从表5可知,无论取材部位是主根根尖还是侧根根尖,其根尖细胞微核数都随着氯化铜浓度的升高而逐渐增加.无氯化铜胁迫时,细胞微核率为0,高浓度氯化铜胁迫(>40 mg/L)时,细胞微核数增加幅度明显变大,这说明高浓度的重金属铜对蚕豆根尖细胞微核率的影响较大.
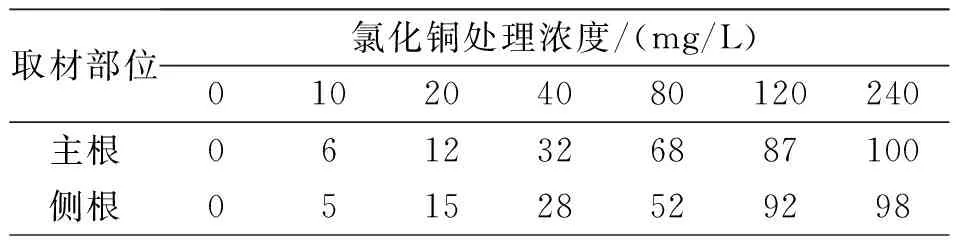
表5 不同浓度氯化铜胁迫下蚕豆根尖细胞微核率/‰
3 结论与讨论
3.1 结论
本研究结果表明,同一浓度下,随着氯化铜胁迫天数的延长,蚕豆种子发芽率、根长、芽长虽然呈增加趋势,但增加幅度明显小于对照;相同处理天数下,氯化铜处理浓度与蚕豆种子发芽率、根长、芽长基本成反比,但与蚕豆根尖细胞染色体畸变率及微核率成正比,并且氯化铜处理浓度越高,染色体畸变率及微核率增加幅度越大.综上所述,不同浓度的氯化铜胁迫处理不同天数对蚕豆种子发芽率、根长、芽长、主根和侧根根尖细胞染色体及微核均有不同程度地影响.
3.2 讨论
重金属对植物产生毒害作用的原因主要是重金属通过根部进入植物体内,扰乱植物的内部生长条件,然后经过一系列生理生化反应,来破坏植物的正常生长.具体表现为随着重金属浓度的增加会使植物的根出现生长缓慢、甚至停止生长.外观会表现出叶子卷曲,甚至变黑,没有光泽,而且根也会相继变黑,甚至烂掉[14-15].本实验中蚕豆根系及一些叶片性状均发生类似的变化(见图1、图2).

图1 不同浓度氯化铜胁迫处理前蚕豆侧根生长情况

图2 不同浓度氯化铜胁迫处理4 d后蚕豆侧根生长情况
重金属不仅影响植物的外观而且还会影响植物的内部结构.但在自然条件或人工因素的重金属影响下,染色体会出现一定程度的变异.具体表现为:一些染色体的数目成对的增加或减少,或者是单个的增加或减少;还有一些染色体会出现断裂,然后会再一次的异常连接;甚至会出现在一条染色体上某一段会含两份或两份以上;以及还会出现某一条染色体发生断裂,形成的节段,经过变位重新连接.本研究中,重金属氯化铜胁迫对蚕豆根尖细胞染色体的影响见图 3.
重金属影响细胞内部结构不仅有染色体畸变还有细胞微核.细胞核是真核细胞内最大最重要的细胞器.细胞核一旦破坏,细胞有丝分裂也会发生变化,在每个分裂时期的染色体会有不同程度的变化,在染色体畸变的间期会出现细胞微核现象.重金属导致植物的细胞核解体常见有2种形式,一种是解体成许多圆球状小的核,二是核质会逐渐解体消失,最后只余下一个空网状的结构.本研究中观察到的细胞微核现象见图4.

图3 染色体畸变现象

图4 微核现象
参考文献:
[1] 廖自基.微量元素的环境化学及生物效应[M].北京:中国环境科学出版社,1993:299-302.
[2]熊亚.环境铅接触对健康的影响[J].微量元素与健康研究,2003,20(1):48-50.
[3]韦朝阳,陈同斌.重金属超富集植物及植物修复技术研究进展[J].生态学报,2001,21(7):1197-1203.
[4]张利红,李培军,李雪梅,等.镉胁迫对小麦幼苗生长及生理特性的影响[J].生态学杂志,2005,24(4):458-460.
[5]荫世安.北京市食物中硒含量及其拮抗元素的含量[J].营养学报,1996,8(1):27-34.
[6]郑世英,商学芳.镉对小麦种子萌发和生长的影响[J].德州学院学报,2006,22(5):90-92.
[7]陈秀芳,赵秀兰,夏章菊,等.硅缓解小麦镉毒害的效应研究[J].西南农业大学学报,2003,24(20):22-25.
[8]蒋明义,杨文英,徐江,等.渗透胁迫下水稻幼苗中叶绿素降解的活性氧损伤作用[J].植物学报,1994,36(4):289-295.
[9]仪慧兰,司良燕.亚硒酸盐对蚕豆根尖细胞的遗传损伤效应[J].应用与环境生物学报,2004,10(4):425-427.
[10]仪慧兰,秦海峰.环磷酰胺诱发蚕豆体细胞遗传损伤的研究[J].植物研究,2004,24(4):439-442.
[11]曹德菊,汤斌.铅、镉及其复合污染对蚕豆根尖细胞的诱变效应[J].激光生物学报,2004,13(4):302-304.
[12]杨铭,张利红.铅胁迫对蚕豆根尖有丝分裂染色体畸变的研究[J].宁夏农林科技,2013,54(9):58-59,71.
[13]南晓光.蚕豆根尖细胞微核实验[J].内蒙古民族大学学报,2003,18(5):415-416.
[14] SHU Tao, TAO Liang. Synergistic effect of copper and lead uptake by fish[J]. Ecotox Environ Safety,1999,4:190-195.
[15] LIU Deng-yi, XIE Jian-chun. Effects of copper mine tailings on gowth and physiological function of wheat[J].Chin J App Ecol,2001,12(1):52-56.

