姜黄素联合干扰素-β/维甲酸对乳腺癌细胞的协同效应
葛素侠,任 敏,查晓军,吴晓东
干扰素-β(interferon-β,IFN-β)联合维甲酸(retinoic acid,RA)是目前已知的能够抑制乳腺癌细胞生长的药物,但目前乳腺癌细胞对于IFN-β/RA药物的敏感性逐渐下降,抵抗性逐渐增强[1]。为解决这一问题笔者选择IFN-β/RA与其他药物联合治疗。姜黄素是从植物姜黄根茎中提取出来的一种多酚类化合物,许多研究[2]已证实姜黄素具有抗肿瘤活性,并被用于许多恶性肿瘤包括乳腺癌的治疗。但目前关于姜黄素和IFN-β/RA联合用药在乳腺癌细胞中的研究鲜有文献报道,因此该研究旨在探讨两者联合用药对乳腺癌细胞的影响。
1 材料与方法
1.1实验材料人类乳腺癌细胞系(Michigan cancer foundation 7,MCF-7)购自中科院上海细胞生物学研究所细胞库;IFN-β购自美国Millipore公司;RA、姜黄素、MTT 购自美国Sigma公司;膜联素Ⅴ/碘化丙啶(Annexin V /propidium iodide, Annexin V/PI) 细胞凋亡试剂盒购自美国BioVision 公司;胎牛血清购自上海Excell公司;DMEM 培养基(高糖)购自美国Hyclone公司。
1.2实验方法
1.2.1细胞培养 将人类乳腺癌MCF-7细胞用含有10%胎牛血清、1%双抗(100 U/ml青霉素、100 μg/ml链霉素)的DMEM培养基,置于37 ℃、5% CO2孵箱内培养,实验取对数生长期细胞。
1.2.2MTT法检测细胞活性 将细胞以104个/孔分别接种到96孔板中,每孔体积200 μl,置于37 ℃、5% CO2孵箱内培养。细胞贴壁后分别加入相应药物,分组如下:对照组(加培养基)、姜黄素组(40 μmol/L)、IFN-β/RA组(IFN-β 750 U/ml,RA 1.5 μmol/L)、姜黄素联合IFN-β/RA组(姜黄素40 μmol/L,IFN-β 375 U/ml,RA 0.75 μmol/L)。继续孵箱内培养,分别在0、12、24、36、48 h五个时间点用MTT法测定细胞活性,每孔加入MTT溶液(5 mg/ml)10 μl,孵育4 h后终止培养,弃去孔内液体,每孔加入100 μl DMSO,摇床震荡10 min,在酶联免疫检测仪上选择490 nm波长处测定各孔的吸光度,绘制生长曲线。
1.2.3Annexin-V/PI 双染流式细胞术检测细胞凋亡 将收集的细胞悬液(细胞浓度为5×105个/ml)加入10 ml离心管中,加入100 μl Bingding Buffer和5 μl Annexin-V(20 μg/ml),室温避光30 min,再加入5 μl PI(50 μg/ml),避光反应5 min后,加入400 μl Bingding Buffer,立即用FC500流式细胞仪分析。数据用细胞流式分析软件(FCS Express4)分析。分别以Annexin V为横坐标、PI为纵坐标作图。结果分为以下几类:左上象限代表坏死细胞,右上象限代表晚期凋亡细胞,左下象限代表正常细胞,右下象限代表早期凋亡细胞。其中早期凋亡细胞与晚期凋亡细胞的和代表细胞总凋亡的百分比。
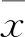
2 结果
2.1姜黄素联合IFN-β/RA显著抑制MCF-7细胞活性MTT结果显示,药物作用48 h后,与对照组相比,姜黄素和IFN-β/RA单独用药时均能抑制细胞活性(F=9.33,P<0.05);而与单药组相比,姜黄素联合IFN-β/RA组能显著抑制细胞活性(F=6.81,P<0.05)。见图1。

图1 MTT法检测姜黄素和IFN-β/RA单药及联合用药对MCF-7细胞活性的影响与对照组比较:#P<0.05;与单药组比较:*P<0.05
2.2姜黄素联合IFN-β/RA能显著促进MCF-7细胞凋亡结果显示单药组的细胞凋亡率高于对照组(F=191.83,P<0.05);而联合用药组的细胞凋亡率明显高于单药组(F=44.02,P<0.05)。见图2。

图2流式细胞术检测对MCF-7细胞凋亡的影响
A:Annexin V和PI染色结果;B:凋亡细胞百分比;
与对照组比较:#P<0.05;与单药组比较:*P<0.05
3 讨论
乳腺癌是全世界女性最常见的恶性肿瘤,是女性癌症死亡的第二大常见原因[3]。在过去20年中,全球乳腺癌绝对数量上升了1.4倍,世界上大多数国家和地区乳腺癌的发病率上升了30%~40%[4]。在2015年,美国有231 840例被诊断为乳腺癌,其中40 290例患者死于乳腺癌,在我国,乳腺癌的发病率和死亡率呈持续上升趋势,据国际癌症研究所预计,在2030年我国女性乳腺癌发病数可达到23.4万例,因乳腺癌死亡7.0万例[5]。除了手术和放疗外,化学药物仍是乳腺癌治疗的重要手段。但目前单一的药物总有这样或那样的缺点,严重影响了药物的疗效,降低患者的生存质量,因此寻求有效的联合用药以减少药物的毒副作用至关重要。
IFN-β属于I型干扰素,是一种由成纤维细胞产生的细胞因子,具有抗病毒、抑制和杀伤肿瘤细胞、抑制细胞生长、免疫调节等多种生物学功能,目前已成功用于治疗恶性肿瘤、病毒性感染和多发性硬化症。IFN-β是第一个在临床上用于恶性肿瘤治疗的细胞因子,在目前的许多动物模型和临床研究[6]中,都显示IFN-β能够明显的抑制肿瘤细胞的生长,如乳腺癌细胞、卵巢癌细胞、黑色素瘤细胞。IFN-β的抗肿瘤机制主要有:增加肿瘤特异性抗原的表达量,提高自然杀伤细胞的杀伤水平;在淋巴瘤细胞系中下调c-Myc的表达,抑制肿瘤细胞增殖[7]。尽管单药IFN-β对白血病具有很好的治疗效果,但对于一些实体肿瘤单药IFN-β治疗效果却不十分理想。
RA是维生素A在体内代谢的活性产物或衍生物,在胚胎发育、 器官形成、 细胞增殖和分化等许多基本生命活动中发挥着重要作用。RA可与细胞核内的相应受体结合,进而结合在靶基因的特定区域,调控目的基因表达,从而抑制细胞增殖,诱导细胞分化、凋亡,发挥生物学效应[8]。RA是临床上常用的诱导分化剂,是目前临床上用于治疗急性早幼粒细胞性白血病的首选药物。此外,RA也已成功用于乳腺癌、宫颈癌、前列腺癌等实体肿瘤的临床治疗。
为了解决IFN-β在临床上对多数实体肿瘤治疗效果差这一问题,研究者们提出了许多新的治疗方法,在这些方法中,IFN-β与RA的联合用药取得了很好的效果,大大提高了单药IFN-β对实体肿瘤的治疗效果[9]。目前有许多研究[10]表明IFN-β与RA联合用药(IFN-β/RA)比单药能更有效地抑制细胞生长,而且这种协同抗肿瘤效应在人类乳腺癌细胞及乳腺癌裸鼠移植瘤中也得到了证实。但随着乳腺癌发病率的提高以及年轻化,乳腺癌对于IFN-β/RA也逐渐出现了“耐药现象”,抵抗性逐渐增强,敏感性逐渐下降,治疗效果越来越不理想,因此积极寻求新的治疗方案以提高乳腺癌患者的生存率及生存质量就显得十分迫切。
姜黄素是从天然植物姜黄中提取出来的一种色素,自古以来就被用作药物。其具有抗炎、抗氧化、抗肿瘤等广谱的生物学作用,且来源广泛,价格低廉,毒副作用小,对正常细胞几乎无影响,因此具有十分广泛的应用前景[11]。近年来,由于恶性肿瘤如肺癌、胃癌、乳腺癌等疾病的发病率在逐年上升,严重威胁了人类的健康,因此姜黄素的抗肿瘤作用被越来越多的研究者们重视,相关研究[12-15]表明姜黄素对肺癌、胃癌、骨肉瘤、胰腺癌等许多恶性肿瘤都具有明显的抗肿瘤作用。姜黄素的抗肿瘤机制较为复杂,在不同的肿瘤细胞中表现出不同的效应,目前认为姜黄素的抗肿瘤机制主要有:抑制某些癌基因表达,促进抑癌基因表达;抑制肿瘤细胞的增殖,诱导肿瘤细胞的凋亡;抑制肿瘤血管的生成等[13-14,16]。
本研究结果表明,相对于姜黄素和IFN-β/RA单一药物治疗,姜黄素和IFN-β/RA的联合用药能更明显地抑制MCF-7细胞活性,且促进细胞凋亡。而且,在姜黄素与IFN-β/RA联合用药时,IFN-β/RA的药物浓度比单独用IFN-β/RA时药量减少,从而减少IFN-β/RA高浓度时的毒副作用。综上所述,姜黄素能协同性地增强IFN-β/RA对人类乳腺癌MCF-7细胞的抗肿瘤作用,抑制肿瘤细胞增殖,促进细胞凋亡。这种协同效应可以在提高IFN-β/RA药物疗效的情况下减少其药物用量,增强药物敏感性,降低抵抗性,从而控制单一药物的副作用,达到更好的治疗效果,为乳腺癌的临床治疗提供一种新的选择。
[1] Hallman K,Aleck K,Dwyer B,et al. The effects of turmeric (curcumin) on tumor suppressor protein (p53) and estrogen receptor (ERα) in breast cancer cells[J].Breast Cancer (Dove Med Press),2017,9:153-61.
[2] Schaffer M,Schaffer P M,Bar-Sela G. An update on curcuma as a functional food in the control of cancer and inflammation[J]. Curr Opin Clin Nutr Metab Care,2015,18(6):605-11.
[3] Pence K A, Mishra D K,Thrall M,et al. Breast cancer cells form primary tumors on ex vivo four-dimensional lung model[J]. J Surg Res,2017,210:181-7.
[4] 郑 莹,吴春晓,张敏璐. 乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561-9.
[5] Wang L L, Hao S, Zhang S,et al. PTEN/PI3K/AKT protein expression is related to clinicopathological features and prognosis in breast cancer with axillary lymph node metastases[J]. Hum Pathol,2016,61:49-57.
[6] Ethiraj P, Veerappan K, Doraisami B, et al. Synergistic anti-carcinogenic effect of interferon-β with cisplatin on human breast adenocarcinoma MDA MB231 cells[J]. Int Immunopharmacol,2014,23(1):222-8.
[7] Schreiber G,Piehler J. The molecular basis for functional plasticity in type I interferon signaling[J]. Trends Immunol,2015,36(3):139-49.
[8] 杨 娟,张锡宝. 维甲酸受体及其作用机制研究进展[J]. 皮肤性病诊疗学杂志,2014,21(5):423-6.
[9] 赵冀安,聂文佳,李 卫,等.β干扰素联合全反式维甲酸通过抑制JAK2/STAT3信号通路抑制HepG2人肝癌细胞增殖并促进其凋亡[J].细胞与分子免疫学杂志,2016,32(7):901-5.
[10] Lindner D J,Borden E C,Kalvakolanu D V. Synergistic antitumor effects of a combination of interferons and retinoic acid on human tumor cellsinvitroandinvivo[J]. Clin Cancer Res,1997,3(6):931-7.
[11] Lv Z D,Liu X P,Zhao W J,et al. Curcumin induces apoptosis in breast cancer cells and inhibits tumor growthinvitroandinvivo[J]. Int J Clin Exp Pathol,2014,7(6):2818-24.
[12] Lev-Ari S,Starr A,Katzburg S,et al. Curcumin induces apoptosis and inhibits growth of orthotopic human non-small cell lung cancer xenografts[J]. J Nutr Biochem,2014,25(8):843-50.
[13] Cai X Z,Huang W Y,Qiao Y,et al. Inhibitory effects of curcumin on gastric cancer cells:A proteomic study of molecular targets[J]. Phytomedicine,2013,20(6):495-505.
[14] 钱定军. 姜黄素的抗骨肉瘤活性及其相关作用机理[J].中国生化药物杂志,2012,33(2):136-8.
[15] Ma J,Fang B,Zeng F,et al. Curcumin inhibits cell growth and invasion through up-regulation of miR-7 in pancreatic cancer cells[J]. Toxicol Lett,2014,231(1):82-91.
[16] 高 文,何彦津,梁凤鸣.黄素抗肿瘤血管生成分子机制研究进展[J].国际眼科杂志,2016,17(3):466-8.

