WDR1与小鼠精神分裂样阴性症状呈正相关性
王 梅,王 静,杨中州,高 隽
精神分裂症是一类以情感障碍,精神活动与周围环境不协调,脱离现实为主要特征的常见精神疾病。其终生患病率在世界范围内约为1%[1]。临床阴性症状较为多见,表现为情感低落或情绪冷漠、精神性失语症、意志缺乏。阴性症状的危害不容忽视,且相对更难治疗。WDR1(WD repeat protein 1)是一种64 ku的位于细胞质中的细胞骨架蛋白,促进F-actin解聚,参与调节树突棘的形成[2-3]。就目前国内外的研究结果来看,有研究者对精神分裂症患者的背外侧前额叶皮层进行蛋白质组学分析,发现WDR1在该脑区的表达出现异常[4]。虽然目前发现WDR1的表达在精神分裂症中有变化,但是并没有直接证据证明海马脑区的WDR1与精神分裂症的关系及其调控机制,通过海马CA1区条件性敲除WDR1来观察WDR1与精神分裂样阴性症状的关系。
1 材料与方法
1.1材料实验选用了两种基因工程小鼠,均为C57BL/6背景:① WDR1flox/flox小鼠是将loxP片段选择性地插入WDR1基因内含子中,该小鼠由南京大学模式动物所杨中州实验室赠送;② CA1-Cre小鼠,该小鼠的特点为Cre重组酶特异性表达于海马CA1区,该品系小鼠由美国麻省理工学院Picower学习记忆研究所Susumu Tonegawa教授赠送。利用Cre/loxP技术,将WDR1flox/flox小鼠与CA1-Cre小鼠杂交,即可得到海马CA1区特异性敲除WDR1基因的小鼠,即CA1-Cre;WDR1flox/flox(CKO)小鼠。行为学采用8~10周龄雄鼠,20~25 g,每天12/12 h昼夜更替饲养。抗体:Anti-WDR1抗体(美国Proteintech 公司);腺相关病毒(上海泰廷生物科技有限公司)。
1.2方法
1.2.1小鼠基因型鉴定 小鼠出生1周后即可进行基因型鉴定。剪下小鼠的脚趾并编号,将脚趾放入1.5 ml的离心管,加入500 μl消化液,55 ℃烘箱中过夜消化。第2天消化好后振荡离心,常温12 000 r/min离心5 min,吸取上清液400 μl的消化液加入离心管,接着加入400 μl预冷的异丙醇,充分混匀后4 ℃、12 000 r/min离心15 min,弃上清液,加入500 μl 75%乙醇混合振荡,4 ℃或常温12 000 r/min离心5 min,弃上清液,再加入500 μl 100%无水乙醇混匀4 ℃或常温12 000 r/min离心1 min。然后弃去上清液,倒置晾干,最后加入80~120 μl灭菌水溶解,放入-4 ℃保存,DNA提取完毕。每个PCR过程采取20 μl体系(2 μl模板DNA,1 μl引物,7 μl水及10 μl的混合taq酶),放入PCR仪中进行扩增。结束后放入琼脂糖凝胶中电泳,在孔中加入DNA marker,跑胶完成后用凝胶成像系统观察条带有无及位置。引物序列: WDR1-F:5′-GGACCTTCTAAGCAGTTACAACC-3′;WDR1-R:5′-TTGCACAGAGGTGAATGACAGAG-3′。Camk2-Cre-F:5′-TGCCACGACCAAGTGACAGCAATG-3′;Camk3-Cre-R:5′-ACCAGAGACGGAAATCCATCGCTC-3′。
1.2.2做窝实验 做窝实验是用于评价啮齿类动物筑窝能力的方法,其可以反映出动物的冷漠样情绪,实验具体步骤如下:首先,晚上20:00(熄灯)之前1 h将实验小鼠笼搬至安静清洁的房间,再将小鼠单笼单只放置,笼内添有充足的水、食物以及6片正方形紧密压制的脱脂棉片。然后,用标签详细记录小鼠的组型、编号,将其贴至笼子的边缘。最后,每隔2、4、6、12 h观察小鼠筑窝情况,并用相机拍照进行记录。根据小鼠做窝的不同情况,对其做窝行为进行评分,并对得分进行比较,具体的评分标准如下,5分:95%的脱脂棉被撕碎,窝形完美,立体感强,高度高于小鼠身高50%;4分:95%的脱脂棉被撕碎,窝形扁平,高度不足小鼠身高50%;3分:大部分棉片被撕碎,但形状不规则,无法辨认出是一个窝;2分:小部分棉片被撕碎;1分:95%以上的棉片保持完好。见图1。
1.2.3海马神经元体外培养 手术器械高压灭菌。准备预冷的HBSS缓冲液及37 ℃预热的0.25%胰酶、Neurobasal培养基。用P0新生鼠,冰上取脑后,放入4 ℃预冷的HBSS缓冲液中解剖分离出海马组织。将组织剪碎后加入0.25%胰酶37 ℃消化5 min,在此期间可轻柔振荡几次。消化结束后,用含有10%胎牛血清的DMEM培养液终止消化反应,将其轻轻吹打混匀至细胞完全分散,室温下1 000 r/min离心10 min。吸去上清液,根据沉淀的细胞量加入300 μl左右的DMEM培养液重新悬浮细胞,取上述细胞悬液适当稀释后用细胞计数板进行计数。将所需密度的神经元接种于多聚-D-赖氨酸氢溴酸盐包被过的24孔板中,轻晃培养板使其混匀,置于37 ℃、5% CO2孵箱中培养。24 h后换Neurobasal培养液,第3天加入10 μmol/L阿糖胞苷来抑制胶质细胞的生长,以后每2~3 d半定量换液。
1.2.4神经元细胞转染病毒及免疫荧光实验 神经元培养到7~9 d时,转染GFP腺相关病毒2 μl(AAV-CMV-bGi-eGFP,滴度:2.24×1010)。体外继续培养到18~21 d时进行实验。室温下,将细胞用4%多聚甲醛固定20 min,用封闭液(3% BSA + 0.3% Triton X-100)封闭1 h,封闭完成后加入配制好的一抗孵育液,4 ℃过夜。次日,4 ℃取出后室温孵育30 min,然后用PBS/T漂洗,洗去一抗后加入相应的荧光二抗,室温下避光孵育2 h,再用PBS漂洗。在载玻片上滴加防荧光淬灭剂,将带有细胞的一面贴到载玻片上,用滤纸吸干多余液体,指甲油封边后置于暗盒中保存。染好后的细胞贴片用奥林巴斯激光共聚焦显微镜采集图像。
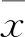
2 结果
2.1WDR1条件性敲除小鼠的基因型鉴定为了研究WDR1与精神分裂症的关系,实验利用Cre/loxP技术构建了WDR1基因条件性敲除小鼠,将CA1-Cre小鼠与WDR1flox/flox小鼠(简称WT小鼠)杂交,子代中loxP位点就有概率在Cre重组酶的作用下将4号外显子切除,得到CA1-Cre;WDR1flox/flox小鼠(简称CKO小鼠),见图2A。首先,对WT小鼠和CKO小鼠进行了初步的外观观察,发现出生2个月后的CKO小鼠和WT小鼠在外形上没有明显的区别,见图2B。接着通过海马脑片免疫荧光实验验证敲除效率,结果表明CKO小鼠的海马组织中WDR1的荧光强度明显降低(t=6.509,P<0.001,n=4),见图2C、D。表明WDR1在海马CA1区敲除成功。
2.2WDR1敲除后小鼠精神分裂样阴性症状减弱冷漠情绪是精神分裂症阴性症状的一种常见症状,做窝实验能够评价小鼠是否有冷漠样情绪。WT组(n=8)与CKO组(n=8)小鼠做窝质量在2 h时差异无统计学意义,但是在以后的4、6、12 h时,CKO组小鼠做窝评分明显高于WT组(t=-1.922、-2.335、-2.274,P=0.029、0.038、0.042)。说明海马CA1区敲除WDR1使小鼠更不容易产生冷漠样情绪。见图3。

图1 小鼠做窝实验的评分标准A: 1分;B: 2分;C: 3分;D: 4分;E: 5分
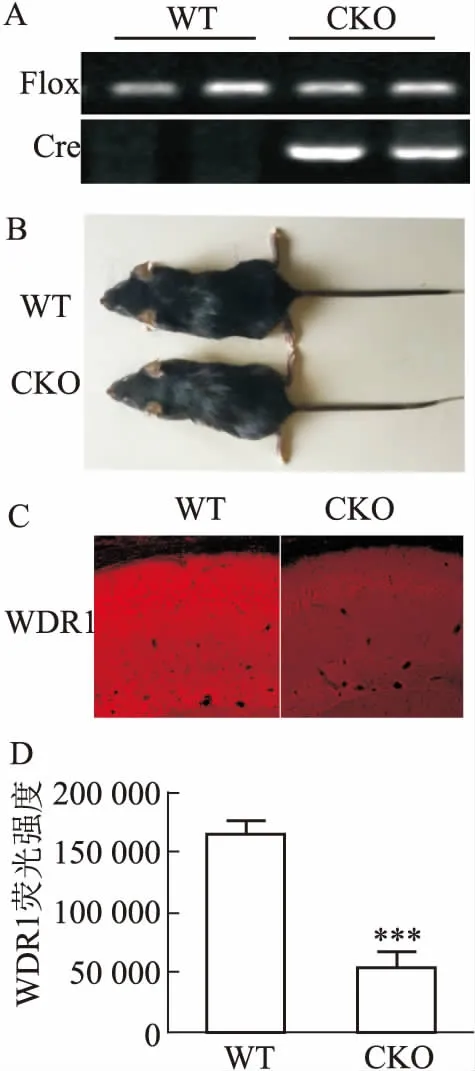
图2 WDR1条件性敲除小鼠的鉴定
A:WT与CKO组小鼠基因型鉴定结果;B:WT组与CKO组小鼠外观比较;C: 两组小鼠海马脑片免疫荧光实验结果×20;D:免疫荧光结果统计;与WT组比较:***P<0.001

图3 不同时间点小鼠做窝质量评分
A:两组小鼠分别在0、4 h做窝照片;B:A中做窝评分统计;与WT组比较:*P<0.05
2.3WDR1敲除后树突棘明显增多WDR1能够促进actin的解聚,进而减少树突棘密度,而树突棘减少是精神分裂症的主要神经病理改变,提示在海马中敲除WDR1可能对精神分裂症产生影响。通过海马神经元原代培养、病毒转染及免疫荧光染色的方法,观察CKO小鼠树突棘的形态变化。结果显示WDR1敲除后,CKO组小鼠相比于WT组,神经元的树突棘明显增多(n=23,t=6.906,P<0.001)。表明海马CA1区敲除WDR1可以增加树突棘密度,提示WDR1与精神分裂样阴性症状呈正相关性。见图4。
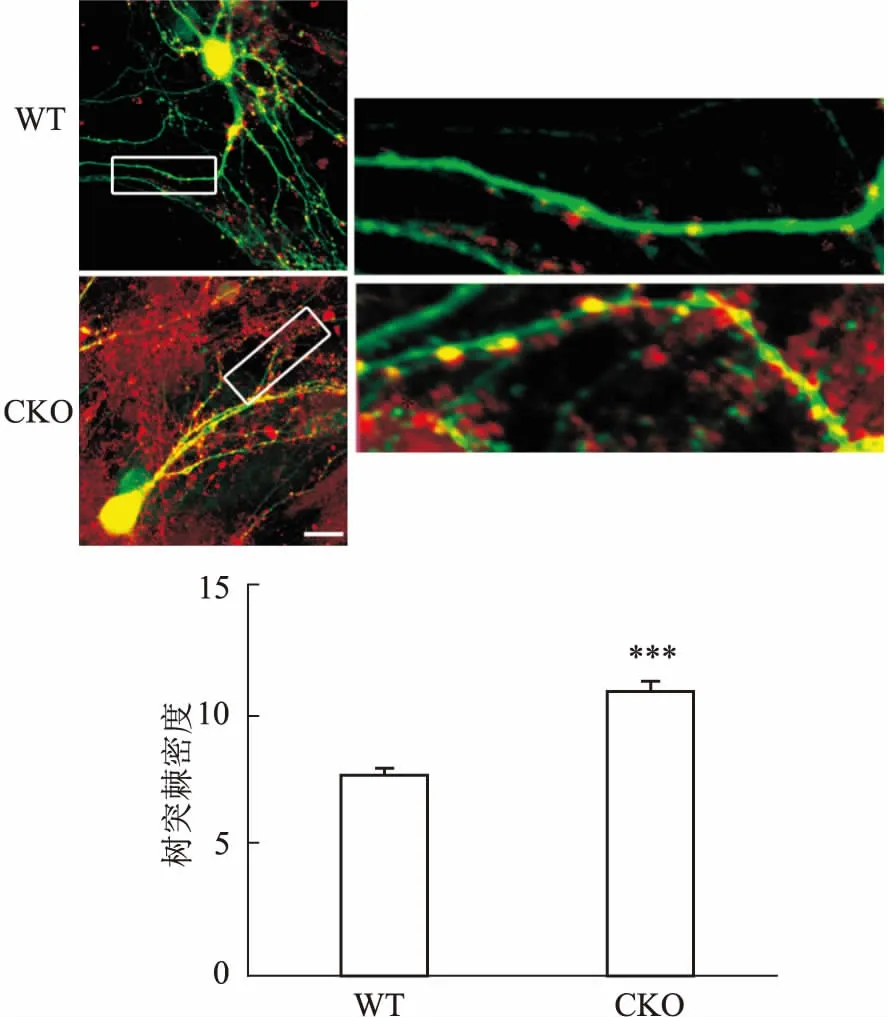
图4 海马CA1区敲除WDR1后神经元树突棘增加 免疫荧光×180
A:两组小鼠海马神经元共聚焦照片;B:两组小鼠神经元树突棘密度统计;与WT组比较:***P<0.001
3 讨论
精神分裂症的阴性症状在行为方面表现为失语症、意志力下降、快感缺乏和无法正常表达情感,在认知方面则表现为记忆力减退、执行能力下降、注意力不能集中、语言能力和阅读能力降低以及社会认知能力受损,严重影响了个人的身心健康和生活质量甚至可能危及个人的生命安全。近年来,越来越多的证据表明WDR1与精神分裂症有着密切的关系,有学者对1 162例欧美样本的全基因组进行关联分析,发现WDR1基因与精神分裂症的发病年龄相关性很大[5]。也有研究[6]显示在精神分裂症患者的前额叶皮层中WDR1蛋白表达增加。
WDR1影响actin,促进F-actin解聚,进而影响树突棘的形成,使树突棘减少。在海马CA1区条件性敲除WDR1后,小鼠海马中锥体神经元的树突棘增加。海马被公认为在记忆形成中起到核心作用,但有研究[7]表明在精神分裂症患者中海马的结构和功能也是异常的。通过对精神分裂症患者死后的脑组织进行检测,结果显示神经元树突棘的减少是最常见的神经病理改变,并且这种改变出现在海马菌丝层、额叶皮层、初级视觉皮层和颞叶皮层等多个脑区[8]。海马CA1区条件性敲除WDR1小鼠的树突棘明显增加。做窝实验是用来评价啮齿类动物的筑窝能力的行为学模型,可以反映出动物的冷漠情绪,目前做窝实验是一种可以广泛用来评价啮齿类动物精神分裂样阴性症状的动物模型[9]。在做窝模型中,CKO小鼠在做窝质量评价中也获得更高的得分,表现出更好的做窝能力。上述结果提示,WDR1与精神分裂样阴性症状有着密切的联系。
目前对于精神分裂症的研究,越来越重视海马脑区在其中的作用。海马被公认为在学习记忆中有着重要的作用。目前很多研究[10]显示在精神分裂症患者中海马结构及功能异常。在精神分裂症发病初期,海马体积缩小。除宏观的变化,有研究[11]显示精神分裂症患者的一些脑局部微观结构改变,海马的锥体细胞体积变小、密度增加,提示轴突发育过程中的突触删除以及树突棘密度减少[12]。类似的微观结构改变在前额叶、丘脑等其他脑区也有出现。除了树突棘密度的改变之外,突触的传递也会影响精神分裂症。突触蛋白是一种与突触结构和功能密切相关的蛋白,在突触的形成与传递中也起着重要作用[13],那么很可能WDR1同样也可以通过调节海马脑区树突棘密度及突触传递来对精神分裂症产生影响。
综上所述,实验结果表明WDR1很可能是通过影响actin进而改变树突棘的密度,最终调控精神分裂症的阴性症状,能够为WDR1与精神分裂样阴性症状呈正相关提供直接证据,即减弱冷漠样情绪的表型。实验结果为以后研究精神分裂症提出了一个新的思路,WDR1缺失可能能够改善精神分裂症的阴性症状,也为精神分裂症的临床治疗提供了一个新的潜在治疗靶点。
[1] van Os J, Kapur S. Schizophrenia[J]. Lancet, 2009, 374 (9690):635-45.
[2] Lei W, Omotade O F, Myers K R, et al. Actin cytoskeleton in dendritic spine development and plasticity[J]. Curr Opin Neurobiol, 2016,39:86-92.
[3] Adler H J, Sanovich E, Brittan-Powell E F, et al. WDR1 presence in the songbird basilar papilla[J]. Hear Res, 2008,240(1-2):102-11.
[4] Glessner J T, Reilly M P, Kim C E, et al. Strong synaptic transmission impact by copy number variations in schizophrenia[J]. Proc Natl Acad Sci USA, 2010,107(23):10584-9.
[5] Wang K S, Liu X, Zhang Q, et al. Genome-wide association analysis of age at onset in schizophrenia in a European-American sample[J]. Am J Med Genet B Neuropsychiatr Genet, 2011, 156B (6):671-80.
[6] Martins-de-Souza D, Gattaz W F, Schmitt A, et al. Prefrontal cortex shotgun proteome analysis reveals altered calcium homeostasis and immune system imbalance in schizophrenia[J]. Eur Arch Psychiatry Clin Neurosci, 2009, 259 (3):151-63.
[7] Hall J, Whalley H C, Marwick K, et al. Hippocampal function in schizophrenia and bipolar disorder[J]. Psychol Med, 2010, 40 (5):761-70.
[8] Moyer C E, Shelton M A, Sweet R A. Dendritic spine alterations in schizophrenia[J]. Neurosci Lett, 2015, 601:46-53.
[9] Pedersen C S, Sorensen D B, Parachikova A I, et al. PCP-induced deficits in murine nest building activity: employment of an ethological rodent behavior to mimic negative-like symptoms of schizophrenia[J]. Behav Brain Res, 2014, 273:63-72.
[10] Heckers S. Neuroimaging studies of the hippocampus in schizophrenia[J]. Hippocampus, 2001, 11 (5):520-8.
[11] Lewis D A, Sweet R A. Schizophrenia from a neural circuitry perspective: advancing toward rational pharmacological therapies[J]. J Clin Invest, 2009, 119 (4):706-16.
[12] Meyer-Lindenberg A. From maps to mechanisms through neuroimaging of schizophrenia[J]. Nature, 2010, 468 (7321):194-202.
[13] Gitler D, Takagishi Y, Feng J, et al. Different presynaptic roles of Synapsins at excitatory and inhibitory synapses[J]. J Neurosci, 2004, 24 (50):11368-80.

