全人源化PD-L1单抗功能活性及其对人肺腺癌HCC827细胞毒性作用的研究
谢庆书,束 军,陈晴晴, 胡思怡
程序性死亡受体1(programmed death receptor-1,PD-1)最初在1992年从鼠T细胞杂交瘤中分离出来[1],属于CD28分子家族,表达在活化的T细胞、B细胞、单核细胞和树突状细胞表面。PD-1有两个已知的配体,包括程序性死亡配体-1(programmed death ligand-1,PD-L1)又称B7-1或CD274和程序性死亡配体-2 (programmed death ligand-2,PD-L2)又称B7-DC或CD273[2]。PD-L1属于B7家族成员,为Ⅰ型跨膜蛋白,在正常情况下,PD-1/PD-L1通路通过负性调节免疫应答防止过度刺激和维持自身抗原的免疫耐受[3]。然而,PD-L1在肿瘤组织中的过表达,包括黑色素瘤、卵巢癌及非小细胞肺癌[4],导致肿瘤微环境中的免疫反应障碍。PD-1/PD-L1通路抑制T淋巴细胞增殖、减少细胞因子的释放,并降低T淋巴细胞活性,导致肿瘤特异性T细胞耗竭和凋亡[5]。PD-L1抗体可以抑制PD-L1与受体PD-1的相互作用解除其免疫抑制,增强T细胞的细胞毒活性从而发挥抗肿瘤作用[6]。该研究从分子及细胞水平初步验证自研PD-L1单抗的体外功能活性,为研究PD-L1类抗体提供新的思路。
1 材料与方法
1.1实验材料
1.1.1细胞 人肺癌HCC827细胞株购自美国ATCC公司,中国仓鼠卵巢癌细胞DHO-DG44(DHFR缺陷)、中国仓鼠卵巢癌细胞CHO-PD-L1-TCR及急性T细胞白血病细胞Jurkat-PD1-NFAT由安徽安科生物工程股份有限公司技术研发中心实验室馈赠。
1.1.2主要试剂 RPMI 1640培养基、DMEM培养基均购于美国Hyclone公司,胎牛血清购自美国Gibco公司,Ficoll淋巴细胞分离液购自Biosharp 公司,G418硫酸盐 (G418 sulfate)及潮霉素B (hygromycin B,Hg)购自上海生工生物工程股份有限公司,生物素标记的人PD-L1(Bio-hPD-L1)、人PD-1与鼠Fc的嵌合体(hPD-1-mFc)[7]突变体由安徽安科生物工程股份有限公司自行研制,异硫氰酸荧光素(FITC)标记的山羊抗人IgG1购自美国Sigma公司,FITC标记的山羊抗鼠IgG1购自美国Jackson公司,辣根过氧化物酶(HRP)标记山羊抗人IgG1 二抗、HRP标记链酶亲和素(简称SA-HRP)购自Thermo公司,荧光素酶试剂盒购于美国Promega 公司,ExpressPlusTM预制胶购自金斯瑞生物科技公司。以罗氏公开的PD-L1抗体Atezolizumab序列为参考,安徽安科生物工程(集团)股份有限公司自行构建未糖基化的IgG1亚型的PD-L1抗体(为方便描述简称阿特朱单抗),自研全人源化PD-L1单抗由安徽安科生物工程(集团)股份有限公司馈赠(简称自研PD-L1单抗)。
1.1.3主要仪器 FLX800UV荧光分析仪购于美国Biotek公司,超净工作台购于苏州安泰空气技术有限公司,CO2培养箱购自美国Thermo公司,流式细胞仪购自美国Beckman 公司。
1.2实验方法
1.2.1细胞培养 HCC827细胞用含10%胎牛血清的RPMI1640培养; Jurkat-PD1-NFAT、CHO-PD-L1-TCR细胞分别用含有0.5 mg/ml G418和0.1 mg/ml Hg加压的Ham's F12和RPMI1640培养基培养,细胞生长汇合度达到80%~90%时,消化传代培养,37 ℃、5% CO2培养箱内常规传代培养。
1.2.2十二烷基硫酸钠聚丙烯凝胶电泳(SDS-PAGE)鉴定两抗体纯度 转染PD-L1的CHO-DG44 细胞的上清液中含抗体,经过滤、提纯、12%ExpressPlusTM预制胶凝胶电泳、考马斯亮蓝染色。
1.2.3ELISA法测定两抗体的结合活性及阻断活性 缓冲液分别稀释hPD-L1及hPD-1-mFc铺板,100 μl/孔4 ℃冰箱铺板过夜。TPBS(含0.1% Tween20的PBS)洗涤3次,封闭剂37 ℃烘箱封闭1 h。TPBS洗涤3次,结合:封闭剂分别稀释两抗体使浓度 1 μg/ml, 3倍稀释,依次稀释8个梯度,100 μl/孔;阻断:稀释后的两抗体(8 μg/ml开始,4倍稀释)分别与Bio-hPD-L1(终浓度为50 ng/ml)预混,向96孔板加入100 μl/孔,室温震荡孵育1 h。TPBS洗3次,分别加封闭剂稀释的HRP-羊抗人Fc、HRP-羊抗鼠Fc二抗 100 μl/孔,室温震荡孵育30 min。TPBS洗3次,加入OPD显色、终止、酶标仪测定490 nm吸光值,每次实验均重复3次。
1.2.4细胞阻断实验测定两抗体的阻断活性 取对数生长期的CHO-PD-L1-TCR细胞(5×105/ml)接种于96孔板,其余孔加入等体积的PBS,CO2培养箱培养16~24 h。用含10% FBS的RPMI1640(理论buffer)培养基稀释抗体使终浓度为100 μg/ml,3倍梯度稀释,浓度依次为100.00、33.33、11.11、3.70、1.23、0.41、0.05、0.02、0.00 μg/ml。取对数生长期的Jurkat-PD1-NFAT细胞,计数、离心后用理论Buffer重悬调整细胞浓度为6.25×105/ml。弃96孔板中细胞培养上清液,分别加入稀释后自研PD-L1单抗、阿特朱单抗,其余孔加等体积PBS,室温孵育20 min后,向96孔板中加入Jurkat-PD1-NFAT,其余孔加入等体积的PBS,CO2培养箱中培养6 h后每孔加入荧光酶底物Bio-GloTMReagent,37 ℃烘箱孵育10 min后FLX800UV酶标仪上机检测其相对光单位(RLU),实验重复3次。RLU标化值=实验组相对光单位/对照组相对光单位。
1.2.5流式细胞仪检测HCC827细胞PD-L1的表达 收集 HCC827细胞5×105个,分对照组(抗体为0)和实验组,用含1%牛血清白蛋白(BSA)的PBS封闭后,加入自研PD-L1单抗(10、1、0.1、0.01 μg/ml),冰上孵育30 min,封闭液洗涤2次后,再加入FITC-羊抗人IgG二抗,重复上述洗涤3次后上流式细胞仪检测。
1.2.6细胞毒性试剂盒检测抗体ADCC效应 取对数生长期的HCC827细胞用5%FBS的无酚红RPMI1640调整细胞浓度为1×105/ml接种于圆底96孔板,每孔50 μl。自研PD-L1单抗、阿特朱单抗用培养基稀释至终浓度为1 μg/ml,4倍梯度稀释,共9个梯度,每孔加入50 μl。将昨日提取的等体积的人外周血单个核细胞(human peripheral blood mononuclear cells, PBMCs)(2×106/ml),每孔加入50 μl,6 000 r/min离心4 min,37 ℃、5% CO2的培养箱中培养5 h后,6 000 r/min离心板子4 min,取50 μl上清液至新的96孔板。每孔加入显色试剂50 μl,室温避光显色30 min,酶标仪测量490 nm吸光值。靶细胞组:设置3个复孔,每孔加入上述浓度的HCC 827细胞50 μl,然后用培养基调节体积为150 μl;靶细胞最大裂解组:设置3个复孔,每孔加入上述浓度的HCC 827细胞50 μl,收集上清液之前15 min加入细胞裂解液,使之充分裂解;效靶细胞组:设置3个复孔,为未加入抗体,用等体积的培养基替代。细胞裂解率=OD(实验组-效靶细胞组)/OD(靶细胞最大裂解组-靶细胞组)。
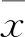
2 结果
2.1两抗体SDS-PAGE电泳分析转染PD-L1的CHO-DG44细胞,其培养上清液经过过滤、提纯后, SDS-PAGE分析结果显示,阿特朱单抗与自研PD-L1抗体经过二硫苏糖醇(DTT)还原后,由分别是45、20 ku轻重链组成,与分子为130 ku的未还原型阿特珠单抗及自研PD-L1单抗相符,见图1。

图1 阿特朱单抗及自研PD-L1抗体凝胶电泳分析
M:marker;A~D分别为未还原型阿特朱单抗、自研PD-L1单抗;还原型阿特朱单抗、自研PD-L1单抗
2.2ELISA实验中两抗体的结合与阻断活性结果表明阿特朱单抗及自研PD-L1单抗均可以与hPD-L1结合,EC50分别为7.88 ng/ml、18.86 ng/ml(图2A)。两者均可以竞争性阻断hPD-L1与hPD-1-mFc的结合,IC50分别为56.28 ng/ml和190.70 ng/ml(图2B)。自研PD-L1单抗的结合和阻断活性稍弱于阿特朱单抗。
2.3细胞阻断实验中两抗体的阻断活性利用基因工程改造的两个细胞株:CHO-PD-L1-TCR细胞分别为稳定表达PD-L1和TCR激活剂,Jurkat-PD-1-NFAT细胞含荧光素酶驱动基因NFAT并表达PD-1。当两个细胞共培养时,Jurkat-PD-1-NFAT细胞表面的TCR被CHO细胞表面的TCR激活剂激活,荧光素酶基因表达,但两细胞表面PD-L1与PD-1的结合阻断TCR信号,导致荧光素酶活性减弱。PD-L1抗体可以阻断PD-L1/PD-1抑制通路,导致TCR信号及下游荧光素酶活化。细胞阻断试验结果表明,阿特朱单抗及自研PD-L1单抗均可阻断两细胞表面PD-L1与PD-1的结合,EC50分别为0.154 8 μg/ml和0.208 5 μg/ml。如图3所示,阿特朱单抗及自研PD-L1单抗从低浓度(0 μg/ml)到高浓度(100 μg/ml)对应的RLU标化值用均数±标准差表示,两抗体在相同浓度下利用两独立样本t检验进行两两比较,各浓度组差异均无统计学意义。两个抗体EC50没有明显差异,剂量效应呈S型曲线关系。

图2 不同浓度阿特朱单抗及自研PD-L1单抗与hPD-L1的结合及两抗体阻断hPD-L1与PD-mFc结合
A:阿特朱单抗及PD-L1单抗的结合活性;B:阿特朱单抗及PD-L1单抗的阻断活性

图3 不同浓度阿特朱单抗及自研PD-L1单抗阻断两细胞表面PD-L1与PD-1的结合
2.4FACS测定人肺腺癌HCC827细胞表面PD-L1的表达以自研PD-L1单抗作为一抗,检测结果表明,在一定浓度范围内随着抗体浓度增加,荧光强度逐渐增加。表明肺腺癌HCC827细胞高表达PD-L1,自研PD-L1抗体与肿瘤细胞表面PD-L1抗原分子有特异结合,见图4。
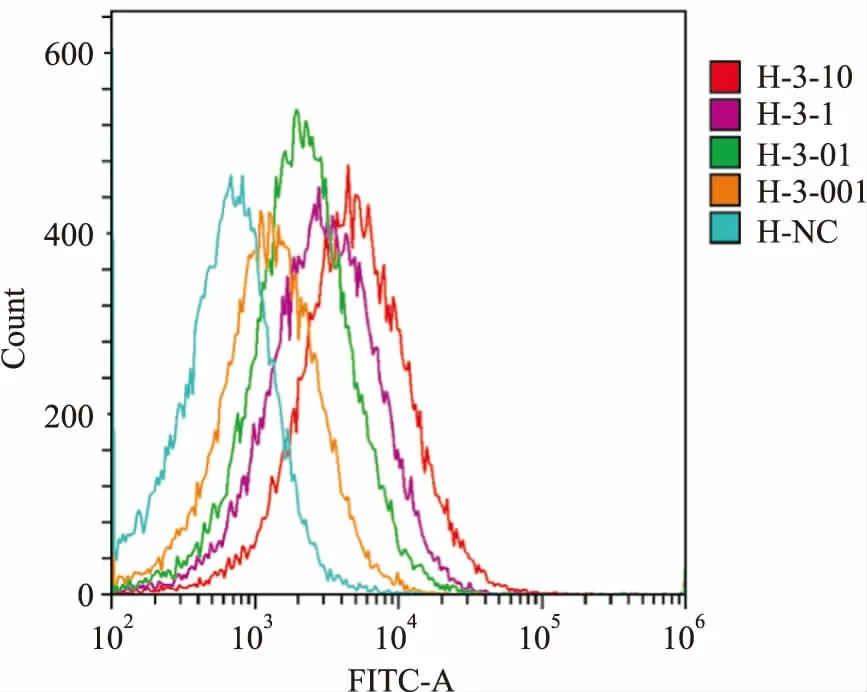
图4 HCC827细胞表面PD-L1的表达
H-NC:阴性对照;H-3-10、H-3-1、H-3-0.1、H-3-001分别指10、1、0.1、0.01 μg/ml自研PD-L1抗体对应的荧光强度
2.5细胞毒性试验中两抗体对HCC827的毒性作用效应细胞与靶细胞比值为20 ∶1时,阿特朱单抗及自研PD-L1单抗均可以介导人外周血单个核细胞对人肺腺癌HCC827细胞的杀伤活性,即有ADCC效应,并随着抗体浓度增加,杀伤活性增强,呈S型剂量效应曲线。利用单因素方差分析,分别比较自研PD-L1抗体各组(包括对照组即未加抗体组)细胞裂解率,各组之间差异有统计学意义(F=146.234,P=0.000),利用单因素方差分析比较阿特朱单抗各实验组之间裂解率,差异有统计学意义(F=196.235,P=0.000)。利用Graphpad Prism 6软件以抗体浓度对数为x轴,细胞溶解率为y轴(图5),自研PD-L1及阿特朱单抗的EC50分别为1.791 ng/ml和1.033 ng/ml。
3 讨论
在各种类型的癌症患者中,肺癌是导致患者死亡的主要原因之一,其中非小细胞肺癌占肺癌总数的85%, 5年生存率不到15%[8]。以铂类药物为基础的双药联合化疗是未提示基因突变或者易位的晚期非小细胞肺癌的一线治疗[9],反应率仅有15%~30%[10]。虽然肺癌患者有一部分亚群由特异性驱动基因的变异引起,通过分子靶向疗法一定程度可以提高患者中位生存期,然而肺癌治疗仍受限。过去人们认为肺癌是无免疫原性的肿瘤[11],然而近年来免疫治疗特别是针对免疫检查点抑制剂相关的抗体使肺癌患者获益。2015年、2016年分别针对PD-1、PD-L1的抗体:纳武单抗(novolumab)、派姆单抗(pembrolizumab)和阿特朱单抗被批准用于非小细胞肺癌的治疗。例如罗氏的阿特朱单抗被批准用于铂类为基础的初始化疗失败或进展的转移性非小细胞肺癌的二线治疗[12]。

图5 阿特朱单抗及自研PD-L1单抗介导人PBMCs对HCC827的毒性作用
PD-L1不仅可以和PD-1结合,也可以与CD80结合,而靶向PD-L1的抗体是通过阻断PD-L1与PD-1的结合而间接发挥抗肿瘤作用的,本研究中ELISA实验结果表明自研PD-L1单抗可以与hPD-L1结合,并且可以竞争性阻断hPD-L1与hPD-1的结合。有研究[13]应用基因工程设计的高表达hPD-1和AP-1驱动的荧光素酶报告基因的Jurkat/AP-1-Luc/hPD-1 细胞和表达人CD20和hPD-L1的HEK293/hCD20/hPD-L1细胞检测PD-1单抗REGN2810生物学活性。本研究用相似模型在细胞水平上进一步验证自研PD-L1单抗可以阻断两细胞表面PD-L1与PD-1的结合,并且在一定程度上表明自研PD-L1单抗可以通过阻断PD-L1/PD-1通路激活T细胞受体下游信号。
PD-L1在胃癌[14]、肺癌等多种肿瘤中高表达,胃癌组织中PD-L1的高表达与TNM分期及淋巴结转移等临床病理特征相关,提示靶向PD-L1抗体可作为肺癌潜在治疗方法。PD-L1抗体不仅可以通过抑制PD-L1/PD-1通路发挥抗肿瘤作用,ADCC效应也可以发挥抗肿瘤作用。因此,本研究细胞毒性实验表明自研PD-L1单抗及阿特朱单抗均有ADCC效应,对肺癌细胞HCC827有相似的毒性作用。虽然研究[15]显示运用来自同一供体的从外周血单个核细胞提取的NK细胞与人PBMCs相比较,纯化的NK细胞与Bavencio(Avelumab)能够产生更大的溶解活性,实验中以人PBMCs作为效应细胞验证也是可行的。
综上所述,该自研PD-L1单抗在体外有一定的功能活性,能够介导人外周血单个核细胞对人肺腺癌HCC827细胞产生毒性作用。以往被批准PD-L1单抗大多是从杂交瘤细胞获得,生产成本高并且杂交瘤细胞基因稳定性不易维持,有免疫原性。该自研抗体是从全人源噬菌体抗体库筛选和改造的,推测具有相对较低的免疫原性,然而本实验有一定的局限性,在动物和临床上的应用还有待进一步验证。
[1] Ishida Y,Agata Y,Shibahara K,et al. Induced expression of PD-1,a novel member of the immunoglobulin gene superfamily,upon programmed cell death [J]. EMBO J,1992,11(11):3887-95.
[2] Ceeraz S, Nowak E C, Noelle R J. B7 family checkpoint regulators in immune regulation and disease [J].Trends Immunol,2013,34( 11) : 556-63.
[3] Riella L V, Paterson A M, Sharpe A H,et al. Role of the PD-1 pathway in the immune response[J]. Am J Transplant,2012, 12(10):2575-87.
[4] Iwai Y, Ishida M, Tanaka Y, et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade[J]. Proc Natl Acad Sci U S A,2002,99(19):12293-7.
[5] Wherry E J. T cell exhaustion[J]. Nat Immunol,2011,12(6):492-9.
[6] Blank C, Kuball J, Voelkl S, et al. Blockade of PD-L1 (B7-H1) augments human tumor-specific T cell responses in vitro[J]. Int J Cancer, 2006, 119(2):317-27.
[7] Maute R L, Gordon S R, Mayer A T, et al. Engineering high-affinity PD-1 variants for optimized immunotherapy and immuno-PET imaging[J]. Proc Natl Acad Sci U S A,2015 ,112(47): E6506-14.
[8] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013,63(1):11-30.
[9] Aisner D L, Marshall C B. Molecular pathology of non small cell lung cancer: a practical guide[J]. Am J Clin Pathol, 2012,138(3):332-46.
[10] Schiller J H, Harrington D, Belani C P, et al. Comparison of four chemotherapy regimens for advanced non small cell lung cancer[J]. N Engl J Med ,2002,346(2):92-8.
[11] Holt G E, Podack E R, Raez L E. Immunotherapy as a strategy for the treatment of non-small-cell lung cancer[J]. Therapy,2011, 8(1):43-54.
[12] Weinstock C, Khozin S, Suzman D, et al. U.S. Food and Drug Administration approval summary: Atezolizumab for metastatic non-small cell lung cancer[J]. Clin Cancer Res,2017,23(16):4534-9.
[13] Burova E, Hermann A, Waite J,et al. Characterization of the anti-PD-1 antibody REGN2810 and its antitumor activity in human PD-1 knock-in mice[J]. Mol Cancer Ther,2017,16(5):861-70.
[14] 吴 圣,邵婧怡,王 芳,等. PD - L1 和 PD - 1 在胃癌组织中的表达及其临床意义[J].安徽医科大学学报,2015,50(6):821-4.
[15] Boyerinas B, Jochems C, Fantini M, et al. Antibody-dependent cellular cytotoxicity activity of a novel anti-PD-L1 antibody Avelumab (MSB0010718C) on human tumor cells[J]. Cancer Immunol Res,2015,3(10):1148-57.

