靶向沉默DEK对肝癌HepG2细胞增殖及细胞周期的影响
李伟伟,耿晓松,孙建伟,段树鹏,宋新文,申保生
(1.新乡医学院第一附属医院感染疾病科,河南 卫辉 453100;2.新乡医学院护理学院,河南 新乡 453003;3.新乡医学院第一附属医院科研科,河南 卫辉 453100)
DEK蛋白是一种普遍存在的可磷酸化的染色质架构蛋白[1]。目前,DEK被确认为是一种癌基因,DEK过度表达可能参与了细胞中致癌基因的突变,导致癌症的发生、发展[2]。关于DEK在肝癌细胞中的作用及功能,目前国内外文献报道尚少。因此,本研究应用RNA干扰技术下调人肝癌细胞株HepG2细胞中DEK表达,研究其表达下调对HepG2细胞增殖、细胞周期分布的影响,并探讨可能的分子机制,为治疗肝癌提供新的检测、诊断和治疗方法。
1 材料与方法
1.1材料人肝癌细胞株HepG2购自中国科学院上海细胞库,RPMI-1640培养液、胰蛋白酶、胎牛血清、LipofectamineTM2000脂质体转染试剂盒购自美国Invitrogen公司,DEK引物由南京凯基生物公司合成,抗体DEK、细胞周期素D1(Cyclin D1)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗均购自美国Santa Cruz公司,Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自美国Biovision公司。实时定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR)仪购自新加坡Life Technologices公司,流式细胞仪购自美国BD公司。
1.2方法
1.2.1细胞培养及分组HepG2细胞为贴壁细胞,置于含体积分数10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的RPMI-1640培养基中培养,每2~3 d传代1次。待细胞生长至90%融合度时分为空白对照组、小分子干扰RNA(small interfering RNA,siRNA)对照组和DEK siRNA组。空白对照组细胞正常培养,不做任何处理;siRNA对照组和DEK siRNA组细胞分别在LipofectamineTM2000脂质体介导下进行siRNA表达载体和DEK siRNA表达载体转染。
1.2.2RT-PCR检测HepG2细胞中DEKmRNA表达收集各组HepG2细胞,按照TRIzol RNA试剂盒说明书步骤操作,反转录成cDNA,然后以cDNA为模板,以荧光定量PCR的方法扩增DEK mRNA,RT-PCR检测各组细胞中DEK mRNA的表达。DEK引物序列:上游为5′-AACGTGGGTCAGTTC-AGTGGC-3′,下游为5′-TTCGCTGTTCACGCCTGACCT-3′。GAPDH引物序列:上游为5′-GCGTCG-TCGACAACGGCTC-3′,下游为5′-CAAACATGATCTGGGTCATCTTTC-3′。PCR 反应条件:95 ℃ 1 min、95 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min,共30个循环。实验重复3次,计算Ct值,采用2-△△Ct法进行计算分析。
1.2.3免疫蛋白印迹法(Westernblot)检测HepG2细胞中DEK和CyclinD1蛋白表达收集转染48 h后的各组HepG2细胞,按说明书提取总蛋白,二辛可酸(bicinchoninic acid,BCA)法测蛋白浓度。凝胶电泳后转印至聚偏二氟乙烯膜上,用含质量分数5%的脱脂牛奶于常温下封闭l h,分别加入稀释过的磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)、DEK、CyclinD1一抗,于4 ℃下孵育过夜。次日洗膜后,加入对应的第二抗体孵育90 min,增强型化学发光试剂显影、定影。采用Quantity One软件分析蛋白表达灰度值,蛋白相对表达水平为目的基因灰度值与内参基因灰度值的比值,以GAPDH为内参。
1.2.4四甲基偶氮唑盐(methylthiazolyltetrazolium,MTT)法检测HepG2细胞增殖取对数生长期HepG2细胞,按每孔5×104个细胞接种于96孔板,继续培养并进行转染,每组设4个复孔,同时设空白对照,分别于转染后24、48、72、96、120 h加入 5 g·L-1的MTT溶液 20 mL,继续培养3 h,弃去上清液,每孔加入二甲基亚砜150 μL,震荡使结晶溶解混匀后,以空白孔为对照,酶标仪490 nm波长读取各孔吸光度值,吸光度值越高,代表细胞增殖能力越强。
1.2.5流式细胞仪检测细胞周期收集转染48 h后的各组HepG2细胞,800 r·min-1离心10 min,4 ℃ 下体积分数70%乙醇固定细胞过夜,磷酸盐缓冲液洗涤3次,加入1 g·L-1核糖核酸酶(ribonuclease,RNase)200 μL,37 ℃温育30 min,加入PI染液1 mL,4 ℃避光放置30 min后进行流式细胞仪检测。
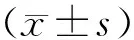
2 结果
2.13组HepG2细胞中DEKmRNA及DEK、CyclinD1蛋白表达比较结果见图1和表1。空白对照组、siRNA对照组和DEK siRNA组HepG2细胞中DEK mRNA及DEK、CyclinD1蛋白表达总体比较差异有统计学意义(P<0.05);DEK siRNA组HepG2细胞中DEK mRNA及DEK、CyclinD1蛋白表达低于空白对照组和siRNA对照组,差异均有统计学意义
(P<0.05);空白对照组和siRNA对照组HepG2细胞中DEK mRNA及DEK、CyclinD1蛋白表达比较差异均无统计学意义(P>0.05)。

1:空白对照组;2:siRNA对照组;3:DEK siRNA组。
图1转染48h后3组HepG2细胞中DEK和CyclinD1蛋白表达
Fig.1ExpressionofDEKandCyclinD1proteininHepG2cellsafter48htransfectioninthethreegroups
表13组HepG2细胞中DEKmRNA及DEK、CyclinD1蛋白表达比较
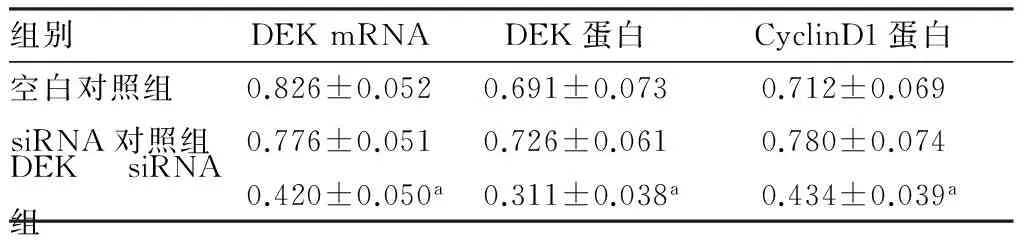
注:与空白对照组和siRNA对照组比较aP<0.05。
2.23组HepG2细胞增殖能力比较结果见表2。DEK siRNA组转染后24、48、72、96、120 h的细胞增殖能力均低于空白对照组和siRNA对照组,差异有统计学意义(P<0.05);空白对照组和siRNA对照组各时间点细胞增殖能力比较差异均无统计学意义(P>0.05)。
表23组HepG2细胞增殖能力比较
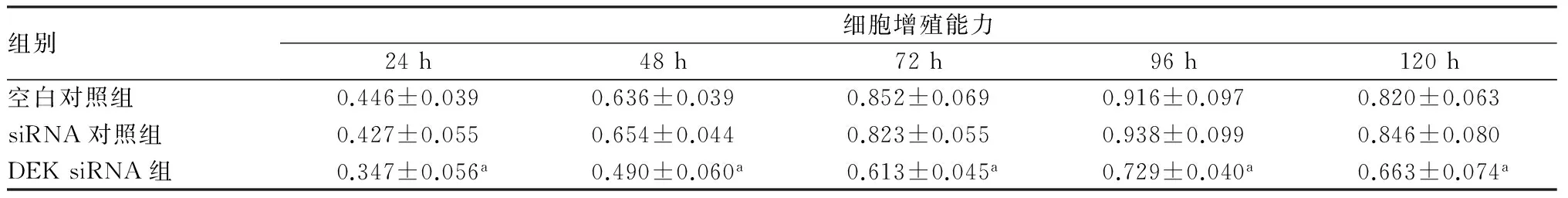
注:与空白对照组和siRNA对照组比较aP<0.05。
2.33组HepG2细胞的细胞周期比较结果见表3。DEK siRNA组G0+G1期细胞所占比例高于空白对照组和siRNA对照组,差异有统计学意义(P<0.05);DEK siRNA组S期、G2+M期细胞所占比例均低于空白对照组和siRNA对照组,差异有统计学意义(P<0.05);空白对照组和siRNA对照组G0+G1期、S期、G2+M期细胞所占比例比较差异均无统计学意义(P>0.05)。
2.4CyclinD1蛋白表达与DEKmRNA和DEK蛋白表达的相关性Pearson相关性分析结果显示,CyclinD1蛋白表达与DEK mRNA和DEK蛋白表达均呈正相关(r=0.909、0.899,P<0.05)。
表33组HepG2细胞的细胞周期分布比较

注:与空白对照组和siRNA对照组比较aP<0.05。
3 讨论
肝细胞癌(hepatocellular carcinoma,HCC)是世界第5大常见肿瘤,进展迅速,预后较差,在癌症相关病死率中排名第3[3-4]。DEK作为一种新的DNA 拓扑结构调节蛋白,位于染色体6p22.3,由375个氨基酸残基组成。人类的DEK蛋白最初发现于一种急性髓细胞系白血病,且DEK可作为自身抗原出现在系统性红斑狼疮、类风湿关节炎等自身免疫性疾病[5-6]。DEK蛋白与恶性肿瘤的发生、发展关系密切,可通过多种途径调控细胞的增殖、分化、凋亡、迁移等过程。YU等[7]研究发现,DEK在肝癌细胞系(SMMC7721、HepG2、Hep3B、MHCC97L、MHCC97H)中的表达显著高于正常肝细胞HL7702;林黎娟等[8]研究发现,HCC组织中DEK蛋白阳性表达显著高于癌旁肝组织,且HCC组织中DEK蛋白阳性表达与组织分化程度及淋巴结转移密切相关;提示DEK蛋白与HCC进展密切相关。siRNA技术是目前肿瘤基因领域常用的研究手段。本研究应用DEK siRNA转染人肝癌细胞株HepG2,结果显示,HepG2细胞中DEK mRNA和蛋白表达均下调,说明siRNA可以特异性下调靶基因的表达,进而影响细胞的生物学特性,具有高效性、特异性。
细胞癌变与增殖失控具有明确的关系,细胞周期主要分为G1、S、G2和M期,遵循G1→S→G2→M的发展规律,是细胞生命活动的基本过程,细胞一旦从G1期进入S期则可自动完成分裂过程[9]。Cyclin D1是G1期进展的限速控制因素,能够抑制细胞进入S期进行DNA复制和分裂[10]。研究表明,DEK主要在增殖活跃的细胞和癌细胞中高表达,外周血来源的正常淋巴细胞被有丝分裂原刺激增生后,DEK表达显著上调[11];乳腺癌组织和细胞系中DEK均为高表达状态[5];转移性黑素瘤中DEK表达高于良性痣[12];张彩凤等[13]应用特异性siRNA沉默胃癌SGC-7901细胞DEK表达后,通过细胞计数试剂盒检测,发现SGC-7901细胞增殖能力降低;刘岿然等[14]将表达DEK siRNA的重组质粒psiRNA-hHDEK转染宫颈癌CaSki细胞后,发现细胞增殖抑制率显著升高。本研究结果显示,特异性DEK siRNA下调HepG2细胞中DEK表达后,HepG2细胞增殖能力降低,G0+G1期细胞比率升高,S期及G2+M期细胞比率降低,与上述研究结果一致。相关性分析显示,DEK基因表达下调后,Cyclin D1基因表达出现同步下调,提示DEK siRNA可能通过抑制Cyclin D1蛋白表达而抑制肿瘤细胞的生长,但其具体机制及是否存在相关信号通路有待进一步深入研究。
[1] 刘光明,马洪顺.DEK蛋白和肿瘤关系的研究进展[J].中国肿瘤临床,2015,42(9):482-486.
[2] MATRKA M C,HENNIGAN R F,KAPPES F,etal.DEK over-expression promotes mitotic defects and micronucleus formation[J].CellCycle,2015,14(24):3939-3953.
[3] KANDA M,SUGIMOTO H,KODERA Y.Genetic and epigenetic aspects of initiation and progression of hepatocellular carcinoma[J].WorldJGastroenterol,2015,21(37):10584-10597.
[4] 罗磊,岳小变,赵宏峰,等.乙型肝炎病毒性相关性肝细胞癌患者外周血与肝癌组织 T 淋巴细胞受体谱系分析[J].新乡医学院学报,2016,33(8):686-691.
[5] PRIVETTE VINNEDGE L M,BENIGHT N M,WAGH P K,etal.The DEK oncogene promotes cellular proliferation through paracrine Wnt signaling in Ron receptor positive breast cancers[J].Oncogene,2015,34(18):2325-2336.
[6] LIN L J,CHEN L T.The role of DEK protein in hepatocellular carcinoma for progression and prognosis[J].PakJMedSci,2013,29(3):778-782.
[7] YU L,HUANG X B,ZHANG W F,etal.Critical role of DEK and its regulation in tumorigenesis and metastasis of hepatocellular carcinoma[J].Oncotarget,2016,7(18):26844-26855.
[8] 林黎娟,蔡英兰,张晓燕.肝细胞癌中DEK蛋白的表达及其意义[J].临床与实验病理学杂志,2011,27(7):778-780.
[9] RUIJTENBERG S,HEUVEL S.Coordinating cell proliferation and differentiation:antagonism between cell cycle regulators and cell type-specific gene expression[J].CellCycle,2016,15(2):196-212.
[10] HUANG X H,JIAN W H,WU Z F,etal.Small interfering RNA(siRNA)-mediated knockdown of macrophage migration inhibitory factor(MIF) suppressed cyclin D1 expression and hepatocellular carcinoma cell proliferation[J].Oncotarget,2014,5(14):5570-5580.
[11] LIN L J,PIAO J J,MA Y B,etal.Mechanisms underlying cancer growth and apoptosis by DEK overexpression in colorectal cancer[J].PLoSOne,2014,9(10):e111260.
[12] KAPPES F,KHODADOUST M S,YU L M,etal.DEK expression in mela nocytic lesions[J].HumPathol,2011,42(7):932-938.
[13] 张彩凤,董良鹏,李少华,等.DEK表达下调对胃癌SGC-7901细胞增殖和侵袭的影响[J].中华普通外科杂志,2016,31(5):415-418.
[14] 刘岿然,赵敏,张淑兰.DEK 基因沉默对宫颈癌CaSki细胞增殖和凋亡影响的研究[J].中华肿瘤防治杂志,2011,18(10):758-761.

