鸡传染性支气管炎病毒ck/CH/LHB/121042毒株的分离鉴定及分子特征研究
马得莹,姜 磊,,许丽文,,刘亮亮,,韩宗玺
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室禽传染病研究室,哈尔滨 150001)
鸡传染性支气管炎(infectious bronchitis,IB)为传染性支气管炎病毒(infectious bronchitis virus,IBV)引起的一种急性、高度接触性传染病,主要引起高传染性呼吸道、生殖器官和泌尿系统疾病[1-2]。根据传染性支气管炎临床症状和主要病变部位不同,将其分为呼吸型、生殖型、肾型和腺胃型等多种类型。任何年龄段鸡均易感染IBV,但1~4周龄鸡更敏感[3],临床症状主要表现为精神沉郁、咳嗽、呼吸困难、死亡等[4-5]。IBV可感染组织器官纤毛上皮细胞,如肾脏、生殖器官和肠神经束,产生肾炎,导致鸡生殖障碍,产蛋量下降,蛋品质降低。IBV自1980年在我国第一次出现,不同地区流行IBV类型复杂多样,不同类型毒株间交叉反应较小,对我国传染性支气管炎防控带来新挑战[6]。
IBV为冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus)代表成员[7],为单股正链RNA包膜病毒,全长约27.6 kb,IBV有两个较大开放阅读框(ORF),ORF1a和ORF1b[8],约占据病毒全基因组2/3,编码病毒复制酶,IBV含四个结构蛋白,即纤突蛋白(S)、膜蛋白(M)、核蛋白(N)和小分子膜蛋白(E),卷曲多聚体S蛋白在转录后被切割成两段,S1和S2[9],S1包含高度可变区,与病毒免疫原性、血清型、组织嗜性、致病性和遗传变异等有关[10-11]。与S1基因相比,S2基因相对较保守,其C端含疏水性氨基酸集中区,与病毒膜融合有关[12]。S1基因常用于鉴定IBV基因型相关基因。
近年我国大陆TWⅠ型毒株分离数量不断增多[13]。TWⅡ型毒株2010年在河北首次分离[14]。Xia等研究发现我国西南部地区出现QX型毒株与TWⅡ型毒株重组毒株[15]。本研究通过病料病毒分离和鉴定、全基因组测序等分析,确定该病毒基因型为TWⅡ型。进一步研究其分子特征,明确该病毒分离株遗传演化规律,为IBV流行病学调查提供理论依据,也为研制针对该流行毒株疫苗及制定有效防控IBV流行措施等提供理论基础,并可预测未来IBV毒株。
1 材料与方法
1.1 材料
1.1.1 病料
2012年采自河北省某鸡场疑似IB濒死蛋鸡肾脏。
1.1.2 SPF鸡胚
SPF鸡胚由中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.1.3 引物、载体和菌株
参照已发表的Beaudette(M95169)IBV株设计[14]19对引物用于扩增IBV全基因组序列,引物由北京六合华大基因科技有限公司合成。克隆载体pMD18-T购自宝生物工程(大连)有限公司,受体菌为大肠杆菌TG1,由本实验室保存。
1.1.4 主要试剂
Ex Taq DNA聚合酶、DNA Marker(DL2000)均购自宝生物工程(大连)有限公司,RNAiso Plus及3'-Full RACE Kit和5'-Full RACE Kit购自日本TaKaRa公司,凝胶回收试剂盒购自美国OMEGA公司,所用试剂三氯甲烷、异丙醇、无水乙醇等均为分析纯。
1.2 方法
1.2.1 病毒分离与鉴定
取病鸡肾脏于无菌2 mL EP管中,参照文献[16]方法处理组织,上清液用0.22μm微孔滤器除菌,取0.2 mL接种于9日龄SPF鸡胚尿囊腔中,37℃孵化箱孵育,弃去24 h死亡胚,无菌条件下收取72 h鸡胚尿囊液再接种鸡胚,按上述方法将病毒尿囊液在鸡胚中盲传3代后作PCR鉴定。收集第三代PCR鉴定为阳性鸡胚尿囊液1.5 mL,于4℃、12 000 r·min-1离心30 min,弃掉部分上清液,将剩余尿囊液混匀;取适量病毒尿囊液,用2%磷钨酸染色1 min,电镜下观察病毒形态。
1.2.2 病毒血凝活性测定
按常规方法制备1%鸡外周血红细胞,取各代尿囊液作血凝试验[17],检测尿囊液中是否含血凝活性病原微生物。
1.2.3 病毒RNA提取和RT-PCR鉴定
按文献[18]方法处理尿囊液,按照Trizol试剂盒说明书提取RNA,最后用30μL DEPC水溶解,储存于-70℃冰箱备用,以其为模板,以[N(+)]:5'-ACGCGGAGTAGGATCGAGGGTACA-3'和[N(-)]:5'-GACGCCCCAGCGCCAGTCATTAAA-3'为上下游引物,37℃条件下反应2 h反转录[16]。参照文献[19]PCR程序扩增病毒基因片段,病毒基因组3'末端和5'末端参照3'-Full RACE和5'-Full RACE说明书作基因扩增。目的条带回收克隆到pMD18-T中,送北京六合华大基因科技股份有限公司测序。
1.2.4 病毒ORF确定、病毒全基因组和S1蛋白基因序列分析
用GeneRunner3.0软件确定ck/CH/LHB/121042病毒分离株ORF,利用DNAStar软件中MEGALIGN程序ClustalW方法对比和分析序列,MEGA5.0最大似然法(Maximum Likelihood,ML)选取35株IBV作遗传演化分析,55株毒株S1基因作系统进化树分析,MAFFT方法比较55株毒株S1基因高变区氨基酸差异。
2 结果
2.1 病毒分离和鉴定
接种组织研磨上清液SPF鸡胚,第二代出现病变,照蛋时胚体矮小,运动缓慢,从气室端打开鸡胚可见鸡胚蜷曲成球状,伴随透明水泡,鸡胚绒毛弯曲,胚体弥漫出血,羊膜增厚并黏连在胚体上,将培养3 d病变鸡胚与培养7 d对照胚打开(见图1)。病毒颗粒在电镜下呈球形,直径80~120 nm,囊膜表面有疏松排列棒状突起,为典型冠状病毒颗粒形态学特征(见图2),将病毒分离株命名为ck/CH/LHB/121042。

图1 培养3 d病变胚(左)和培养7 d对照胚(右)Fig.1 Comparison of chicken embryo with lesion(left)and control(right)

图2 病毒粒子形态电镜观察Fig.2 Morphological observation of virusby electron-microscope
2.2 病毒分离株全基因组扩增、克隆及测序
从病毒分离株中分别扩增与预计大小相等19条目的片段,将扩增产物克隆于pMD18-T载体中,筛选阳性重组质粒,每个片段送3个独立克隆测序,确保病毒分离株每个片段基因序列准确性。
2.3 病毒分离株血凝试验
对盲传三代含病毒分离株尿囊液作血凝试验,结果显示该病毒分离株未使鸡外周血红细胞发生凝集,该尿囊液中无血凝活性的外源病毒。
2.4 病毒全基因组序列的测定及ORF推测
拼接病毒中获19个基因片段,ClustalW方法与参考毒株ck/CH/LHB/100801对比,结果显示两个毒株之间核苷酸同源性达99.9%,病毒分离株ck/CH/LHB/121042基因组特征为5'UTR-1a-1b-S-3a-3b-3c-M-5a-5b-N-3'UTR(见表1),与IBV基因组学特征相符,基因组全长27 675 bp,病毒整个基因组普遍存在碱基缺失、插入和突变,与参考毒株相比,ORF1中缺失和插入相对较多。该分离株基因组GenBank注册号为MG448607。
2.5 分离株ck/CH/LHB/121042全基因组序列分析
选择GenBank已提交34株IBV毒株作为参考,与分离株病毒全基因组作遗传演化分析,结果显示,分离株ck/CH/LHB/121042与ck/CH/LHB/100801亲缘关系最近,属TWⅡ型毒株,其次与TWⅠ毒株3375/08和TW2575/98亲缘关系较近(见图3)。

表1 ck/CH/LHB/121042推测ORFTable1 Open reading framesencoded in ck/CH/LH/121042 genome

图3 病毒分离株ck/CH/LHB/121042基因组序列系统进化树分析Fig.3 Phylogenetic analysisof isolateck/CH/LHB/121042 based on completegenomic sequenceswith IBV referencestrains
2.6 ORF1遗传特征
病毒分离株ck/CH/LHB/121042ORF1全长19934bp,包括两个开放阅读框,ORF1a和ORF1b,前者由11910个核苷酸编码3969个氨基酸残基,后者由7950个核苷酸编码2650个氨基酸残基。ck/CHLHB/121042与参考毒株ck/CH/LHB/100801具有相同“滑脱序列”,即“TTTAAAC”。与参考毒株相比,ck/CH/LHB/121042ORF1a区共缺失17个碱基,主要分布在核苷酸 875~877位、879~888位、894位、904~905位和942位,另在核苷酸10 782位有碱基序列“TTACCTATTGCTACAGTTCAATCTAAGTTGA GTGATGTAAA”插入,缺失碱基导致推导的氨基酸序列只编码917个氨基酸残基提前终止,又从核苷酸1042位开始编码;插入碱基导致推导的氨基酸序列3594~3608位连续突变8个氨基酸,病毒编码3 256个氨基酸后提前终止。ORF1b区,核苷酸12 756位插入一个碱基,核苷酸13 838~13 844位缺失6个碱基,插入碱基导致氨基酸4 252位及4 254~4 259位共7个氨基酸发生突变,ORF1b编码氨基酸提前终止;缺失碱基导致ORF1b推导的氨基酸序列4 612~4 613位缺失1个氨基酸。
2.7 ck/CH/LHB/121042主要结构蛋白基因遗传特征
ck/CH/LHB/121042分离株S基因序列测定结果表明,此分离株S基因由3492个核苷酸组成,编码1163个氨基酸残基。推测核苷酸在距离S基因起始密码子1 600位,即氨基酸534位有5个氨基酸残基“Arg-Arg-Phe-Arg-Arg”组成酶识别位点,将S基因裂解成两段,S1亚基由1614个核苷酸组成,编码含538个氨基酸残基多肽,S2亚基由1878个核苷酸组成,编码625个氨基酸残基多肽。
在系统进化树分析中,ck/CH/LHB/121042与ck/CH/LHB/100801、 ck/CH/LSD/110856、 TW2296/95、T07/02等为第Ⅱ群,S1亚基核苷酸同源性较高,且ck/CH/LHB/121042与ck/CH/LHB/100801核苷酸同源性最高,为99.9%(见图4),与其他血清型毒株S1亚基核苷酸和氨基酸对比结果(见表2)显示,ck/CH/LHB/121042分离株与TWⅡ型毒株同源性最高,分别为94.1%~99.9%和88.8%~99.6%。与参考毒株相比,ck/CH/LHB/121042S1亚基核苷酸突变为两处,均为有义突变,即发生两个氨基酸突变;S2亚基出现1个碱基位点突变,产生1个氨基酸突变。
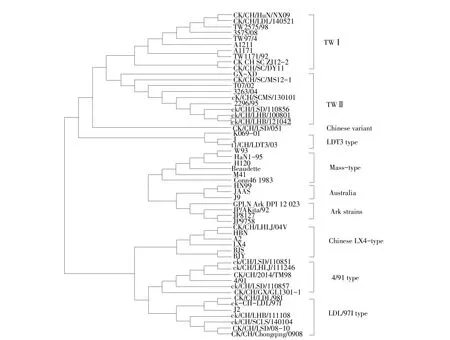
图4 ck/CH/LHB/121042病毒分离株与54个参考毒株S1基因分析Fig.4 Phylogenetic analysisof isolateck/CH/LHB/121042 based on S1 genewith 54 IBV referencestrains
MAFFT方法比较55株毒株S1基因氨基酸差异,发现此分离株有两个高变区HVR1和HVR2(见表3),HVR1为氨基酸56~85位,HVR2为氨基酸126~157位,ck/CH/LHB/121042与其他血清型之间氨基酸突变较多,与TWⅡ型毒株相比突变较少,与ck/CH/LHB/100801氨基酸完全相同,无突变。
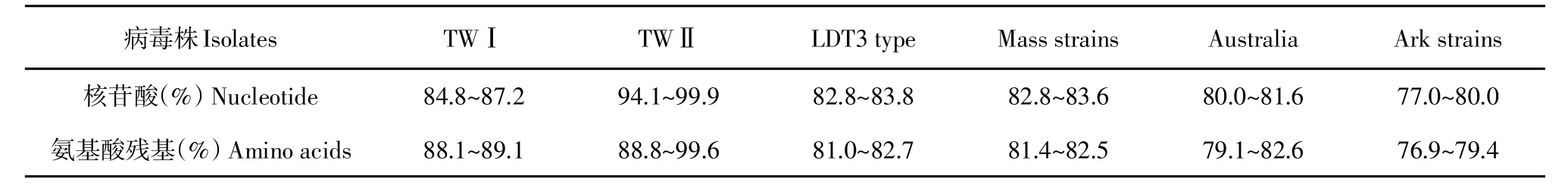
表2 ck/CH/LHB/121042与其他血清型毒株S1基因核苷酸和氨基酸残基比较Table2 Pairwisecomparison of nucleotidesand amino acidsof the S1 geneof ck/CH/LHB/121042 with other serotypestrains

表3 55株IBV毒株HVR1和HVR2突变氨基酸比较Table3 Comparison of amino acid mutation of HVR1 and HVR2 of 55 strains
ck/CH/LHB/121042分离株M基因由678个核苷酸组成,编码225个氨基酸残基组成多肽。ck/CH/LHB/121042分离株M基因与TW2296/95、ck/CH/LHB100801核苷酸同源性分别为100%和99.7%,与ck/CH/LHB/100801相比有两处碱基位点发生突变,产生两个氨基酸突变。
ck/CH/LHB/121042分离株N基因由1 230个核苷酸组成,编码409个氨基酸残基组成的多肽。与ck/CH/LHB/100801相比有一处碱基位点发生突变。ck/CH/LHB/121042分离株N基因与ck/CH/LHB/100801核苷酸同源性为99.9%。
ck/CH/LHB/121042分离株5'UTR和3'UTR分别有587和465个核苷酸,与ck/CH/LHB100801毒株5'UTR和3'UTR核苷酸同源性均为100%。

续表
3 讨 论
近年来我国IBV流行毒株复杂,存在出现突变型毒株甚至重组型毒株可能[6,9]。本研究通过病料IBV分离和鉴定、序列分析等,确定该分离株ck/CH/LHB/121042为TWⅡ型毒株。目前我国流行病学调查鲜有TWⅡ型毒株报道,但多省份出现TW型毒株,西南部地区出现QX型与TWⅡ型重组毒株等,原因不明。因此,该病毒分离株回顾性研究尤为重要,本研究可为探析新型毒株或重组型毒株出现原因及进化演变规律提供参考。
近年来,世界各地相继出现新基因型或突变型IBV,原因为病毒S1亚基点突变积累、碱基位点缺失、插入和重组等。IBV基于S1基因不同而分型,为IBV流行病学分析、分型、遗传演化研究提供依据,因此基于S1基因作系统进化树分析成为研究IBV演化有效措施[20]。本研究筛选不同血清型55株毒株对其S1基因作系统进化树分析,分离株ck/CH/LHB/121042与2010年在河北分离得到TWⅡ型毒株ck/CH/LHB/100801同源性最高,系统发育树中两者在同一分支,病毒全基因组序列经BLASTn后与ck/CH/LHB/100801核苷酸同源性为99.9%,选取34株IBV毒株作全基因组遗传演化分析,得到相同结果。以上结果表明,分离株ck/CH/LHB/121042与TWⅡ型毒株ck/CH/LHB/100801为同一基因型和血清型,两株毒株可能具有相同遗传进化规律,且与台湾地区分离病毒同源性极高,但河北省与台湾地区地理位置相对较远,推测IBV流行形势相关性可能与携带IBV禽类迁徙有关,但不排除禽类疫苗使用不当造成IBV重组。
IBV不同血清型、基因型、免疫表型间存在相关性,相同血清型毒株之间氨基酸相似度达95%以上[21],不同血清型之间则低于85%[22]。研究表明,2004年台湾地区分离株2296/92与大陆血清Ⅶ型,如CK/CH/LDL/97I,核苷酸同源性达95%以上[23],2010年分离病毒ck/CH/LHB/100801与台湾地区分离株TW2296/95核苷酸同源性为99.8%[13],说明不同地域也会出现相同或相似血清型病毒,可能与携带传染性支气管炎病毒鸟类长途迁徙有关[24]。本研究中,分离株ck/CH/LHB/121042与TWⅡ型分离株ck/CH/LHB/100801S1基因和全基因组相似度均达95%以上,S1基因2个氨基酸残基发生突变,但未使病毒分离株基因型和血清型发生变化。我国流行IBV类型复杂,基因型或血清型以LX4(QX)和自然重组TWI型为主,同时存在其他多种类型毒株以及变异株。扬州大学农业部畜禽传染病重点开发实验室在2009~2015年流行病学监测中发现,全国各地发病鸡中分离150株IBV,其中LX4型毒株105株,占总数70.0%,TWⅠ型排名第二位[25];Gao等调查研究发现,TWⅠ型IBV于2010年开始在我国河北、黑龙江、山东、吉林、辽宁等地免疫鸡群中分离,逐渐成为主要流行毒株类型,这些地区IBV流行毒株形式发生变化可能与不同地区免疫接种程序、家禽密度、饲养习惯、养殖环境等因素有关[26]。本研究从河北省分离的ck/CH/LHB/121042为TWⅡ型毒株,不属于我国主要流行毒株,一定程度上反映河北当地IBV流行形势复杂性。由于此分离株ck/CH/LHB/121042与2010年在该地分离的ck/CH/LHB/100801属同一血清型病毒,推测此型病毒出现后一直存在并普遍流行,至今是否发生更多突变或与其他病毒发生重组尚不明确,病毒是否传播至河北其他地区需进一步流行病学监控,该病毒防控和治疗有效性仍需调查。
4 结 论
本研究从河北省某鸡场蛋鸡疑似IB病鸡肾脏中分离一株IBV,命名为ck/CH/LHB/121042。通过进一步研究其分子特征等发现,ck/CH/LHB/121042分离株与ck/CH/LHB/100801同源性最高,病毒基因型为TWⅡ型。
[1] Cavanagh D.Coronavirus avian infectious bronchitis virus[J].Veterinary Research,2007,38(2):281-297.
[2] Jane K A C,Jackwood M,Jones R C.The long view:40 years of infectious bronchitis research[J].Avian Pathology,2012,41(3):239-250.
[3] Glahn R P,Robert F,Wideman J R,et al.Order of exposure to high dietary calcium and gray strain infectiousbronchitis virus alters renal function and the incidence of urolithiasis[J].Poultry Science,1989,68(9):1193-1204.
[4] Chen Y,Jiang L,Zhao W J,et al.Identification and molecular characterization of anovel serotypeinfectiousbronchitisvirus(GI-28)in China[J].Veterinary Microbiology,2017,198:108-115.
[5] Balestrin E,Fraga A P,Ikuta N,et al.Infectious bronchitis virus in different avian physiological systems-A field study in Brazilian poultry flocks[J].Poultry Science,2014,93(8):1922-1929.
[6] Han Z X,Sun C Y,Yan B L,et al.A 15-year analysis of molecular epidemiology of avian infectious bronchitis coronavirus in China[J].Infection,Genetics and Evolution,2011,11(1):190-200.
[7] 刘胜旺,刘玉芬,孔宪刚,等.鸡传染性支气管炎病毒中国分离株LH2/01/10纤突蛋白基因的遗传变异[J].中国农业科学,2004,37(2):306-312.
[8] Sawicki SG,Sawicki D L,Siddell SG.A Contemporary View of Coronavirus Transcription[J].Journal of Virology,2007,81(1):20-29.
[9] Jiang L,Zhao W J,Han Z X,et al.Genome characterization,antigenicity and pathogenicity of a novel infectious bronchitis virus type isolated from south China[J].Infection,Genetics and Evolution,2017,54(2):437-446.
[10] Casais R,Dove B,Cavanag D,et al.Recombinant avian infectious bronchitis virus expressing a heterologous spike gene demonstrates that the spike protein is a determinant of cell tropism[J].Journal of Virology,2003,77(16):9084-9089.
[11] Belouzard S,Millet J K,Licitra B N,et al.Mechanisms of coronavirus cell entry mediated by the viral spike protein[J]Viruses,2012,4(6):1011-1033.
[12] Tripet B,Howard M W,Jobling M,et al.Structural characterization of the SARS-coronavirus spike S fusion protein core[J].Journal of Biological Chemistry,2004,279(20):20836-20849.
[13] 郭明萍,王富研,吴瑞婷,等.台湾基因Ⅰ型鸡传染性支气管炎病毒SCTW株的分离鉴定及致病性研究[J].中国预防兽医学报,2013,35(8):613-617.
[14] 马会杰,马亚珍,韩宗玺,等.鸡传染性支气管炎病毒ck/CH/LHB100801株的分离鉴定及分子特征研究[J].中国预防兽医学报,2011,13(5):348-353.
[15] Xia J,He X,Yao K C,et al.Phylogenetic and antigenic analysis of avian infectious bronchitis virus in southwestern China,2012-2016[J].Infection,Genetics and Evolution Journal,2016,45:11-19.
[16] 刘胜旺,张玥,刘晓丽,等.一株鸭坦布苏病毒的分离鉴定及全基因组序列分析[J].东北农业大学学报,2013,44(3):72-78.
[17] 何秀苗,张科,秦爱建,等.I群禽腺病毒江苏分离株(FAVI_JS)的分离鉴定[J].中国预防兽医学报,2005,27(1):42-45.
[18] 刘胜旺,何秀媛,孔宪刚,等.鸡传染性支气管炎病毒中国地方分离株M基因的分子特征[J].中国预防兽医学报,2001,23(6):404-406.
[19] Liu SW,Zhang Q X,Chen J D,et al.Genetic diversity of avian infectious bronchitis coronavirus strains isolated in China between 1995 and 2004[J].Archives of Virology,2006,151(6):1133-1148.
[20] Liu SW,Chen JF,Han Z X,et al.Infectious bronchitis virus:S1 gene characteristics of vaccines used in China and efficacy of vaccination against heterologous strains from China[J].Avian Pathology,2006,35(5):394-399.
[21] Valastro V,Holmes E C,Britton P,et al.S1 gene-based phylogeny of infectious bronchitis virus:An attempt to harmonize virus classification[J].Infection,Genetics and Evolution,2016,39:349-364.
[22] Cavanagh D.A nomenclature for avian coronavirus isolates and the question of species status[J].Avian Pathology,2001,30(2):109-115.
[23]Chen H W,Huang Y P,Wang C H.Identification of Taiwan and China-like recombinant avian infectious bronchitis viruses in Taiwan[J].Virus Research,2009,140(1-2):121-129.
[24] Cavanagh D.Coronaviruses in poultry and other birds[J].Avian Pathology,2005,34(6):439-448.
[25] 张小荣,吴艳涛.禽传染性支气管炎流行动态与防控对策[J].中国家禽,2016,38(16):1-5.
[26] Gao M Y,Wang QL,Zhao W J,et al.Serotype,antigenicity,and pathogenicity of a naturally recombinant TWI genotype infectious bronchitis coronavirus in China[J].Veterinary Microbiology,2016,19:1-8.

