番茄颈腐根腐病菌分离鉴定与生物学特性研究
李景富,孙亚莉,赵婷婷,姜景彬,许向阳
(东北农业大学园艺园林学院,哈尔滨 150030)
番茄为全球主要种植蔬菜之一,但病害种类较多,发病严重,降低品质及产量。番茄颈腐根腐病,俗称“死棵病”,常见于我国山东省番茄连作大棚。分离鉴定大棚病株发现,番茄颈腐病致病菌为尖孢镰刀菌。耿丽华等在2007年鉴定出北京郊区大棚番茄病害为颈腐根腐病,病原菌为尖孢镰刀菌番茄颈腐根腐专化型,并分析病原菌菌丝生长和孢子萌发温度、pH、氮源[1]。国外对番茄颈腐病相关研究较多[2-4]。番茄颈腐根腐病已发展为破坏性极大土传病害之一,侵染后造成减产70%~83%[5]。幼苗感病初期出现老叶变黄和小叶萎缩,病原菌攻击根部和基部,使其褐变和腐烂,晚期症状表现为茎基部萎缩倒塌,根腐烂,甚至死亡[6-7],成熟植株感染表现为果成熟前期老叶边缘黄化,茎基部有明显深褐色病斑,植株纵向截面后,根茎皮层可见广布褐变斑点和腐烂现象,褐变不超过土壤线25~30 cm[8]。一些生物防治剂可有效控制温室内番茄颈腐根腐病,配合使用效果良好[9]。研究表明,选育抗病品种和选用抗性砧木嫁接栽培为最有效防治方法[10],用植物代谢物和基于植物衍生处理方法抑制颈腐根腐病,可替代某些化学物质杀菌剂如恶霉灵和苯菌灵[11-12]。
目前鲜见番茄颈腐根腐病病原菌产孢条件、致病性、生理小种研究,急需筛选有效抗病生物制剂和抗病种质资源。文章结合传统病原菌形态观察、柯赫氏证病法及rDNA-ITS序列分析方法,对番茄颈腐根腐病作病原菌鉴定,探究病菌菌丝和产孢适宜条件等基本生物学特性,为识别鉴定该病害及抗病种质资源筛选等提供科学依据。
1 材料与方法
1.1 材料
番茄品种:Moneymaker,由东北农业大学番茄研究所提供。
1.2 供试培养基
①马铃薯葡萄糖琼脂培养基(PDA培养基):马铃薯200 g,葡萄糖15~20 g,琼脂粉17~20 g,蒸馏水1 000 mL,pH为7[13]。②燕麦培养基:燕麦片30 g,琼脂粉17~20 g,蒸馏水1 000 mL[14]。③ 番茄秧汁培养基:番茄叶300 g,葡萄糖20 g,琼脂粉16 g,蒸馏水1 000 mL[15]。④查彼克培养基:KNO32.00 g,KCl 0.50 g,FeSO40.01 g,MgSO4· 7H2O0.50 g,Na2HPO41.00 g,蔗糖30 g,蒸馏水1 000 mL[14]。⑤琼脂糖培养基:葡萄糖15~20 g,琼脂粉17~20 g,蒸馏水1 000 mL[13]。
1.3 病原菌分离鉴定
1.3.1 病原菌采集
2017年4月4日、4月26日,5月14日共3次从山东温室大棚采回病株并编号,观察植株下部叶片变黄萎蔫,茎基部有成片褐色斑点并缢缩,根部部分腐烂,将茎基部横切发现韧皮部部分变褐。
1.3.2 病原菌分离
将病株茎基部感病组织和根部缢缩部分剪成小段,参考文献[13]常规组织分离法,根据实际分离情况稍加改动[13],75%酒精消毒30 s,1%升汞溶液消毒1.5 min,无菌水漂洗3次后接种至PDA培养基,25℃恒温培养。每日观察病菌生长情况。
1.3.3 病原菌纯化
从平板长出的菌落边缘挑菌丝至新PDA培养基,直至菌落均一,采用涂板纯化法,挑针挑取少许菌丝于10 mL ddH2O中摇2 min制成孢子悬液,稀释成不同浓度,灭菌枪头吸取稀释后菌液两滴于PDA平板培养基中央,消毒涂布棒将菌液均匀涂至培养基,25℃恒温培养,每日观察病菌生长情况。
1.3.4 病原菌鉴定
1.3.4.1 病原菌形态鉴定
观察25℃恒温箱中培养10 d菌落质地、形状、颜色,测量分生孢子尺寸,孢子梗长度。
1.3.4.2 分子生物学鉴定
病原菌DNA提取采取CTAB法,PCR扩增采用真菌核糖体DNA转录间隔区通用引物:
ITS1:5'-TCCGTAGGTGAACCTGCGG-3';
ITS4:5'-TCCTCCGCTTATTGATATGC-3'。
反应体系为H2O 17.8μL,Buffer 3μL,dNTP 2μL,Primer1 3μL,Primer2 3μL,DNA 模板1μL,酶0.2μL,反应总体积30μL。反应条件为95℃预变性5 min,95℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环,72℃延伸10 min。产物送北京六合华大基因科技有限公司测序,结果在GenBank数据库中对比。
1.3.4.3 柯赫氏证病法
用打孔器在菌落边缘取直径6 mm菌饼4片,放入装有150 mL PD液体培养基三角瓶中,150 r·min-1,28℃摇4 d,用无菌水将培养液稀释为浓度1.0 ×106个·mL-1孢子悬浮液。
番茄种子用75%酒精浸泡20 s,灭菌水清洗3次,待种子晾干后在温室大棚中播种于育苗盘,四叶一心时采用棉球接种法和浸根法反接[16],PD液体培养基代替孢子悬浮液作对照,其他处理相同,每日喷雾保湿,发病时采集分离纯化病原菌测序鉴定。
1.3.5 病原菌保存
保存以上鉴定为番茄颈腐根腐病病原菌菌株,将菌株接种至PDA试管培养基,室温下培养3~4 d,4℃冰箱中冷藏保存。为维持病原菌致病力,每3个月作一次继代培养重新保存[17]。
1.4 病原菌生物学特性研究
1.4.1 高温致死情况研究
菌株培养在25℃恒温箱中,采用PDA培养基,待菌落生长10 d左右时,用直径6 mm打孔器在菌落边缘取圆形菌片置于装有10 mL灭菌水试管,恒温水浴[18],温度设置为56、57、58、59、60、61、62、63、64、65℃,3次重复,1 h后挑取菌块于PDA培养基中,25℃恒温培养3 d后每日观察菌株生长情况,确定致死温度。
1.4.2 不同温度对菌丝生长影响
25℃恒温箱中菌株培养,采用PDA培养基,待菌落生长10 d用直径6 mm打孔器在菌落边缘取菌落一致圆形菌片,置于新PDA平板中央,温度设置为20、23、25、28、30、35 ℃,pH为7,5次重复,每48 h用十字交叉法测定一次菌落直径,第6天确定菌丝生长最适温度[8]。
1.4.3 不同光照对菌丝生长影响
光照设置为24 h黑暗、12 h光照12 h黑暗、24 h光照,温度为最适温度,其余操作同1.4.2,记录数据并分析。
1.4.4 不同PH对菌丝生长影响
处理培养基的pH分别调整为5、6、7、8、9、10、11、12,温度为最适温度,其余操作同
1.4.2 ,记录数据并分析。
1.4.5 不同培养基对菌丝生长影响
处理培养基采用马铃薯葡萄糖琼脂培养基(PDA)、燕麦培养基、查彼克培养基、番茄秧汁(寄主)培养基、琼脂糖培养基,其余操作同
1.4.2 ,记录数据并分析。
1.4.6 不同碳源对菌丝生长影响
将PDA培养基作为基础培养基,碳源为葡萄糖、乳糖、木糖、蔗糖、麦芽糖,用不同碳源等量替换葡萄糖并作缺碳对照,其余操作同1.4.2,记录数据并分析。
1.4.7 不同氮源对菌丝生长影响
参照韩文华等方法[19],将PDA培养基作为基础培养基,氮源为硫酸铵、尿素、甘氨酸、氯化铵、乙酸铵,按PDA培养基配方另外再加0.5%氮源并作缺氮对照,其余操作同1.4.2,记录数据并分析。
1.4.8 不同温度对产孢影响
用直径6 mm打孔器在培养10 d左右菌落边缘打取菌落一致圆形菌片,置于新PDA平板中央,温度设置为20、23、25、28、30、35℃,pH为7,3次重复,10 d后测量产孢量,参照康立功等方法将20 mL无菌水注入待测培养皿中,冲洗孢子和菌丝,磁力振荡器振荡几分钟使孢子完全释放,过滤制成孢子悬浮液,吸取一定量孢子悬浮液滴至血球计数板,显微镜观察计数分析[20]。
1.4.9 不同光照对产孢影响
光照设置为24 h黑暗、12 h光照12 h黑暗、24 h光照,温度为最适温度,其余操作同1.4.8。
1.4.10 不同pH对产孢影响
培养基pH分别调整为5、6、7、8、9、10、11、12,温度为最适温度,其余操作同1.4.8。
1.4.11 不同培养基对产孢影响
培养基采用马铃薯葡萄糖琼脂培养基(PDA)、燕麦培养基、查彼克培养基、番茄秧汁(寄主)培养基、琼脂糖培养基,温度为最适温度,其余操作同1.4.8。
1.4.12 不同碳源对产孢影响
将PDA培养基作为基础培养基,碳源为葡萄糖、乳糖、木糖、蔗糖、麦芽糖,用不同碳源等量替换葡萄糖并作缺碳对照,温度为最适温度,其余操作同1.4.8。
1.4.13 不同氮源对产孢影响
PDA培养基作为基础培养基,氮源为硫酸铵、尿素、甘氨酸、氯化铵、乙酸铵,按PDA培养基配方另加0.5%氮源并作缺氮对照,温度为最适温度,其余操作同1.4.8。
2 结果与分析
2.1 病原菌分离鉴定结果
2.1.1 病原菌分离纯化结果
分离3 d后平板中生长白色绒状菌丝如图1所示,显微镜初步鉴定为镰刀菌。涂板分离时将菌悬液继续稀释100倍单菌落较分散,效果良好,获生长均匀单一菌株。
图1 组织分离3 d后菌丝生长情况Fig.1 Mycelial growth after 3 d of tissueisolation
2.1.2 病原菌鉴定结果
2.1.2.1 病原菌生长形态鉴定结果
如图2所示,纯化获单一菌株生长较一致,菌落平铺生长,细绒毛状为圆形,淡紫红色。分生孢子较多,含质体,略透明,基本无格,长宽比2.3~6,大分生孢子两头稍尖,微弯,长度约20~25μm,小型分生孢子多为椭圆或纺锤形,长度约4~8μm。厚垣孢子为透明状球形,顶生或间生。孢子梗长度较短,生长于菌丝侧面,无分枝。根据形态特征初步鉴定为尖孢镰刀菌(见图3~4)。
2.1.2.2 分子生物学鉴定
由图5所示,目的条带约550 bp,拼接结果为542 bp,将序列上传基因库中得序列登录号为MG736729,根据在基因库中Blast结果,该病菌与尖孢镰刀菌Fusariumoxysporum亲源关系最近。

图2 病原菌生长5 d形态Fig.2 Pathogen morphology after 5 d
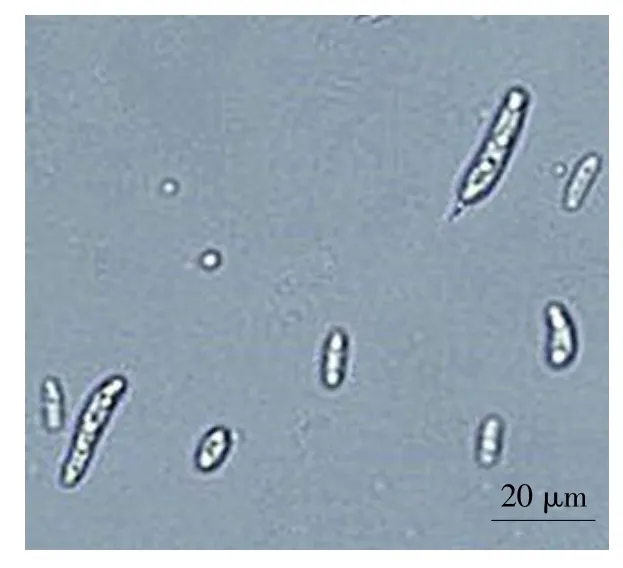
图3 大孢子和小孢子Fig.3 Megasporesand microspores

图4 厚垣孢子和孢子梗Fig.4 Cryptosporidium and sporestem
2.1.2.3 柯赫氏证病法
由图6所示,棉球接种幼苗5 d后发现茎基部有褐色腐烂,甚至发生倾倒,传统浸根方法接种幼苗发病较晚,症状表现为茎部有褐色条状凹痕,缢缩,下部叶片变黄,有气生根。对发病植株作病原菌基因组DNA提取,PCR扩增,送北京六合华大基因科技有限公司测序,发现与接种病原菌分子生物学鉴定结果一致,证明试验分离病菌为尖孢镰刀菌番茄颈腐根腐病专化型。
2.2 生物学特性
2.2.1 高温致死情况
将菌块转移至新PDA培养基生长3 d后发现56、57、58、59、60℃处理菌块均生长菌丝,61、62℃处理菌块部分生长菌丝,其余处理无变化,一周后63、64、65℃处理菌块仍未生长菌丝,证明致死温度为63℃,1 h。

图5 琼脂糖凝胶电泳检测PCR产物Fig.5 PCR product detected by agarosegel electrophoresis

图6 人工接种病原菌发病情况Fig.6 Symptomsof artificial inoculation
2.2.2 不同温度、光照、pH对菌丝生长影响
由表1可知,病原菌在20~35℃范围均可生长,28℃时菌落直径最大,说明菌丝生长最快,与其他温度处理相比差异均达极显著水平,说明28℃为该病原菌生长最适温度。
对于光照情况,病原菌在不同光照情况下均可生长,光暗交替时菌落直径最大,说明菌丝生长最快,且处理12 h光照12 h黑暗与处理24 h黑暗相比差异显著,与处理24 h光照相比差异达极显著水平,说明光暗交替12 h有利于病原菌菌丝生长。
对于不同pH情况,病原菌在pH 5~12均可生长,pH=9时菌落直径最大说明菌丝生长最快,pH=9与pH=10相比差异不显著,与pH=11、12相比差异显著,与处理pH=8、7、6、5相比差异极显著,说明病原菌菌丝在偏碱性条件下生长较好,酸性条件不利生长,pH=9有利菌丝生长。
2.2.3 不同培养基、碳源、氮源对菌丝生长影响
由表2可知,病原菌在5种培养基上均可生长,燕麦培养基上菌落直径最大,说明菌丝生长最快,其中琼脂糖培养基、查彼克培养基、PDA培养基间无差异,燕麦培养基与其他处理相比差异极显著,说明燕麦培养基利于病原菌菌丝生长。
对于不同碳源,病原菌在各处理培养基均可生长,以乳糖为碳源培养基菌落直径最大,说明菌丝生长最快,碳源乳糖和麦芽糖与缺碳对照相比差异不显著,其他碳源与对照相比差异极显著,添加不同碳源不利于病原菌菌丝生长,乳糖最利于促进菌丝生长。
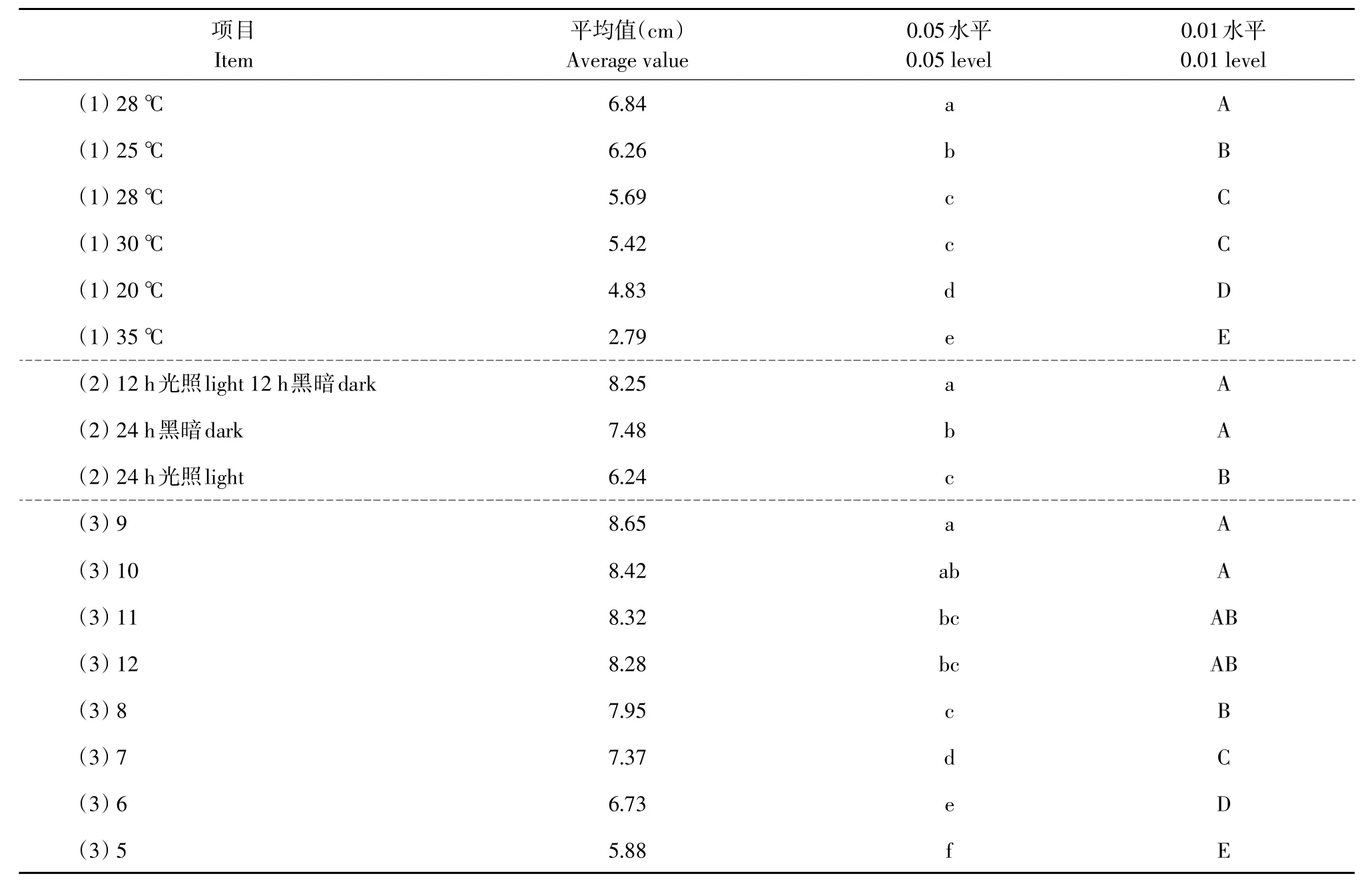
表1 不同温度、光照、p H菌丝生长差异显著性测验Table1 Significant test of differencein mycelial growth on different temperature,light and p H
对于不同氮源,病原菌各处理培养基均可生长,以甘氨酸为氮源培养基上菌落直径最大,菌丝生长最快,且与对照相比差异极显著,说明甘氨酸有利于病原菌菌丝生长。以氯化铵、硫酸铵为氮源培养基与对照相比差异极显著且菌落直径小于对照,不利于病原菌菌丝生长。
2.2.4 不同温度、光照、pH对产孢影响
由表3可知,病原菌各处理温度下均可产孢,25℃时产孢量最大,与28℃相比差异不显著,与30、23、20℃相比差异显著但未达极显著水平,与35℃相比差异极显著,说明25和28℃利于病原菌产孢。
对于不同光照,病原菌在各处理光照情况下均可产孢,24 h黑暗时产孢量最大,与24 h光照产孢量相比差异不显著,与12 h光照12 h黑暗相比差异显著,说明间断光照不利于病原菌产孢,持续黑暗条件可促进病原菌产孢。
对于不同pH,病原菌在pH 5~12培养基上均可产孢,pH=8时产孢量最大,与处理pH=6和pH=7相比差异显著,与其他处理相比差异不显著,说明不同pH对病原菌的产孢影响不大,偏碱性条件相对适宜病原菌产孢。
2.2.5 不同培养基、碳源、氮源对产孢影响
由表4可知,病原菌在5种培养基上均可产孢,PDA培养基上产孢量最大,与番茄秧汁培养基相比差异不显著,与琼脂糖培养基相比差异极显著,与其他处理相比差异显著,说明供试培养
基PDA最利于病原菌产孢。

表2 不同培养基、碳源、氮源的菌丝生长差异显著性测验Table2 Significant test of differencein mycelial growth on different medium,carbon sourceand nitrogen source
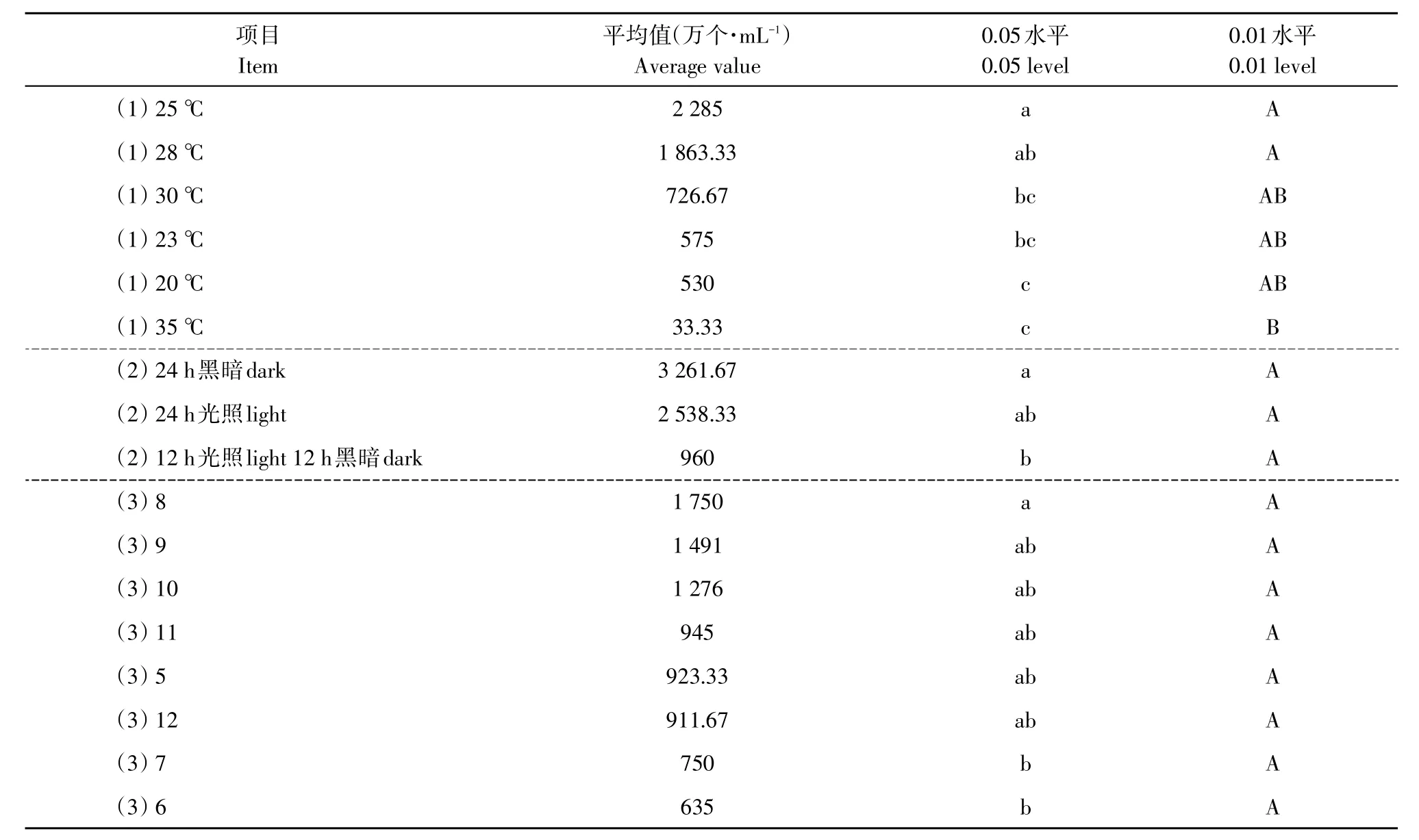
表3 不同温度、光照、p H的产孢差异显著性测验Table3 Significant test of differencein sporulation on different temperature,light and pH
对于不同碳源,病原菌在各供试碳源培养基均可产孢,葡萄糖碳源培养基上产孢量最大,与木糖相比差异显著,与其他处理相比差异不显著,说明不同碳源对病原菌产孢影响不大,木糖不利于病原菌产孢。
对于不同氮源,病原菌在各供试氮源培养基上均可产孢,以PDA(对照)培养基上产孢量最大,供试氮源和对照相比差异不显著,说明不同氮源对病原菌产孢基本无影响。

表4 不同培养基、碳源、氮源的产孢差异显著性测验Table4 Significant test of differencein sporulation on different medium,carbon sourceand nitrogen source
3 讨论与结论
文章结合多种方法鉴定山东温室大棚大面积番茄植株茎部病害,证明其为番茄土传病害颈腐根腐病,病原菌为尖孢镰刀菌番茄颈腐根腐病专化型(Fusarium oxysporum f.sp.radicis-lycopersici),与程琳等研究结果一致[21]。形态学结合分子生物学方法及人工接种验证鉴定结果真实可靠。病原菌生物学特性研究对掌握该病害发生规律,选育抗病种质资源有重要作用,本试验研究病原菌菌丝生长和产孢所需营养和环境条件,确定菌丝生长最适温度为28℃,与Benaouali等研究一致[6],产孢最适温度为25℃,耿丽华研究认为菌丝生长和孢子萌发最适温度均为25℃,产孢和孢子萌发最适温度一致。综上说明,该病原菌生长最适温25~28℃[1]。菌丝生长最适pH为9,产孢pH为8,与Rattink研究结果一致[22],表明病原菌适于偏碱性条件下生长,我国北方土壤偏碱性,病害爆发严重。研究证明光暗交替12 h有利于菌丝生长,24 h黑暗有利于病原菌产孢,真菌一般黑暗条件利于产孢[23]。菌丝生长最适培养基为燕麦培养基,碳源为乳糖,氮源为甘氨酸即有机氮,铵态氮和尿素不利于菌丝生长,与耿丽华等研究结果一致[1]。Farooq等认为葡萄糖是该病原菌最合适碳源[24],结果差异可能因所选碳源种类不同造成,后者并未明确选择乳糖作碳源,也可能是病原菌培养条件差异造成。但Farooq等研究结果与本文病原菌产孢适宜条件一致,产孢最适培养基为PDA培养基,碳源为葡萄糖[24]。综上说明病原菌菌丝生长和产孢条件相关性不大,研究应兼顾考虑这两个因素。
番茄颈腐根腐病致病菌除侵染番茄外,还危害葫芦科豆科和藜科植物[25],尖孢镰刀菌番茄颈腐根腐病专化型危害更大,应引起研究者足够重视并开发有效生物防治方法。目前认为选育抗病品种和砧木嫁接防治效果最佳[12],已筛选抗病种质资源有效标记为与单基因Frl紧密连锁保守序列位点C2-At2g38025所设计的CAPS标记C2-25[26],程琳等运用此方法鉴定田间25份种质材料[21],分子标记筛选与人工接种筛选基本一致。后续试验可利用这两种方法对各种番茄品种作有效抗病资源筛选,加快选育抗病品种进程。
明确该病害及其致病菌,可为今后山东温室大棚及其他地区该番茄病害研究和防治提供依据。番茄颈腐根腐病在我国多地均有发生,本研究仅采集山东省大棚病株鉴定存在一定局限,分离菌株较单一,是否存在其他菌类共同作用仍未可知,生理小种分化尚未明确。后续研究重点为苗期接种条件筛选[27]、病原菌侵染和传播途径、生理小种分化、抗性遗传机制及抗病育种。
[1] 耿丽华,李常保,迟胜起,等.番茄颈腐根腐病病原鉴定及不同条件对其生长的影响[J].植物病理学报,2012,42(5):449-455.
[2] Sato R,Araki T.On the tomato root-rot disease occurring under vinyl-house conditions in southern Hokkaido[J].Annual Report of the Society of Plant Protection of North Japan,1974,25:5-13.
[3] Brammall R,Lynch K.Occurrence of Fusarium crown and root rot of tomato in New Brunswick,Canada[J].Plant Disease,1990,74(12):24-28.
[4] Krikun J,Nachmias A,Cohn R,et al.The occurrence of Fusarium crown and root rot of tomato in Israel[J].Phytoparasitica,1982,10(2):113-115.
[5] Shenashen M,Derbalah A,Hamza A,et al.Antifungal activity of fabricated mesoporous alumina nanoparticles against root rot disease of tomato caused by Fusarium oxysporium[J].Pest Management Science,2017,73(6):1121-1126.
[6] Benaouali H,Hamini-Kadar N,Bouras A,et al.Isolation,pathogenicity test and physicochemical studies of Fusarium oxysporum f.sp radicis lycopersici[J].Advances in Environmental Biology,2014,8(10):36-49.
[7] Mcgovern R J,Vavrina C S,Mckay L A.Effect of transplant tray type and tomato cultivar on the incidence of Fusarium crown and root rot in tomato transplants[C].Florida State:Florida State Horticultural Society,1993.
[8] 刘蕾,王辉.番茄颈腐根腐病病原菌及抗病育种研究进展[J].长江蔬菜,2016(6):35-37.
[9] Colak A,Bicici M.Integrated disease management of Fusarium crown and root rot of greenhouse-grown tomato in eastern mediterranean region of turkey[J].Tarim Bilimleri Dergisi,2013,19(2):89-100.
[10] Thorpe H J,Jarvis W R.Grafted tomatoes escape Fusarium foot and root rot.[J].Canadian Journal of Plant Science,1981,61(4):1027-1028.
[11]Hibar K,Daami-Remadi M,Ayed F,et al.Fusarium crown and root rot of tomato and its chemical control[J].International Journal of Agricultural Research,2007,2(8):687-695.
[12] Murugesan S,Vijayakumar R,Panneerselvam A.Antifungal activity of medicinal plants against plant pathogenic fungus Fusarium oxysporum[J].Journal of Pharmacy Research,2011,4(3):843-844.
[13] 方中达.植病研究法[M].北京:中国农业出版社,1998.
[14] 韩长志.番茄灰叶斑病病原鉴定及其生物学特性研究[D].保定:河北农业大学,2007.
[15] 王晓东,李国英.哈密瓜炭腐病病原鉴定及生物学特性研究[J].石河子大学学报:自然科学版,2004,22(增1):98-100.
[16] 霍燕,张鹏,任丽娟,等.小麦茎基腐病苗期快速接种鉴定方法研究[J].江西农业学报,2010,22(8):93-96.
[17] 王迪.番茄根腐病病原菌的鉴定及抗病种质资源筛选[D].哈尔滨:东北农业大学,2007.
[18] 郭洪参,张悦丽,齐军山,等.山东花生茎腐病病原菌研究[J].中国油料作物学报,2014,36(4):524-528.
[19] 韩文华,许文奎,张英杰,等.番茄叶霉病菌形态特征鉴定及生物学特性研究[J].辽宁农业科学,1997(5):16-20.
[20] 康立功,姜景彬,李景富,等.番茄晚疫病病原菌生物学特性研究(Ⅱ)[J].东北农业大学学报,2008,39(11):168-170.
[21] 程琳,张生,李艳青,等.番茄颈腐根腐病病原菌鉴定与抗病种质材料的筛选[J].园艺学报,2016,43(4):781-788.
[22] Rattink H.Targets for pathology research in protected crops[J].Pesticide Science,1992,36(4):385-388.
[23] 张俊华,李云鹏,韩雨桐,等.黑龙江省水稻褐变穗病病原鉴定及生物学特性研究[J].东北农业大学学报,2018,49(1):3-13.
[24] Farooq S,Iqbal SM,Rauf C A.Physiological studies of Fusarium oxysporum f.sp.ciceri[J].International Journal of Agriculture and Biology,2005,7(2):275-277.
[25] Menzies J G,Koch C,Seywerd F.Additions to the host range of Fusarium oxysporum f.sp.radicis-lycopersici.[J].Plant Disease,1990,74(8):569-572.
[26] Staniaszek M,Szczechura W,Marczewski W.Identification of a new molecular marker C2-25 linked to the Fusarium oxysporum f.sp.radicis-lycopersici resistance Frl gene in tomato.[J].Czech Journal of Geneticsand Plant Breeding,2014,50(4):285-287.
[27] 王振华,孙培元,李宁宁,等.玉米苗期室内菌土接种丝黑穗病菌侵染条件的优化[J].东北农业大学学报,2015,46(1):1-5.

