番茄CIPK基因家族鉴定及生物信息学分析
王傲雪,刘思源
(东北农业大学园艺园林学院,哈尔滨 150030)
钙离子作为第二信使,广泛参与植物生长发育过程并调控外界环境胁迫刺激反应[1]。细胞质中钙离子浓度瞬时升高可能因生理过程所致,包括非生物胁迫刺激(如高温、低温、盐、干旱或渗透胁迫)、病原防御、离子平衡、生长发育等[2-3],改变细胞内钙离子时空分布[4]。植物对钙信号解码首先从钙离子感受器开始,特异刺激产生钙信号可被特异钙离子感受器感知,CBL是植物中一种钙离子感受器,可与CIPK特异互作,将钙信号传递,在植物中产生理化反应[5]。
Veronica等和Lee等分析拟南芥CIPK蛋白结构发现,拟南芥CIPK蛋白均在N端包含激酶结构域,C端包含调节结构域,其中C端调节域包括NAF结构域(与CBL蛋白特异结合)和PPI结构域(与PP2C互作)[6-7]。在无CBL蛋白结合情况下,CIPK蛋白无激酶活性,因CIPK的C端调节域抑制N端激酶域。一旦CIPK蛋白与CBL蛋白结合,CIPK C端调节域移动使激酶域显露而活化[8]。
近年来,植物中发现CBL-CIPK参与高盐、低温、干旱、营养元素、氧化胁迫、高Ph胁迫、激素信号应答等多种环境因素刺激引发的生理变化。其中CBL-CIPK参与盐胁迫SOS途径主要包括SOS1(Na+/H+antipoter)、SOS2(AtCIPK24)、SOS3(AtCBL4)3个功能蛋白,在高盐环境下SOS2和SOS3结合并磷酸化激活SOS1,SOS1从细胞质吸收质子排除钠,维持细胞内低盐环境[9]。除此,其他非生物胁迫过程中CIPK基因也发挥重要作用,拟南芥中AtCBL9-AtCIPK3和AtCBL1-AtCIPK7信号通路参与低温诱导调控[10-11];水稻中OsCIPK3可被低温诱导,上调表达[12];小麦中TaCBL4、TaCBL9、TaCIPK7、TaCIPK15、TaCIPK24、TaCIPK32参与诱导植物低温胁迫应答[13]。Yong等通过表达拟南芥CBL5基因提高其干旱胁迫抗性[14];水稻中过表达OsCIPK12后可增强其耐旱性[12]。
番茄随基因组公布已鉴定YABBY、bZIP、GRF等功能基因家族[15-17],但CIPK蛋白家族尚未报道。本研究基于番茄全基因组数据、拟南芥CIPK基因家族氨基酸序列及生物信息学常用软件,在全基因组范围内,鉴定番茄CIPK基因家族成员序列并预测生物信息学信息及作用,为揭示该家族成员生物学功能奠定基础。
1 材料与方法
1.1 番茄CIPK基因家族的鉴定及生物信息学分析
利用现有番茄注释基因的核苷酸序列(https://solgenomics.net/)与拟南芥CIPK氨基酸序列(https://www.arabidopsis.org/)作tBLASTn比对(E-value<1e-10,identity>50%),去除重复,筛选CIPK候选基因。利用Prosite网站(http://prosite.expasy.org/)鉴定候选CIPK蛋白结构域,挑选同时具有NAF和PPI结构域蛋白序列。鉴定番茄CIPK基因家族成员后用ExPASy Proteomics Sever网站(http://expasy.org/)预测所有番茄CIPK蛋白氨基酸序列蛋白质长度、分子质量、等电点。
1.2 番茄CIPK基因家族系统进化分析
为探究CIPK基因家族内进化关系,用MEGA软件,采用邻接法(Neighbor-Joining),将番茄、拟南芥、杨树、小麦、水稻、加拿大油菜CIPK基因家族分析合并系统进化,校验参数 1 000次重复。
1.3 番茄CIPKs基因结构分析
提取番茄CIPK基因CDS序列及对应基因组序列信息,运用GSDS工具分析基因结构,绘制番茄CIPK基因家族外显子-内含子结构图。
1.4 番茄CIPK基因家族顺式作用元件分析
分析启动子区域的顺式作用元件,用 UGENE软件从基因组序列中获取起始密码子上游1 500 bp基因序列,plantCARE软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)搜索顺式作用原件,确定启动子区域包含顺势作用元件。
1.5 番茄CBL、CIPK基因家族相互作用分析
以STRING软件(http://string-db.org/)分析番茄13个SlCBLs和22个SlCIPKs相互作用[18],保留可信度大于0.700相互作用关系,隐藏无相互作用蛋白。
1.6 番茄低温转录组数据中番茄CIPK表达量分析
以Reads Per Kilobase per Million mapped reads(RPKM)分析基因表达水平。计算番茄低温(4℃)胁迫下CIPK基因家族表达量,Heml绘制热图。
2 结果与分析
2.1 番茄CIPK基因家族的鉴定及生物信息学分析
经生物信息学分析,鉴定番茄中22个SlCIPK基因家族成员,除10号染色体外均有分布,其中五号染色体上分布成员最多。番茄CIPK基因家族成员氨基酸长度差异较小,变化范围为419 aa(SlCIPK14)~478 aa(SlCIPK11、SlCIPK3)。番茄CIPK成员等电点变化范围为6.21(SlCIPK22)~9.21(SlCIPK5)。在番茄CIPK基因家族中分子质量最小成员为SlCIPK15(47.6 ku),最大为SlCIPK6(57.8 ku)(见表1)。
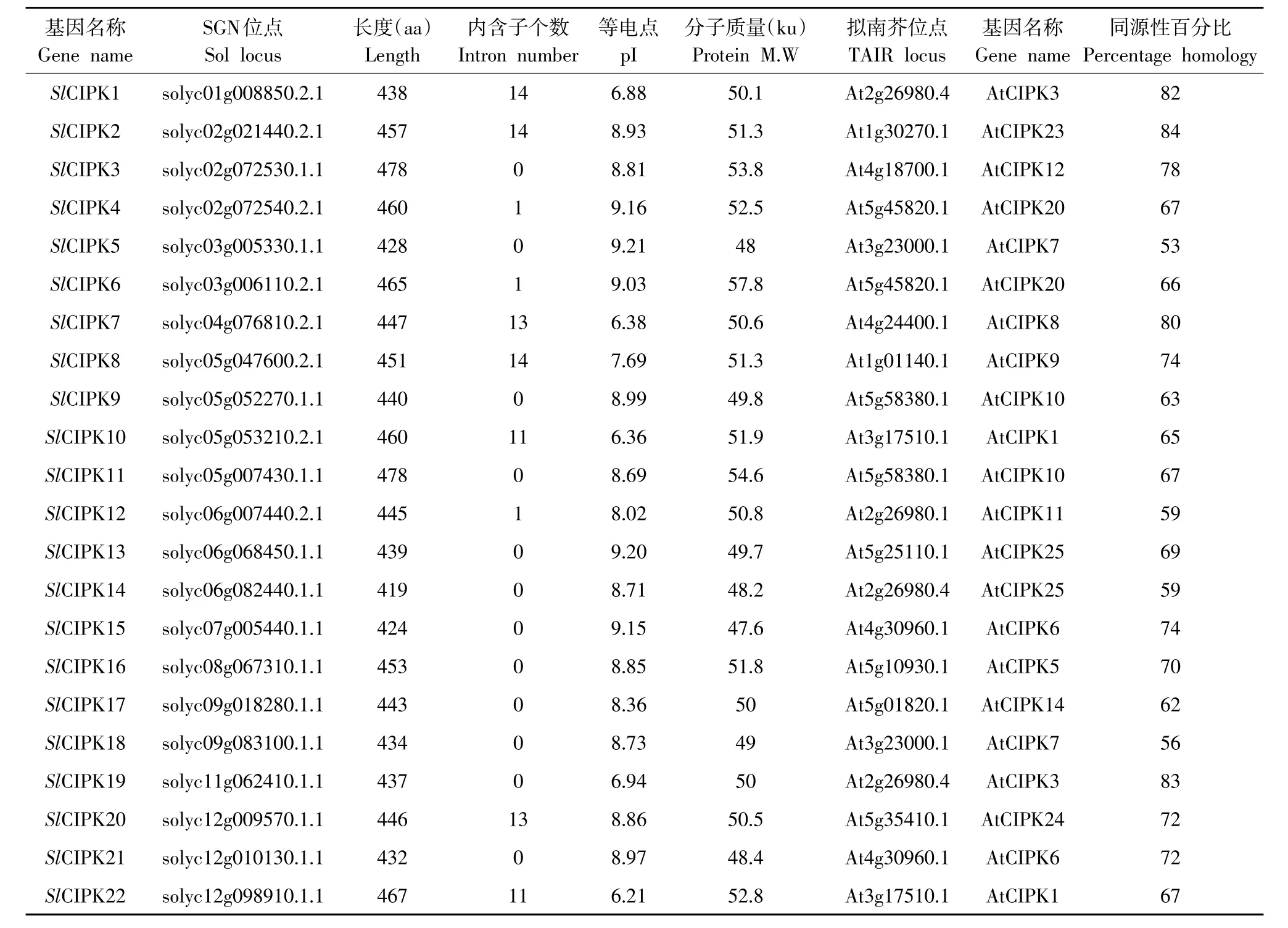
表1 番茄CIPK基因家族特征分析Table 1 Character of tomato CIPK genes
2.2 番茄CIPK基因系统进化分析
通过番茄、拟南芥、杨树、小麦、水稻、加拿大油菜组成系统进化树分析,CIPKs可分为A、B、C、D、E、F、G、H八个亚组,其中A亚组包 含 SlCIPK17、 SlCIPK14、 SlCIPK12, SlCIPK17与PtCIPK21为垂直同源基因对,SlCIPK14、SlCIPK12为平行同源基因对;B亚组中包含SlCIPK18和SlCIPK5,二者为平行同源基因对;C亚组中仅包含SlCIPK3;D亚组中包括SlCIPK16和SlCIPK13;E 亚组中 包 含 SlCIPK11、 SlCIPK9、SlCIPK4和SlCIPK6,SlCIPK4和SlCIPK6为平行同源基因对;F亚组包括SlCIPK15和SlCIPK21,二者为平行同源基因对;G亚组中的SlCIPK10和SlCIPK22也为平行同源基因对;H亚组中成员最多,番茄CIPK家族成员数量最多,包括:SlCIPK20、 SlCIPK7、 SlCIPK2、 SlCIPK8、 SlCIPK1和SlCIPK19,SlCIPK1和SlCIPK19为平行同源基因对(见图1)。

图1 CIPK家族进化树分析Fig.1 Unrooted neighborjoining phylogenetic tree of CIPK genes

图2 番茄CIPK基因外显子-内含子结构分析Fig.2 Exon-intron structure of tomato CIPK genes
2.3 番茄CIPK基因结构分析
由图2可知,番茄CIPK基因家族分为内含子富集和内含子缺失两类,其中SlCIPK9、SlCIPK11、SlCIPK15、SlCIPK21、SlCIPK13、SlCIPK16、SlCIPK3、SlCIPK17、SlCIPK5、SlCIPK18 无内含子;SlCIPK4、SlCIPK6、SlCIPK12仅1个内含子,以上成员均属于内含子缺失组;SlCIPK1、SlCIPK2、SlCIPK8含14个内含子,SlCIPK7、SlCIPK20含13个内含子,SlCIPK10、SlCIPK22含11个内含子,以上成员均属多内含子富集组。
2.4 番茄CIPK基因家族顺式作用原件分析
番茄CIPK基因家族成员上游1 500 bp存在多个与植物逆境应答相关顺式作用原件,其中77%(17/22)成员具有TC-richment顺式作用原件,说明大多数成员均与防卫和逆境应答相关;68%(15/22)成员具有HSE作用原件,说明与响应热胁迫相关;36%(8/22)成员具有LTR顺式作用原件,说明可能与冷胁迫应答相关;36%(8/22)成员具有茉莉酸甲酯应答元件;36%(8/22)成员具有BOX-W1原件说明这些基因在真菌侵染后可能发挥作用,且具BOX-W1原件的CIPK成员均有w-box原件;7个CIPK家族成员存在ABRE原件,说明32%成员可能与脱落酸应答相关;7个CIPK家族成员存在MBS原件,说明32%成员与干旱胁迫相关;仅4个基因具有TCA原件,可能与水杨酸应答相关(见表2)。
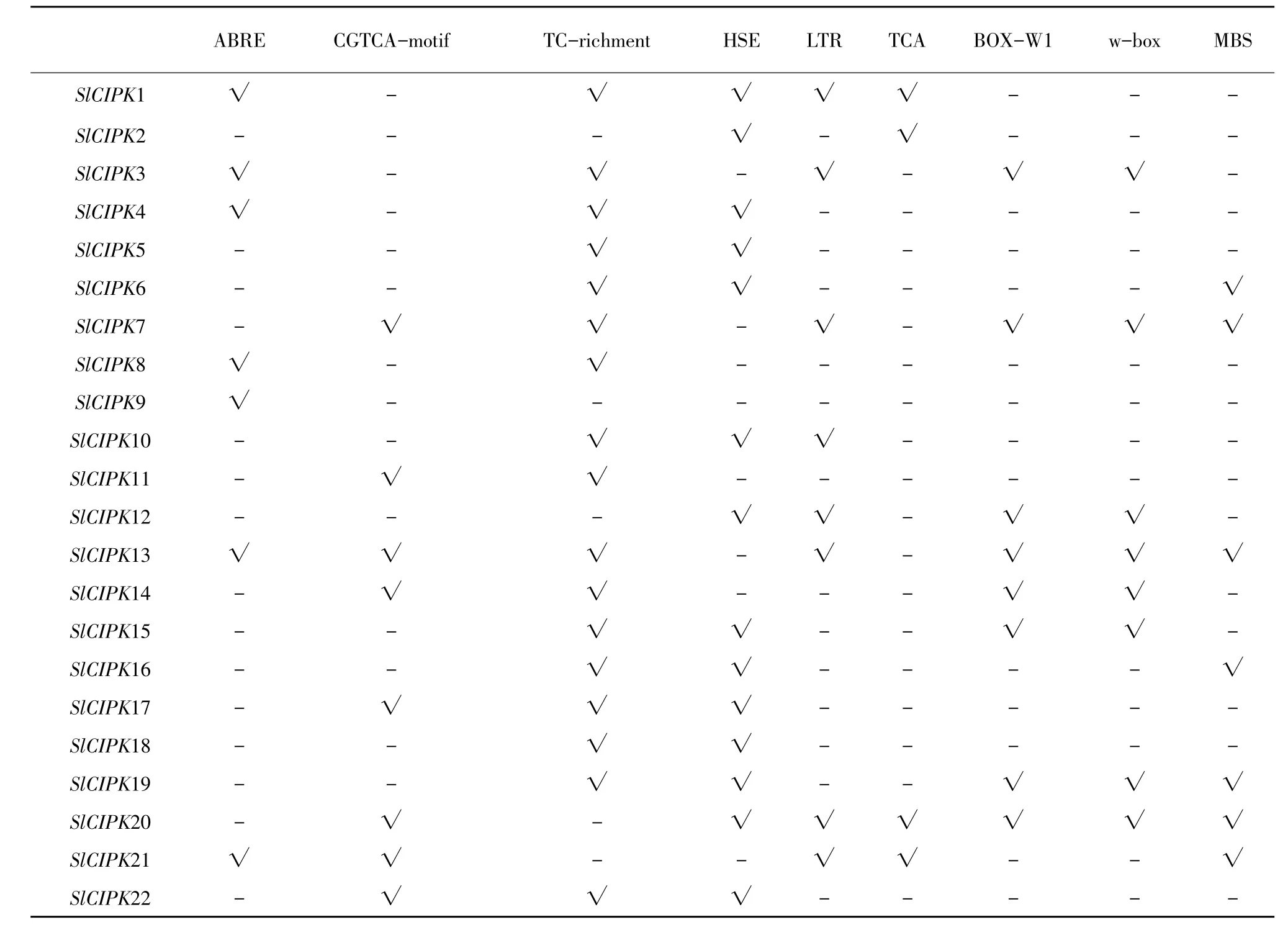
表2 番茄CIPK顺式作用元件分析Table2 Cis-elementsanalysis of tomato CIPK genes
2.5 番茄CBL、CIPK基因家族相互作用分析
由图3可知,SlCBLs与SlCIPKs间互作关系复杂,但并非所有SlCIPK和SlCBL成员参与,预测SlCIPK2、 SlCIPK14、 SlCIPK3、 SlCIPK15、SlCIPK18、 SlCIPK19、 SlCIPK11、 SlCIPK21、SlCIPK17、 SlCIPK8、 SlCIPK10、 SlCIPK12 参与CBL-CIPK互作。番茄某一CIPK蛋白可结合一个或多个CBL蛋白,同时某一CBL蛋白也可与一个或多个CIPK蛋白相互作用。
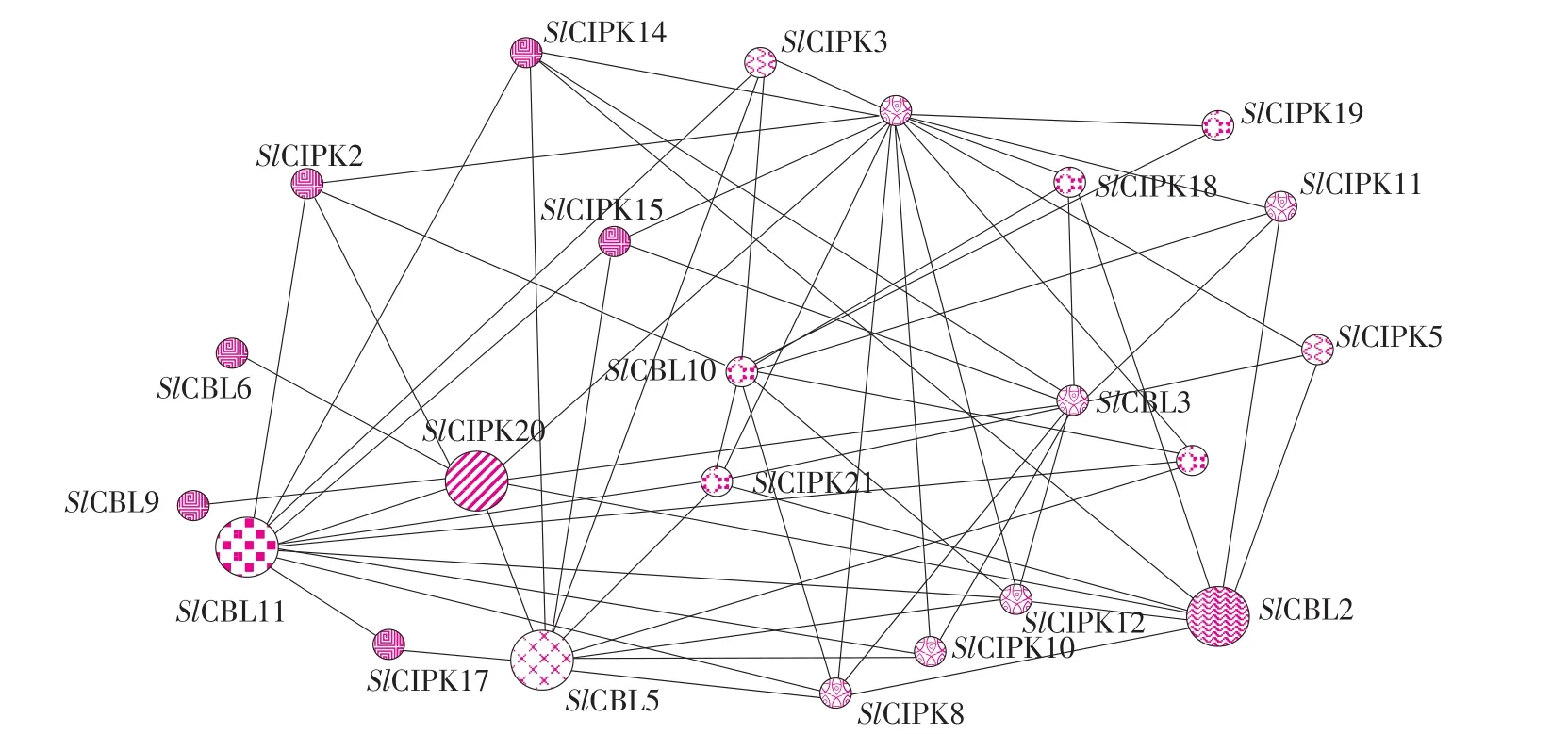
图3 SlCBLs-SlCIPKs相互作用网络Fig.3 SlCBLs-SlCIPKs interaction network

图4 番茄CIPK基因表达分析Fig.4 Expression analyses of tomato CIPK genes
2.6 番茄低温转录组数据中CIPK表达量分析
结果见图4。
由图 4可知,SlCIPK1、SlCIPK2、SlCIPK15、SlCIPK14、SlCIPK21、 SlCIPK3、 SlCIPK9、SlCIPK10、SlCIPK7、SlCIPK18、SlCIPK12、SlCIPK22 冷诱导12 h后表达量升高;SlCIPK13、SlCIPK20、SlCIPK11、SlCIPK7、SlCIPK19、SlCIPK4、SlCIPK4冷诱导后表达量几乎无变化;在番茄中SlCIPK5、SlCIPK6、SlCIPK8、SlCIPK16表达量较低。
3 讨论与结论
本研究利用生物信息学方法从番茄中鉴定22个SlCIPK基因。目前,已在多种植物中发现CIPK基因:刘淑梅等在加拿大油菜中鉴定出26个BnaCIPK26基因[18];Hanfeng等在杨树中发现27个PtCIPK基因[19];Yanhua等在小麦中鉴定出32个TaCIPK基因[20];Ting等在茄子中发现25个SmCIPK基因[21]。番茄除10号染色体外均有SlCIPK分布,氨基酸长度变化范围419~478 aa,等电点变化范围6.21~9.21,分子质量变化范围47.6~57.8 ku。由番茄、拟南芥、杨树、小麦、大米及加拿大油菜CIPK成员构建系统进化树可分为A、B、C、D、E、F、G、H八个亚组且每个亚组中均有SlCIPK分布,其中 SlCIPK12 与 SlCIPK14、 SlCIPK18 与 SlCIPK5、SlCIPK4与SlCIPK6、SlCIPK15与SlCIPK21、SlCIPK10与SlCIPK22、SlCIPK1与SlCIPK19为平行同源基因对;SlCIPK17与PtCIPK21为垂直同源基因对。SlCIPKs分为内含子富集组和内含子缺失组,与木薯 MeCIPK基因中发现一致[22]。根据基因序列内含子情况,拟南芥CIPK基因家族分为两个分支,第一种不含内含子或仅含有1个内含子,第二种CIPK蛋白激酶含有9个或以上内含子。不含内含子或仅含1个内含子CIPK基因系统发生于含9个或以上内含子基因之后,可能是第二类含9个或以上内含子基因mRNA反转录过程中,重新插入基因组而出现分支[23]。通过蛋白相互作用预测发现,1个SlCBL蛋白可与1个或者多个SlCIPK蛋白相互作用。同样,1个SlCIPK蛋白也可与1个或多个SlCBL相互作用,与木薯和辣椒中发现一致[22,24]。通过冷胁迫下转录组数据分析发现,番茄CIPK基因家族中多个成员受冷胁迫后表达量发生变化。拟南芥中AtCBL9-AtCIPK3和AtCBL1-AtCIPK7参与低温诱导调控,其中AtCIPK3基因可能通过调控CBF/DREB1转录因子基因调节抗冷基因表达[10-11]。本研究通过一系列生物信息学分析,为深入研究番茄 CIPK基因家族功能奠定基础,有待后续研究验证番茄CIPK基因家族生物学功能。
[1] Peter K H.Calcium:A central regulator of plant growth and development[J].The Plant Cell,2005,17(8):2142-2155.
[2]Dale S,Colin B,Jeffrey F H.Communicating with calcium[J].The Plant Cell,1999,11(4):691-704.
[3] Jorg K,Oliver B,Kenji H.Calcium Signals:The lead currency of plant information processing[J].The Plant Cell,2010,22(3):541-563.
[4] Antony N D,Joerg K,Dale S.The language of calcium signaling[J].Annual Review of Plant Biology,2010,61(1):593-620.
[5] Sheng L.The CBL-CIPK network in plant calcium signaling[J].Trendsin Plant Science,2009,14(1):37-42.
[6] Veronica A,Olga R,Sabine L,et al.The NAF domain defines a novel protein-protein interaction module conserved in Ca2+-regulated kinases[J].The EMBOJournal,2001,20(5):1051-1063.
[7] Lee SC,Lan W Z,Kim B G,et al.A protein phosphorylation/dephosphonylation network regulates a plant potassium channel[J].Proceedings of the National Academy of Sciences of the United Statesof America,2007,104(40):15959-15964.
[8] Yan G,Ursula H,Manabu I,Jiankang Z.Molecular characterization of functional domains in the protein kinase SOS2 that is required for plant salt tolerance[J].The Plant Cell,2001,13(6):1383-1400.
[9] Liu J,Zhu JK.A calcium sensor homolog required for plant salt tolerance[J].Science,1998,280:1943-1945.
[10] Kim K N,Cheong Y H,Grant JJ,et al.CIPK3,a calcium sensorassociated protein kinase that regulates abscisic acid and cold signal transduction in Arabidopsis[J].Plant Cell,2003,15(2):411-423.
[11] Huang C,Ding S,Zhang H,et al.CIPK7 is involved in cold respouse by interacting with CBL1 in Arabidopsis thaliana[J].Plant Science An International Journal of Experimental Plant Biology,2011,181(1):57-64.
[12] Xiang Y,Huang Y,Xiong L.Characterization of stress-responsive CIPK genes in rice for stress tolerance improvement[J].Plant Physiology,2007,144(3):1416-1428.
[13] Tao S,Yan W,Meng W,et al.Identification and comprehensive analyses of the CBL and CIPK gene families in wheat(Triticum aestivum L.)[J].BMCPlant Biology,2015,15:1-17.
[14] Yong H C,Sun J,SungBeom-Gi K,et al.Constitutive overexpression of the calcium sensor CBL5 confers osmotic or drought stress tolerance in Arabidopsis[J].Molecules&Cells,2010,29(2),159-165
[15] 陈秀玲,刘思源,孙婷,等.番茄YABBY基因家族的生物信息学分析[J].东北农业大学学报,2017,48(10):11-19.
[16] 张珍珠,陈秀玲,王沛文,等.番茄bZIP基因家族的系统进化分析[J].东北农业大学学报,2014,45(9):47-55.
[17] 袁岐,张春利,赵婷婷,等.番茄GRF转录因子家族的生物信息学分析[J].分子植物育种,2017,15(8):2949-2956.
[18] 刘淑梅,王施慧,刘明毓,等.番茄CBL家族基因的鉴定和遗传进化分析[J].分子植物育种,2015,13(10):2268-2273.
[19] Hanfeng Z,Bo Y,Wuzhen L,et al.Identification and characterization of CBL and CIPK gene families in canola(Brassica napus L)[J].BMCPlant Biology,2014,14:1-24.
[20] Yanhua Y,Xinli X,Weilun Y,et al.Comparative genomic analysis of CIPK gene family in Arabidopsis and Populus[J].Plant Growth Regulation,2007,52(2):101-110.
[21] Jing Li,Ming min J,Li R,et al.Identifcation and characterization of CBL and CIPK gene families in eggplant(Solanum melongena L.)[J].Mol Genet Genomics,2016,291(4):1769-1781.
[22] Wei H,Zhiqiang X,Yan Y,et al.Genome-widegene phylogeny of CIPK family in cassava and expression analysisof partial droughtinduced genes[J].Frontiersin Plant Science,2015,6:1-15.
[23] Estelle M H,Catherine W M C,Michael G,et al.The Arabidopsis CDPK-SnRK superfamily of protein kinases[J].Plant Physiology,2003,132(2):666-680.
[24] 刘思源,黄海锋,王旭东,等.辣椒全基因组中CBL、CIPK基因家族的鉴定及特性分析[J].分子植物育种,2017,15(8):2977-2985.

