黄瓜CsCBS克隆及其对霜霉病和棒孢叶斑病抗性功能的初步验证
秦智伟,王奕童,刘 东,辛 明,周秀艳
(1.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学园艺园林学院,哈尔滨 150030)
黄瓜(Cucumissativus L)属于葫芦科一年生蔓生或攀援草本植物,生长发育期内受真菌、细菌等病原菌侵染,导致产量及品质下降。化学药剂防治不仅增加生产成本、污染环境、影响食品安全,且导致病原菌抗药性,因此选育及利用抗病品种十分必要。
黄瓜霜霉病和棒孢叶斑病是黄瓜生产中主要病害,分别由藻界卵菌门古巴假霜霉菌〔Pseudoperonospora cubensis(Berk.&M.A.Curtis)Rostovzev〕和 多 主 棒 孢 霉〔Corynespora cassiicola(Berk &Curt,Wei)〕侵染引起叶部病害,严重时可造成黄瓜减产60%以上。
丁国华,孟攀奇等认为黄瓜霜霉病抗性由1个隐形基因控制[1-2]。也有多个隐性基因参与调控黄瓜霜霉病抗性,张素勤等发现霜霉病抗性由2对主基因控制[3];Kozik等研究表明霜霉病抗性由多基因决定[4]。目前,有关黄瓜棒孢叶斑病抗性基因研究较少,Adam等认为黄瓜抗棒孢叶斑病由1对显性基因控制[5];王惠哲等发现1对隐形单基因控制黄瓜棒孢叶斑病[6];Wang等发现由单隐性基因控制黄瓜棒孢叶斑病[7]。
挖掘抗性基因可为黄瓜霜霉病和棒孢叶斑病的双抗分子机制研究提供理论依据。Bateman根据胱硫醚β合成酶(cystathionine beta synthase,CBS)命名CBS结构域[8]。CBS结构域具有多种功能,如氯离子通道、蛋白间相互作用、细胞内离子强度、细胞质靶向与细胞能量状态传感器等[9],CBS结构域调节相关酶和转运蛋白结构域活性,响应腺苷与分子结合,如AMP、ATP或S-腺苷甲硫氨酸[10]。CBS结构域通常存在于酶促、膜转运蛋白或DNA结合活性蛋白质中,但仅含CBS结构域蛋白质也存在于原核生物中。独立CBS结构域蛋白可能与其他蛋白(如激酶)结合形成复合物并相互作用[11]。
目前CBS结构域集中于人类相关疾病,如含CBS结构域PRL-2-CNNM3蛋白复合物可抑制乳腺癌增殖和肿瘤生长[12],CBS结构域发生突变引起各种严重疾病,包括高胱氨酸尿症,肥厚性心肌病和色素视网膜炎[13]。PCS中发现CBS结构域大部分错义突变导致家族性心室预激综合征,引起传导缺陷和心脏肥大[14],但CBS结构域蛋白在植物中作用研究成果有限。
本研究在前期转录组测序基础上[15],筛选10个基因(在抗病品种中上调表达基因且在感病品种中下调表达或无差异表达基因),包含果胶裂解酶基因、蛋白激酶家族基因、BAG家族基因、CBS结构域蛋白基因、赤霉素调节蛋白基因、ERF转录因子、bHLH157转录因子、锌指蛋白基因、钙调素蛋白基因和CCT基序蛋白基因,挑选含有CBS结构域基因Csa6M496430.1,命名为CsCBS。通过CsCBS作克隆及功能验证,明确该基因在黄瓜霜霉病和棒孢叶斑病抗性中作用,旨在为黄瓜双抗分子机理研究及黄瓜多抗品种选育奠定基础。
1 材料与方法
1.1 材料
选取抗病品种‘D9320’和感病品种‘D0401’作为试材[16],种子由东北农业大学园艺园林学院黄瓜课题组提供。
1.2 接种方法
1.2.1 菌悬液配制
霜霉病菌菌悬液制备:于2016年6月黄瓜生长季节,在东北农业大学园艺试验站黄瓜大棚中采集黄瓜霜霉病病叶。用毛刷将霜霉病菌刮至无菌水烧杯中,血球计数板计数配制接种悬浮液。
棒孢叶斑病菌菌悬液制备:将黄瓜棒孢叶斑病菌于PDA培养基培养,28℃恒温黑暗培养7 d。无菌水冲洗分生孢子,无菌纱布过滤菌丝,血球计数板计数配制孢子悬浮液。
1.2.2 接种处理
接种处理分为单一接种棒孢叶斑病菌、霜霉病菌和同时接种两种病原菌共3个处理,具体参见文献[17]。
培养条件均为接种后保湿24 h,白天光照26℃/16 h,夜晚黑暗18℃/8 h,设置清水为对照组。分别在接种后2、4、8、12、24、36、48、72、96、120 h取样,液氮处理后于-80℃冰箱中保存备用。
1.3 CsCBS基因克隆及生物信息学分析
在前期转录组测序基础上[16],选择与对照相比在抗病品种中表达上调的差异基因,在感病品种中无差异表达基因Csa6M496430.1。在黄瓜基因组数据库中确定该基因CDS序列,利用primer5.0设计引物(见表1),用蛋白质保守结构域NCBI CDD数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析CsCBS作蛋白质保守结构域。MAGE5.10软件以邻近法构建系统进化树。
1.4 表达模式分析
以在线软件https://www.genscript.com/tools/realtime-pcr-tagman-primer-design-tool作引物设计,所用引物见表1,参照基因为CsEF1α(GenBank Accession Number:XM_004138916),试验共3次生物学重复,相对表达量以2-ΔΔCT相对定量分析方法计算,student t检验作样本比较,“*”代表对应柱值与对照柱值差异显著,“**”代表对应柱值与对照柱值差异极显著。
1.5 CsCBS亚细胞定位
构建CsCBS与GFP融合表达载体,设计带有HindⅢ和Bam HⅠ酶切位点引物(见表1),扩增获去掉终止密码子CsCBS开放读码框。构建pEASYT3-CsCBS载体,转化Trans1-T1于大肠杆菌中并鉴定测序,将pEASY-T3-CsCBS瞬时表达载体质粒和pGII-eGFP载体质粒用快速内切酶 HindⅢ和Bam HⅠ双酶切,胶回收得纯化产物,将目的基因片段与载体片段用 T4连接酶连接,获得融合表达载体 35S-CsCBS-eGFP,转化Trans1-T1于大肠杆菌中并鉴定。
原生质体提取及转化过程参照文献[18]。以激光共聚焦显微镜(TCS SP2 Leica,德国)观察。
1.6 黄瓜遗传转化
使用克隆全长引物(见表1),以pEASY-T3-CsCBS质粒为模板PCR扩增目的基因, PCXSN-1250载体以XcmⅠ单酶切。T4连接酶连接目的片段与载体,转化大肠杆菌。通过菌液PCR及测序鉴定构建PCXSN-CsCBS过量表达载体,冻融法将构建的过量表达载体转入根癌农杆菌LBA4404中。
运用文献[19]中黄瓜遗传转化技术,抗性及浓度为草丁膦100 mg·L-1,转化黄瓜子叶。PCR及qPCR技术对转基因植株作分子鉴定[19]。
1.7 转基因植株表型鉴定
qRT-PCR技术对过表达CsCBS株系作CsCBS表达分析。选择3株表达量最高转基因植株真叶接种处理,分别接种棒孢叶斑病菌(孢子浓度为1.0×105个孢子·mL-1)和霜霉病菌(孢子囊浓度为2.0×103个孢子囊·mL-1)。培养条件为接种后保湿24 h,白天光照26℃/16 h,夜晚黑暗18℃/8 h。非转基因植株作对照。叶片病害症状使用Nikon D5500相机拍摄,分级标准参照文献[17]。测定过表达植株生理指标,硫代巴比妥酸方法测定丙二醛,蒽酮比色法测定可溶性糖[20]。用单因素试验作统计分析,“*”代表对应柱值与对照柱值差异显著,“**”代表对应柱值与对照柱值差异极显著。
2 结果与分析
2.1 CsCBS基因克隆及序列分析
利用RT-PCR技术,以接种后‘D9320’黄瓜叶片提取RNA,反转为cDNA克隆CsCBS基因CDS区全长。CsCBS基因包含一个1 263 bp开放阅读框,编码420个氨基酸,含有1个CBS结构域和1个DUF结构域(见图1),起始密码子ATG,终止密码子TAG。具有CBS结构域蛋白存在于水稻和拟南芥中,根据CBS结构域数量分为两大类,其中一类仅含1个CBS结构域,根据所含其他结构域种类分为 CBSX; CBSDUF; CBSDUFCH; CBSCLC;CBSSIS;CBSPPR;CBSIMPDH 。另一类包含两个CBS结构域,分为CBSCBS和CBSPB1[9]。用MAGE5.10软件,将序列作多重比对并以邻近法构建系统进化树。由图2可知,CsCBS属于CBSDUF成员。

表1 引物序列Table1 Primer sequence
2.2 两种病原菌胁迫下CsCBS表达模式分析
在抗病品种‘D9320’和感病品种‘D0401’中,CsCBS对病原菌胁迫响应模式不同。如图3a所示,在抗病品种‘D9320’中,单一接种霜霉病、棒孢叶斑病菌及同时接种2种病原菌3个处理下,从接种2~24 h,CsCBS表达量均显著高于对照,为表达量高峰期。其中,单一接种棒孢叶斑病菌处理一直处于高表达水平,高于对照12~16倍;同时接种2种病原菌处理在4 h时表达量最高,为对照57倍,24 h开始显著下降,至72 h仍显著高于对照。36~120 h,两单一处理表达量显著下降,与对照处于相同水平。由图3a可知,CsCBS对棒孢叶斑病菌响应更强烈,且持续时间长,2~12 h极显著高于对照。
感病品种‘D0401’在病原菌胁迫下,CsCBS基因表达量(见图3b)仅在4 h单一接种霜霉病菌时显著高于对照,其余时间均低于对照或与对照持平,表达量极低,近似直线。

图2 CsCBS进化分析Fig.2 Phylogenetic analysis CsCBS

图3 CsCBS在抗感品种不同接种处理下相对表达量Fig.3 Relativeexpression of CsCBS under different inoculation treatmentsin resistant and susceptible varieties
通过比较图3a和b可知,CsCBS在抗病品种‘D9320’与感病品种‘D0401’中表达模式存在差异。抗病品种‘D9320’中CsCBS表达先高后低,2~24 h处于高表达状态,36~120 h除单一接种棒孢叶斑病菌处理外,其余表达量低且平稳;在感病品种‘D0401’中,CsCBS表达量低于对照或与对照持平,始终处于低水平。
2.3 CsCBS亚细胞定位
将CsCBS-GFP融合表达载体和GFP空载体分别转入拟南芥原生质体中,在共聚焦显微镜下观察,结果显示CsCBS-GFP绿色荧光分布于细胞质中(见图4),证明CsCBS属于细胞质蛋白。

图4 CsCBS蛋白亚细胞定位Fig.4 Subcellular localization of CsCBS protein
2.4 转基因植株表达及表型鉴定
以PCXSN-1250载体引物作PCR鉴定,出现1 500 bp左右目的条带的为阳性植株(见图5),共鉴定出16株阳性植株。将所得阳性植株作qRTPCR表达量分析,筛选CsCBS表达量最高3株(S1、S2、S3)转基因植株。CsCBS表达量分别为对照226、133、153倍(见图6)。
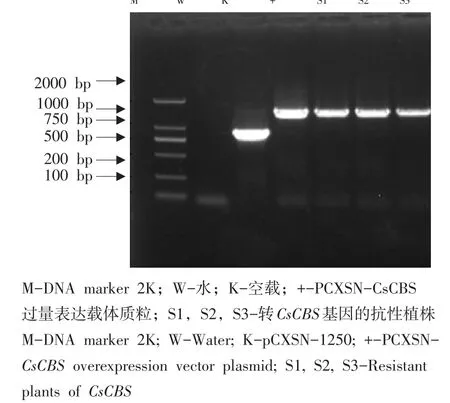
图5 过表达植株PCR鉴定Fig.5 PCR identification of overexpressed plants

图6 过表达植株CsCBS基因表达量Fig.6 Expression of CsCBS in over-expression transgenic plants
对S1、S2、S3及对照植株真叶作离体接种处理,接种7 d后,感染霜霉病菌转基因植株S1、S2、S3叶片褪绿面积约15%~20%,与抗病品种‘D9320’相同;感病品种‘D0401’叶片褪绿面积大于95%;感染棒孢叶斑病菌转基因植株S1、S2、S3叶片褪绿面积约5%~20%,与抗病品种‘D9320’基本相同。感病品种‘D0401’叶片褪绿面积大于40%(见图7)。可见,在感病品种D0401中过表达CsCBS后,显著增强其对霜霉病和棒孢叶斑病抗性。
2.5 黄瓜转基因T 0代植株生理生化指标测定
从过表达CsCBS植株中选择表达量高3株作相关生理指标测定。由图8a可知,在过表达植株中丙二醛含量极显著低于对照植株,低于对照植株2.1~3.2倍。
由图8 b中知,在过表达植株中可溶性糖含量极显著高于对照植株,高于对照植株1.5~1.6倍。

图7 黄瓜感病品种D0401过表达CsCBS的T 0代植株接种发病症状Fig.7 Expression levelsof the CsCBS in the T 0-generation CsCBS-overexpressing plants

图8 转基因植株中丙二醛、可溶性糖含量Fig.8 Transgenic plants malondialdehydeand solublesugar content
3 讨论与结论
王晓敏等研究表明在小麦中TaCDCP1可能通过脱落酸信号途径参与小麦对条锈菌防御反应[21];OsCBS过表达后增强水稻在盐、重金属和氧化应激条件下耐受性[9];彩叶草中cbCBS基因随叶片衰老上调表达[22];OsBi1在褐飞虱侵害后表达上调,在维管束周围累积表明其为一种防御基因,与韧皮部吸允损伤有关[23];大豆中GmCBS21基因过表达可提高植物低氮条件下耐受性[18];目前,CBS结构域蛋白在黄瓜抗病中作用未见报道。
本研究通过表达模式分析发现,CsCBS基因在3个接种处理下,抗病品种‘D9320’中持续上调前期表达,感病品种‘D0401’中无显著变化,说明CsCBS基因可积极响应霜霉病菌和棒孢叶斑病菌胁迫。在‘D9320’中,4 h双接种处理下表达量高于对照57倍,CsCBS基因表达量骤升并高于其他两个接种处理,可能在4 h时2种病菌侵染进程存在协同作用,显著诱导CsCBS表达,说明CsCBS基因可能在病原菌侵染初期起重要作用。但CsCBS基因具体对哪种病菌先出现抵抗作用,抵抗方式如何,尚需试验证明。用离体接种法对过表达植株作表型鉴定,结果表明在感病材料‘D0401’中过表达CsCBS后,发病症状明显轻于对照,说明过表达CsCBS提高黄瓜对霜霉病和棒孢叶斑病抗性,在黄瓜抗霜霉病和棒孢叶斑病中发挥作用。本研究仅针对T0代植株鉴定,植株较少,在T1~T3代中能否稳定遗传,是否对两种病害均有抗性,仍需验证。
刘会宁等认为,MDA含量与植物抗病性呈负相关,葡萄感染黑痘病后,不同品种MDA均上升[24];白粉病侵染紫薇后,抗病品种MDA低于感病品种[25](如图8a),过表达植株中MDA含量显著低于对照,证明CsCBS基因可降低质膜过氧化程度,提高植物抗病性。
另外,在黄瓜侵染霜霉病后,受害叶片中可溶性糖含量上升,与抗病性呈正相关[26]。可溶性糖含量高,辣椒抗疫病能力强[27],利于水稻抗稻瘟病[28],提高苦瓜对白粉病抗性[29],与本研究结果一致。本试验研究CsCBS基因在黄瓜霜霉病及棒孢叶斑病胁迫下作用,分析CsCBS是否具有双抗病性。后续将深入研究CsCBS抗两种黄瓜病害之间是否存在协同作用,CsCBS基因如何发挥作用及可否稳定遗传。
[1]丁国华.黄瓜抗病基因同源序列的克隆及其对霜霉病抗病标记的研究[D].哈尔滨:东北农业大学,2004.
[2] 孟攀奇,蔡丽静,张桂华,等.与黄瓜霜霉病抗性相关基因连锁的分子标记研究[J].长江蔬菜,2014(8):12-14.
[3] 张素勤,顾兴芳,张圣平,等.黄瓜霜霉病抗性相关基因的AFLP标记[J].西北植物学报,2010,30(7):1320-1324.
[4] Kozik E U,Klosinska U,Call A D,et al.Heritability and genetic variance estimates for resistance to downy mildew in cucumber accession ames2354[J].Crop Science,2013,53(1):177-182.
[5]Adam D C,Todd CW.Gene List 2010 for Cucumber[J].Cucurbit Genetics Cooperative Report,2010,(28-29):105-141.
[6] 王惠哲,李淑菊,管炜.黄瓜褐斑病抗源鉴定与抗性遗传分析[J].中国瓜菜,2010(1):24-25.
[7] Wang H Z,Li SJ,Yang R H,et al.EST-SSR marker linked to cucumber target leaf spot resistance-related gene[J].Acta Horticulturae,2010,871:49-56.
[8] Bateman A.The structure of a domain common to archaebacteria and the homocystinuria disease protein[J].Trends in Biochemical Sciences,1997,22(1):12-13.
[9] Singh A K,RKumar,A Pareek,et al.Overexpression of rice CBS domain containing protein improves salinity,oxidative,and heavy metal tolerance in transgenic tobacco[J].Molecular Biotechnology,2012,52(3):205-206.
[10] Bruce E K.Bateman domains and adenosine derivatives form a binding contract[J].Journal of Clinical Investigation,2004,113(2):182-184.
[11] Qingnan H,Shangjuan W,Chanjuan Z,et al.Identification and comparative analysis of CBS domain-containing proteins in soybean(Glycine max)and the primary function of GmCBS21 in enhanced tolerance to low nitrogen stress[J].International Journal of Molecular Sciences,2016,17(5):620-637.
[12] Elie K,Serge H,Valinsky W C,et al.Inhibition of PRL-2·CNNM3 protein complex formation decreases breast cancer proliferation and tumor growth[J].Journal of Biological Chemistry,2016,291(20):10716-10725.
[13] Toshiki Y,Krzeminski Mi,Bozoky Z,et al.Role of CBS and bateman domains in phosphorylation-dependent regulation of a CLC anion channel[J].Biophysical Journal,2016,111(9):1876-1886
[14] Zhang B L,Xu R L,Zhang J,et al.Identificiation and functional analysis of a novel PRKAG2 mutation responsible for Chinese PRKAG2 cardiac syndrome reveal an important role of non-CBS domains in regulating the AMPK pathyway[J].Journal of Cardiology,2013,62(4):241-248.
[15] Dong L,Xin M,Zhou X,et al.Expression and functional analysis of the transcription factor-encoding Gene CsERF004 in cucumber during Pseudoperonospora cubensis and Corynespora cassiicola infection[J].BMCPlant Biology,2017,17:96-108.
[16] 张艳菊,刘东,马柏壮,等.黑龙江省黄瓜棒孢叶斑病发生情况调查及病原鉴定[J].东北农业大学学报,2014,45(9):1-7.
[17] 刘东.黄瓜霜霉病及棒孢叶斑病双抗性分子机制的研究[D].哈尔滨:东北农业大学,2017.
[18] 孟晶晶.黄瓜CsABC19和CsPDR响应霜霉威胁迫的功能分析[D].哈尔滨:东北农业大学,2016.
[19]Yan Zhang,Zhang X L,Liu B,et al.A GAMYB homologue CsGAMYB1 regulates sex expression of cucumber via an ethylene-independent pathway[J].Journal of Experimental botany,2014,65(12):3201-3213.
[20] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003.
[21] 王晓敏,冯浩,孙燕飞,等.含CBS结构域的小麦TaCDCP1基因的克隆及其表达分析[J].作物学报,2010,36(12):2091-2098.
[22] Zhu Q L,Li M Y,Liu G D,et al.Molecular characterization and functional prediction of a novel leaf SAG encoding a CBS-domain-containing protein from Coleus blumei[J].Chinese Journal of Biochemistry and Molecular Biology,2007,23(4):262-270.
[23] Xiaolian W,Ren X,Zhu L L,et al.OsBi1,a rice gene,encodes a novel protein with a CBS-like domain and its expression is induced in responses to herbivore feeding[J].Plant Science,2004,166(6):1581-1588.
[24] 刘会宁,韩红梅.葡萄抗黑痘病与几个生理生化指标的关系[J].东北农业大学学报,2013,44(10):111-116.
[25] 谢宪,张林,王峰,等.白粉病菌不同侵染时间对紫薇品种生理生化指标的影响[J].北方园艺,2017(10):56-58.
[26] 孟庆玖,周晓榕,庞保平,等.黄瓜霜霉病菌侵染对黄瓜叶片生理生化指标的影响[J].西北农业学报,2014,23(6):141-146.
[27] 李海燕,刘惕若,甄艳.辣椒品种对疫病的抗性研究—氨酸、丙二醛与可溶性糖在抗病中的作用[J].中国农学通报,2006,22(11):315-317.
[28] 李佐同,靳学慧,张亚玲,等.水稻幼苗可溶性糖及可溶性蛋白含量与抗瘟性的关系[J].北方水稻,2009,39(4):6-9.
[29] 田丽波,商桑,杨衍,等.苦瓜对白粉病的抗性与相关生理生化指标的关系[J].西北农业学报,2015,24(9):166-173.

