SphK1高表达肝癌细胞株的筛选及PF-543对其增殖能力的影响
杨芳,王欣,苑永辉,黄居梅,郭瑞娟
(1 山东省地方病防治研究所,济南250014;2中国医科大学肿瘤医院·辽宁省肿瘤医院)
原发性肝癌是临床上最常见的恶性肿瘤之一,全世界每年新发病例约60万,居世界恶性肿瘤第五位,我国肝癌的死亡数占全球的55%,其发病率与病死率分别高居第四及第三位[1,2]。大量研究表明,鞘氨醇激酶与体内脂质代谢密切相关,参与细胞的增殖、分化及凋亡[3]。鞘氨醇激酶-1(SphK1)可以起到增强癌细胞活力、促进肿瘤生长和转移的作用[4,5]。2016年10月~2017年6月,本研究筛选了SphK1的高表达株,并观察了SphK1拮抗剂对其高表达株细胞增殖能力的影响。
1 材料与方法
1.1 材料 正常肝细胞系L02和肝癌细胞系HepG2、Huh7、Bel7402购自于中国科学院上海细胞生物研究所。DMEM培养液、RPMI1640培养液购自于Hyclone公司。胎牛血清购自于Gibco公司。TRIzol、PrimeScript RT Reagent Kit、Perfect Real Time和SphK1引物均购自TAKARA公司。细胞增殖-毒性检测试剂盒购自日本Dojindo公司。PF-543购自Selleck公司。
1.2 细胞培养 在5%C02、37 ℃条件下,L02、HepG2细胞置于含10%胎牛血清、100 IU/mL青霉素、100 mg/L链霉素的DMEM培养液中培养;Huh7、Bel7402细胞置于含10%胎牛血清、100 IU/mL青霉素、100 mg/L链霉素的RPMI1640培养液中培养,2~3 d更换一次新鲜培养液,待细胞融合至80%,用0.25%胰酶消化传代后接种于6孔板,每组设6个复孔,选对数生长期的细胞用于试验。
1.3 组织SphK1的检测 采用RT-PCR法。应用TRIzol提取RNA,按说明书要求操作。以紫外分光光度计检测RNA浓度。按PrimeScript RT Reagent Kit试剂盒方法进行RT-PCR逆转录反应,反应体系为20 μL。使用Roche 480Ⅱ荧光定量PCR仪进行PCR扩增及结果分析。取反转录后的 cDNA 2 μL作为模板,按照试剂盒的说明,配制反应体系进行扩增,SphK1引物F:5′-GGGGAATTGATGGTTAGCG-3′,R:5′-AGGAAGGGTCCTGACAGTAGAT-3′,片段长度:179 bp,退火温度为58 ℃;GAPDH引物F:5′-CCACTAGGCGCTCACTGTT-3′,R:5′-TGGAATTTGCCATGGGTGGA-3′,片段长度:228 bp,退火温度为59 ℃。反应体系为20 μL。以GAPDH为内参RNA。目的基因的相对量通过2-ΔΔCt法来计算。以上实验均以不含cDNA的体系为阴性对照。
1.4 细胞增殖活力的检测 采用CCK-8法。取HepG2细胞,PBS清洗,胰蛋白酶消化,制成细胞悬液。按每孔500个接种于96孔板。培养24 h后弃培养液,加入含0.5% FBS的培养液预处理24 h,以达到细胞同步化。实验分为5组: 10-7、10-6、2.5×10-6、10-5mol/L PF-543组及空白组,实验组按100 μL/孔加入含药培养液,每组设6个复孔,空白组加入等量含0.5% FBS的培养液,继续培养72 h,每孔加入CCK-8溶液10 μL,细胞培养箱内孵育4 h。使用酶标仪于450 nm处测OD值。
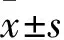
2 结果
2.1 SphK1在肝癌细胞系中的表达 HepG2细胞中SphK1的表达量最高,是正常肝细胞L02中SphK1表达量的(3.28±0.64)倍,两者比较,P<0.01;Huh7细胞中SphK1的表达量是正常肝细胞L02中SphK1表达量的(2.07±0.26)倍,两者比较,P<0.01,BEL7402细胞中SphK1的表达量最低,是正常肝细胞L02中SphK1表达量的0.22±0.04,两者比较,P<0.01。
2.2 不同浓度PF-543对HepG2细胞增殖活力的影响 预处理72 h后,10-7、10-6、2.5×10-6、10-5mol/L PF-543组及空白组OD450值分别为1.03±0.06、0.82±0.08、0.67±0.05、0.43±0.05、1.03±0.07。10-6、2.5×10-6、10-5mol/L的PF-543组均低于空白组(P均<0.01),10-7mol/L PF-543对HepG2细胞未见明显影响。PF-543在10-6、2.5×10-6、10-5mol/L浓度范围内对HepG2细胞增殖的抑制呈现剂量依赖性(P<0.05)。
3 讨论
原发性肝癌是我国常见的恶性肿瘤之一,其发生与细胞内复杂的分子机制密切相关,找到与肝癌发生、发展起关键作用的靶点是肿瘤治疗的关键所在。
近年研究表明,鞘脂在肿瘤的发生、发展过程中发挥极为重要的作用,是细胞生物学功能的重要调控子。重要的鞘脂类分子如神经酰胺(Cer)和鞘氨醇(Sph)有促细胞凋亡和抑制细胞增殖的作用;鞘氨醇-1-磷酸(S1P)既可作为细胞内第二信使发挥作用,又可与细胞表面的特定受体结合而调节细胞的增殖、凋亡、迁移及黏附分子表达等[6]。S1P/Cer的平衡是决定细胞生存或凋亡的重要因素。在 S1P生物合成过程中,Cer/Sph与S1P之间形成“鞘脂变阻器”,决定细胞的存活或死亡,而SphKs是Cer/Sph与S1P平衡的重要调控分子,起关键限速作用[7,8]。
目前,在人类和小鼠组织中已发现有SphK1和SphK2两种异构体存在,其中SphK1是细胞调节S1P生成的最主要分子,与多种肿瘤细胞的过度增殖有关[9]。SphK1对于维持正常细胞周期必不可少,SphK1表达增加不仅导致S1P水平升高,能对抗细胞凋亡,还能增加细胞周期由G1期向S期转化的速率[10]。Kohno等[11]研究发现,SphK1活化能够促进小肠腺瘤细胞增殖,抑制SphK1活性可抑制小肠癌的发生。Zhao等[12]研究发现,抑制SphK1的表达可以降低头颈部鳞状细胞癌的生长速度。但其在肝癌中的研究尚不明确。
为了探索SphK1在肝癌中的作用,我们选取正常肝细胞及三种肝癌细胞系作为模型进一步研究。本实验首先从RNA水平检测SphK1在正常肝细胞L02、肝癌细胞HepG2、Huh7、Bel7402中SphK1的表达量,证实SphK1在HepG2细胞系中的表达量高于其他细胞系,筛选出HepG2细胞系是SphK1高表达株;并进一步采用CCK-8法观察不同浓度SphK1拮抗剂PF-543对HepG2细胞增殖能力的影响,结果显示SphK1拮抗剂PF-543可剂量依赖性地抑制HepG2细胞增殖。
综上所述,HepG2细胞系是SphK1高表达株,在研究SphK1与肝癌的发生机制中,HepG2细胞系是首选细胞系。SphK1拮抗剂PF-543可显著性抑制HepG2细胞增殖,提示SphK1可能成为肝癌治疗的一个潜在靶点。
参考文献:
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016,66(2):115-132.
[3] Pappu R, Schwab SR, Cornelissen I, et al. Promotion of lymphocyte egress into blood and lymph by distinct sources of sphingosin-1-phosphate[J]. Science, 2007,316(5822):295-298.
[4] Heffernan-Stroud LA, Obeid LM.Sphingosine kinase 1 in cancer[J]. Adv Cancer Res, 2013,117:201-235.
[5] Gao Y, Gao F, Chen K, et al. Sphingosine kinase 1 as an anticancer therapeutic target[J]. Drug Des Devel Ther, 2015,9:3239-3245.
[6] Pyne NJ, Ohotski J, Bittman R, et al. The role of sphingosine 1-phosphate in inflammation and cancer[J]. Adv Biol Regul, 2014,54:121-129.
[7] Pyne S, Adams DR, Pyne NJ. Sphingosine 1-phosphate and sphingosine kinases in health and disease: recent advances[J]. Prog Lipid Res, 2016,62:93-106.
[8] Selvam SP, Ogretmen B. Sphingosine kinase/sphingosine 1-phosphate signaling in cancer therapeutics and drug resistance[J]. Handb Exp Pharmacol, 2013(216):3-27.
[9] Hatoum D, Haddadi N, Lin Y, et al. Mammalian sphingosine kinase (SphK) isoenzymes and isoform expression: challenges for SphK as an on cotarget [J]. Oncotarget, 2017,8(22):36898-36929.
[10] Yu H, Shao Y, Gao L, et al. Acetylation of sphingosine kinase 1 regulates cell growth and cell-cycle progression[J]. Biochem Biophys Res Commun, 2012,417(4):1242-1247.
[11] Kohno M, Momoi M, Oo ML, et al. Intracellular role for sphingosine kinase 1 in intestinal adenoma cell proliferation[J]. Mol Cell Biol, 2006,26(19):7211-7223.
[12] Zhao Y, Ling Z, Hao Y, et al. MiR-124 acts as a tumor suppressor by inhibiting the expression of sphingosine kinase 1 and its downstream signaling in head and neck squamous cell carcinoma[J]. Oncotarget, 2017,8(15):25005-25020.

