小剂量肝素在脓毒性休克患者中的应用效果
景丽丽,孙莉萍,杨万杰
(天津市第五中心医院,天津300450)
脓毒症是由真菌、细菌及病毒等病原微生物感染引起的全身炎症反应综合征,常见于严重创伤、感染及重大手术患者[1]。相关文献报道,脓毒症患者每年的病死率为25%~30%,其中脓毒性休克患者最高[2]。脓毒性休克,过去又称感染性休克,是指微生物及其毒素等产物所引起的脓毒病综合征,具有发病率高、病死率高、治疗花费高及预后复杂多样等临床特点[3]。相关文献报道,脓毒性休克的发生与机体的免疫、炎症、凝血等系统活化密切相关[4],除此之外与血管内皮细胞结构以及功能也有密切关联。在血管内皮细胞中以血管性假性血友病因子(vWF)最能反映血管内皮细胞受损情况[5]。目前临床上治疗脓毒性休克主要是抗凝、扩血管等治疗,其中抗凝治疗占有重要的地位[6,7]。本文中探讨了小剂量肝素辅助治疗对脓毒性休克患者肝肾功能、血管内皮细胞功能的影响。
1 资料与方法
1.1 临床资料 选取2015年2月~2017年2月天津市第五中心医院收治的脓毒性休克患者122例。纳入标准:脓毒症患者均符合2005年世界卫生组织中脓毒症明确诊断标准[8];脓毒性休克患者均符合《2014国际严重脓毒症及脓毒性休克诊疗指南》中的明确诊断标准[9];均送检病原微生物等相关检查确诊存在感染;患者及家属均知情同意并签署知情同意书。排除标准:伴有原发性心、肝、肾、脑等疾病;存在恶性肿瘤、自身免疫性疾病及心功能不全者;患有凝血功能紊乱的患者;存在影响vWF的疾病,如:系统性红斑狼疮、淋巴瘤等。按照不同治疗方式将患者分成肝素组与对照组。肝素组男39例、女32例,年龄(49.67±9.47)岁,病程(3.26±1.33)d,APACHEⅡ评分(21.34±5.14)分,氧和指数(228.67±114.37)mmHg,感染部位:腹腔感染15例、肺部感染36例、其他11例。对照组男40例、女31例,年龄(50.34±10.17)岁,病程(3.18±1.02)d,APACHEⅡ评分(20.68±4.27)分,氧和指数(229.67±116.47)mmHg,感染部位:腹腔感染17例、肺部感染35例、其他9例。两组基线资料有可比性。
1.2 治疗方法 对照组采用常规治疗方式:积极处理患者的原发性疾病,早期使用抗生素,但是在使用抗生素治疗前要留取病原学标本,根据药敏实验结果指导合理选用抗生素,同时予以液体复苏,必要时加用血管活性药物;若患者对血管活性药物反应不佳,应予以小剂量糖皮质激素综合治疗。肝素组在常规治疗基础上加用小剂量肝素,1~2万U/24 h,用5%葡萄糖注射液或0.9%氯化钠注射液稀释,两周为1个疗程;根据凝血活酶时间(APTT)调整应用速度,若发现患者出现鼻出血、牙龈出血、气道出血、尿血以及消化道出血等并发症,监测显示血小板(PLT)低于50×109/L,下调或停用肝素,若病情需要可加用鱼精蛋白对抗或予以相关的对症处理。
1.3 观察指标 治疗前后观察以下指标:①肝肾功能指标:谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(Cr)以及尿素氮(BUN);②凝血指标:凝血活酶时间(APTT)、凝血酶原时间(PT)、PLT及血浆vWF;③并发症发生率:成人呼吸窘迫综合征(ARDS)、弥散性血管内凝血(DIC)以及多器官功能障碍综合征(MODS)在治疗结束后的发生情况,与总例数比较,计为发生率;⑤出血发生情况;⑥28 d生存率:治疗结束28 d后,进行回访,记录存活的例数,并与总例数比较,即为28 d生存率。
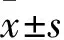
2 结果
2.1 两组肝肾功能指标比较 两组治疗前ALT、AST、Cr、BUN比较,P均>0.05,治疗后两组各指标均降低,以肝素组为著(P均<0.05)。见表1。

表1 两组肝肾功能指标比较
注:与对照组治疗后比较,aP<0.05。
2.2 两组凝血指标及vWF比较 两组治疗前后及两组间凝血功能指标比较,P均>0.05。治疗前两组血浆vWF比较,P>0.05,治疗后两组血浆vWF水平下降,以肝素组为著(P均<0.05)。见表2。

表2 两组凝血指标及vWF水平比较
2.3 两组出血发生情况 肝素组有出血患者5例,其中气道出血3例、胃肠减压引出咖啡色胃内容物患者2例,将肝素减量或停用后根据患者的情况予以对症治疗,出血情况改善4例,无改善1例;对照组出现出血倾向4例,均为消化道出血,经对症治疗后改善3例,无好转1例。
2.4 两组ARDS、DIC、MODS发生率比较 肝素组ARDS、DIC、MODS发生分别为10(16.39%)、6(9.84%)、10例(16.39%),对照组分别为11(18.03%)、16(26.23%)、20例(32.79%)。两组ARDS发生率比较,χ2=0.058,P>0.05;肝素组DIC、MODS发生率少于对照组(χ2值分别为5.545、4.420,P均<0.05)。
2.5 两组治疗结束后28 d生存率比较 对照组随访61例,失访2例,37例[62.71%(37/59)]患者到达随访终点;肝素组随访61例,失访3例,45例[77.59%(45/58)]患者到达随访终点,肝素组患者28 d生存率高于对照组(χ2=3.909,P<0.05)。
3 讨论
休克和MODS是脓毒症患者较为常见也最为严重的并发症,且随着耐药病原微生物的增加及免疫系统抑制患者的不断增多,脓毒性休克相关死亡已成为世界范围的严重卫生问题[10]。虽然近年医学技术不断创新与发展,但脓毒性休克的治疗效果仍欠佳,严重影响患者的生命健康及生活质量。目前,临床上对于脓毒症患者并发休克甚至死亡的具体发病机制及病理生理过程尚未完全了解,但相关研究资料表明,凝血和炎症同时存在、相互作用[11],脓毒症时炎症介质过度释放,凝血和抗凝系统紊乱,引起血管内广泛微血栓形成,从而发生全身性的炎症反应,使机体代谢系统、微循环系统、纤溶系统及免疫系统出现功能障碍,进一步加重脓毒症患者的病情,最终并发休克和MODS[12]。因此抗凝治疗是治疗脓毒性休克最为重要的治疗方式。
肝素是目前临床上较为常用的一种抗凝药物。据相关报道表明,肝素除了有抗凝作用外,还有抑制血栓形成与广泛性抗炎作用[13,14]。有研究证明,肝素对早期发生感染性犬肠黏膜微循环障碍具有改善作用,从而起到保护肠黏膜的作用[15,16]。沈国锋等[17]研究表明,肝素能改善患者肺部呼吸情况,提高氧和指数,降低炎症反应以及病死率。本研究中,治疗组肝肾功能指标改善程度优于对照组,且肝素治疗后对患者的凝血功能无影响,提示肝素对患者的肝肾功能具有保护作用,可间接降低MODS的发生。本研究中,两组ARDS发生率比较差异无统计学意义,可能与本文纳入的样本量少有关。肝素组DIC、MODS发生率少于对照组,说明肝素能降低患者DIC、MODS的发生率,提高脓毒性休克治愈率。肝素组患者28 d生存率高于对照组,提示肝素可改善患者的短期预后,提高其生存率。
血管内皮细胞的损伤与活化在脓毒症休克的发生、发展中起着重要作用,血管内皮细胞同时也是反映炎症反应的主要靶器官。本研究结果中,治疗后两组vWF表达水平均下降,但肝素组下降程度明显。表明肝素能促使内皮细胞功能的恢复,抑制炎症反应的发生[18]。
综上所述,对脓毒性休克患者注射小剂量肝素能改善患者肝肾以及血管内皮细胞功能,降低相关并发症的发生率,改善患者的近期预后,且安全,具有较高的临床应用价值。
参考文献:
[1] 贺能英,严启滔,郭振辉.脓毒症的免疫反应与炎症[J].中华危重病急救医学,2015,27(6):435-438.
[2] 罗红敏.全球脓毒症发生率及病死率的估计[J].中华危重病急救医学,2016,28(8):722.
[3] 夏为,卞晓华,董士民,等.脓毒症患者的临床特征及死亡相关因素分析[J].解放军医药杂志,2016,28(5):91-96.
[4] 龙盼,李响,姜丽静,等.脓毒症休克患者临床免疫功能分析[J].重庆医学,2017,46(2):198-200.
[5] 衡军锋,严洁,赵益明,等.vWF和ADAMTS13活性对脓毒症患者早期预后评估的意义[J].中国急救医学,2016,36(10):871-875.
[6] 李鑫,马晓春.脓毒症疗程中的抗凝治疗[J].中国实用内科杂志,2015,35(11):897-899.
[7] Carr AC, Shaw GM, Fowler AA, et al. Ascorbate-dependent vasopressor synthesis: a rationale for vitamin C administration in severe sepsis and septic shock[J]. Crit Care, 2015,19(1):418.
[8] 彭岩,梁智雄,罗琳,等.连续性肾脏替代治疗联合血必净对脓毒症合并感染性急性肾损伤患者免疫功能的影响[J].解放军预防医学杂志,2016,33(2):364-366.
[9] Al-Dorzi HM, Rishu AH, Tamim HM, et al. Serum procalcitonin in cirrhotic patients with septic shock: relationship with adrenal insufficiency and clinical outcomes [J]. Clin Lab, 2014,60(7):1105-1114.
[10] 唐甜.炎症反应在脓毒症ARDS发病机制中的作用[J].重庆医学,2017,46(15):32-33.
[11] Pepper DJ, Sun J, Welsh J, et al. Increased body mass index and adjusted mortality in ICU patients with sepsis or septic shock: a systematic review and meta-analysis[J]. Crit Care, 2016,20(1):181.
[12] 易梦秋,余旻.脓毒症导致多器官功能障碍的发病机制[J].实用医学杂志,2016,32(20):3451-3454.
[13] 朱宏坤.血清肝素结合蛋白在脓毒症患者中的表达与临床意义[J].中国中西医结合急救杂志,2015,22(1):75-78.
[14] 魏军,王艳红,冯冬青,等.小剂量肝素对脓毒症患者凝血功能及血小板活化的影响与临床疗效[J].血栓与止血学,2015,22(2):94-97.
[15] 邓秋明,陈爱和,尚东,等.肝素影响脓毒性休克血管内皮细胞功能及预后[J].中华急诊医学杂志,2017,26(4):281-282.
[16] 邹英杰,李志飞,王钰.低分子肝素治疗新生儿脓毒症合并DIC的疗效观察[J].中国妇幼健康研究,2015,26(2):268-270.
[17] 沈国锋,李响,倪金迪,等.低分子肝素治疗对ICU脓毒症患者急性肺损伤/急性呼吸窘迫综合征的影响[J].中国急救医学,2016,36(12):427-428.
[18] 何晓清,刘娟,杨录波,等.血清肝素结合蛋白对重症监护室危重患者感染的诊断价值[J].检验医学与临床,2016,13(11):1568-1570.

