血液置换联合洗涤红细胞输注对自身免疫性溶血性贫血患者的治疗效果
黎海江,冯学冠,符晓玲,杨艺伟,吴至成
(海南医学院第一附属医院,海口570102)
自身免疫性溶血性贫血(AIHA)是临床常见的血液系统疾病,主要由于机体免疫功能紊乱,而产生抗自身红细胞的抗体和激活补体,与红细胞表面的抗原相结合,加速了红细胞的破坏进而引发的溶血性贫血[1,2]。其主要临床症状为心悸、气短、乏力等,对于严重的贫血患者则会威胁到其生命健康[3]。输血治疗是目前临床上治疗AIHA患者的有效方法,合适的输血方法对患者生命的抢救及预后均有重要影响[4]。目前治疗AIHA的输血方法有去白红细胞悬液输注、红细胞输注、洗涤红细胞输注,其中洗涤红细胞输注能够有效地去除大多数的补体、白细胞及其血浆蛋白成分,是临床上治疗AIHA的首选输血方式,但单独应用仍有部分患者效果欠佳,因此本研究探讨了血液置换联合洗涤红细胞输注对AIHA患者的治疗效果。现报告如下。
1 资料与方法
1.1 临床资料 选取2012年3月~2017年1月海南医学院第一附属医院收治的AIHA患者92例,均符合AIHA诊断标准[5]。纳入标准:具备输血指征,临床表现为黄疸发热、头晕乏力、深棕色尿液等;首次进行输血治疗;患者及其家属对本研究知情,并签署知情同意书。排除标准:伴有凝血功能障碍、肝肾功能障碍者;伴有输血治疗禁忌证者;治疗依从性差者;伴有精神性疾病者。92例患者采用随机数字表法分为观察组与对照组,各46例。观察组患者中男29例、女17例,年龄29~76(49.38±8.72)岁,原发AIHA患者25例、继发AIHA患者21例,中度贫血(血红蛋白60~90 g/L)38例、重度贫血(血红蛋白<60 g/L)8例,病程1~3(1.42±0.31)年。对照组患者中男26例、女20例,年龄30~76(48.91±9.33)岁,原发AIHA患者26例、继发AIHA患者20例,中度贫血35例、重度贫血11例,病程1~4(1.87±0.53)年。两组基线资料有可比性。
1.2 治疗方法 根据入选患者红细胞指征,当患者出现乏力、头晕等贫血症状则立即进行输血治疗。在输血前需要检查患者血型,并采用戴安娜全自动血型分析仪进行交叉配血,抽取受试者静脉血2~4 mL,配血样本均用EDTA-K2抗凝,然后与供血者血浆进行交叉配血。红细胞洗涤先将抗凝血应用离心机以2 000 r/min的转速离心5 min,将血浆层吸取出,然后加2~3倍的0.9%氯化钠注射液,并用毛细滴管轻轻反复吹吸混匀,再应用离心机以2 000 r/min的转速,离心5 min,将上清液弃掉,共离心3次,最后1次离心时间为10 min,应用压积红细胞完成质量所要求的浓度进行常规输注,洗涤后的红细胞应在24 h内输注完。对照组给予洗涤红细胞输注治疗,输血速度均保持在1~3 mL/(kg·h),隔日1次,3次为1个疗程,输血剂量为63 U。观察组给予血液置换联合洗涤红细胞输注治疗。 应用CS-3000连续式全自动细胞分离机及专用密闭式管道进行血浆置换治疗,操作均严格按照仪器说明书进行,每次置换出血浆20~30 mL。然后给予洗涤红细胞输注治疗,输血速度均保持在1~3 mL/(kg·h),隔日1次,3次为1个疗程,输血剂量为33 U。两组均治疗2个疗程。输血前均进行交叉配血试验,均以静脉滴注的方式给予地塞米松注射液10 mg预防发热反应。在输血治疗的过程中对患者输血反应进行密切监测,若发生轻微输血反应,则进行对症处理,对于出现严重输血反应的患者则立即停止输血。
1.3 疗效判断 两组在治疗2个疗程后进行效果评价。显效:治疗后患者的临床症状完全消失,血液学指标如网织红细胞、胆红素、红细胞计数、血红蛋白均恢复到正常范围;有效:治疗后患者的临床症状明显改善,网织红细胞<5%,胆红素<34 μmol/L,血红蛋白>80 g/L;无效:治疗后患者的临床症状及血液学指标均无明显改善。总有效率=(显效例数+有效例数)/总例数。
1.4 观察指标 在输血结束后对两组患者的治疗效果进行评价,在输血前及输血后1 d应用血液分析仪对两组患者的网织红细胞、胆红素、红细胞计数及血红蛋白进行检测,并观察不良反应发生情况。
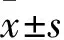
2 结果
2.1 两组临床疗效比较 观察组显效29例(63.04%)、有效15例(32.61%)、无效2例(4.35%),总有效率为95.65%;对照组显效17例(36.96%)、有效19例(41.30%)、无效10例(21.74%),总有效率为78.26%。观察组总有效率高于对照组(χ2=8.914,P<0.05)。
2.2 两组网织红细胞、胆红素、红细胞计数、血红蛋白比较 治疗前两组各指标比较,P均>0.05;治疗后,两组网织红细胞、胆红素均降低,红细胞计数、血红蛋白升高,以观察组为著(P均<0.05)。见表1。

表1 两组网织红细胞、胆红素、红细胞计数、血红蛋白比较
注:与同组治疗前对比,*P<0.05;与对照组治疗后对比,#P<0.05。
2.3 两组不良反应发生率比较 观察组皮疹、发热分别为1(2.17%)、3例(6.52%),总发生率为8.69%;对照组皮疹、发热分别为1(2.17%)、2例(4.35%),不良反应发生率为6.52%。两组不良反应发生率比较,P>0.05。
3 讨论
AIHA属于机体免疫功能调节紊乱而引发的,主要发病机制为产生补体和自身抗体吸附在红细胞表面,通过发生抗原抗体反应使红细胞破坏的速度加快而引发的一种溶血性贫血。近年来,随着人们生活习惯的改变,人口老龄化的发展,AIHA的发生率呈逐年升高趋势,对公众的生命健康带来严重威胁[6,7]。诱发AIHA的因素较多,具体可分为免疫功能紊乱、遗传因素、溶血机制改变及红细胞膜蛋白成分异常等[8]。通过输血治疗可使AIHA患者临床症状改善,心脑肝肾等重要脏器的缺氧状态改善,机体内血红蛋白水平提高,同时若配合药物的有效治疗,则可使患者的溶血病症得到改善,还可适当减少输血量[9~11]。由于AIHA患者血清免疫学特点,对于诱发因素不同的患者,应该选择最佳的输血治疗方法[12]。
洗涤红细胞是指将健康血液除去90%的血小板、白细胞和全部的血浆制成的,是治疗溶血性贫血患者的有效方法[13,14]。血液置换术主要是通过医学设备将多余的血液成分从患者体内有效去除,进而使患者的病情得到控制,临床症状得到缓解,在AIHA的治疗中也具有重要作用[15,16]。本研究中应用血液置换单独或联合洗涤红细胞输注治疗AIHA患者,结果显示,观察组总有效率高于对照组,说明血液置换联合洗涤红细胞输注可有效提高AIHA患者的治疗效果。观察组患者的网织红细胞、胆红素、红细胞计数及血红蛋白改善程度优于对照组,说明与单独进行洗涤红细胞输注治疗相比,血液置换联合洗涤红细胞输注治疗AIHA患者,血液指标能够得到更好的改善。分析其原因主要是因为洗涤红细胞可有效提高红细胞的有效浓度,在洗涤红细胞输注的同时进行血液置换,可使机体免疫复合物与自身抗体的浓度降低,药物的有效浓度提高,进而使治疗效果提高。观察组患者的不良反应发生率虽稍高于对照组,但两组对比差异无统计学意义,提示血液置换联合洗涤红细胞输注并不会增加不良反应的发生,具有较高的安全性。
综上所述,血液置换联合洗涤红细胞输注治疗AIHA一方面可使患者自身抗体和免疫复合物浓度有效降低,另一方面可以提高洗涤红细胞输注治疗的疗效,因此在患者条件允许的情况下,可选择血液置换联合洗涤红细胞输注治疗。
参考文献:
[1] 马庆宗,杨志钊,郑楚忠,等.血液置换输血治疗自身免疫性溶血性贫血疗效分析[J].深圳中西医结合杂志,2016,26(16):97-98.
[2] 袁文声,易峰,何锐洪,等.自身免疫性溶血性贫血患者的类同种自身抗体检测及其输血对策探讨[J].实验与检验医学,2015,33(4):403-404,409.
[3] 马永华.自身免疫性溶血性贫血血型血清学特征及输血治疗效果分析[J].深圳中西医结合杂志,2015,25(10):32-33.
[4] 王志芹,金宝生.自身免疫性溶血性贫血的输血治疗[J].现代诊断与治疗,2015,26(17):3947-3948.
[5] 张之南.血液病诊断及疗效标准[M].北京:科学出版社,2007:68-72.
[6] Klein NP, Ray P, Carpenter D, et al. Rates of autoimmune diseases in Kaiser Permanente for use in vaccine adverse event safety studies[J]. Vaccine, 2010,28(4):1062-1068.
[7] Nicoara AD, Niculescu Z, Ghinea MM, et al. Etiopathogenic aspects of autoimmune hemolytic anemias[J]. Eur J Intern Med, 2013,24(1):173-174.
[8] 王姣杰,李建斌,单泓.两种红细胞制品治疗自身免疫性溶血性贫血的效果比较[J].中国输血杂志,2015,28(5):555-556.
[9] Annibali R, Romagnoli V, Tonelli L, et al. Giant cell hepatitis and autoimmune hemolytic anemia: a 19 months follow-up[J]. Digest Liver Dis, 2013,45(4):306.
[10] 魏中菲,许亚茹,栾明瀚,等.不同输血方法治疗自身免疫性溶血性贫血疗效的Meta分析[J].中国煤炭工业医学杂志,2015,18(7):1191-1196.
[11] Sanefuji K, Ikegami T, Nagata S, et al. End-stage liver cirrhosis with severe autoimmune hemolytic anemia, treated by blood type-incompatible living donor liver transplantation: a case report[J]. Transplant Proc, 2011,43(5):2087-2089.
[12] Nicoara AD, Niculescu Z, Ghinea MM, et al. Etiopathogenic aspects of autoimmune hemolytic anemias[J]. Eur J Intern Med, 2013,24(1):173-174.
[13] Marsalli G, Nastasio S, Ramenghi U, et al. Efficacy of intravenous immunoglobulins in giant cell hepatitis-autoimmune hemolytic anemia: a prospective uncontrolled multicenter study[J]. Digest Liver Dis, 2013,45(4):273-274.
[14] 王立新,陈春霞,魏曾珍,等.自身免疫性溶血性贫血患者输血治疗的回顾性分析[J].中国输血杂志,2017,30(1):45-48.
[15] Gerardo F, Alfons N, Kate H, et al. Chronic lymphocytic leukemia associated with autoimmune hemolytic anemia is characterized by a distinctive miRNA signature[J]. CL Lymph Myelom Leuk, 2011,11(2):181-182.
[16] Annibali R, Romagnoli V, Tonelli L, et al. Giant cell hepatitis and autoimmune hemolytic anemia: a 19 months follow-up[J]. Digest Liver Dis, 2013,45(4):306.

