单孔与传统“三孔”法胸腔镜手术治疗肺癌的临床疗效比较
王学中 刘志广 刘 平
肺癌(lung cancer)是临床中常见的恶性肿瘤,近50年来,其发病率、死亡率在全球范围内明显增高;在所有恶性肿瘤中,男性肺癌发病率及死亡率占第一位,严重影响患者生命健康安全[1]。临床中,肺癌的治疗以手术为主。传统开胸手术风险较高,创伤较大,且术后并发症多,患者痛感强烈[2]。胸腔镜手术(video-assisted thoracoscopic surgery,VATS)凭借创伤性小,术后恢复快,对心肺功能影响小,并发症少等优点被广泛开展应用,成为肺癌切除的主要手术方法,并于2006年被美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)列为肺癌治疗的标准术式之一[3-4]。有数据显示,国外45%以上的肺叶切除在胸腔镜下进行,且呈不断上升趋势[5]。随着VATS技术的不断成熟改进,手术器械及图像清晰度的不断更新提高,VATS技术发生了从3P-VATS到单孔VATS(uniportal-VATS)的飞跃式进步,通过一个微创切口完成肺癌手术,其临床效果及术后恢复等优势显著[6-7]。我院对73例肺癌患者分别采用单孔与传统“三孔”法VATS进行治疗,旨在比较两者的临床效果及对患者预后的影响,现报告如下。
1 资料与方法
1.1 一般资料
选择2012年5月至2016年4月我院收治的73例肺癌患者,采用随机数字表法按1∶1比例随机将所有患者分为观察组(n=37)和对照组(n=36)。观察组:男性24例,女性13例;年龄31~73岁,平均年龄(52.74±5.91)岁;病灶位置:左肺上叶10例,左肺下叶8例,右肺上叶8例,右肺中叶4例,右肺下叶7例;病理类型:腺癌25 例,鳞癌9例,类癌3例;临床(TNM)分期:Ⅰ期22例,Ⅱ期15例。对照组:男性25例,女性11例;年龄34~75岁,平均年龄(53.29±6.23)岁;病灶位置:左肺上叶11例,左肺下叶7例,右肺上叶9例,右肺中叶3例,右肺下叶6例;病理类型:腺癌23例,鳞癌10例,类癌3例;临床(TNM)分期:Ⅰ期25例,Ⅱ期11例。2组患者性别、年龄、病灶位置、病理类型和TNM分期等一般资料组间比较无统计学差异(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:①所有患者符合《NCCN非小细胞肺癌治疗指南解读(2011年版)》中关于肺癌的诊断标准[8];②胸部CT、纤维支气管镜或肺穿刺组织病理活检证实为腺癌、鳞癌或类癌;③TNM分期为Ⅰ期、Ⅱ期者;④肺功能检测状态良好,肺功能1 s用力呼吸容积(FEV1≥1 L),占预计值40%以上,手术耐受者;⑤所有患者均知情同意。排除标准:①肿块过大或已累及血管,肿瘤转移者;②小细胞癌、中央型肺癌及双肺肿瘤者;③胸膜明显增厚,广泛粘连;④术前已给予放、化疗治疗或使用免疫抑制剂者;⑤既往有胸部手术或严重外伤史,存在胸腔镜禁忌证者;⑥合并严重心、肝、肾、肺等重要脏器功能异常或精神异常等。
1.3 治疗方法
所有患者术前均经病理确诊,入院后给予肺功能、腹部超声、头颅MRI、胸部CT及骨扫描等相关检查。取健侧卧位,垫高腰部位置,全身麻醉,双腔气管插管,健侧通气。对照组患者行3P-VATS,分别于患者腋中线第7肋间(切口1)及腋后线第6肋间(切口2)行2 cm切口,腋前线第4肋间(切口3)行4 cm切口。切口1为观察孔,Trocar置入;切口2为副操作孔,切口3为主操作孔,置入保护套。观察组行单孔VATS,于患者腋前线第5肋间行3~5 cm切口,切开皮肤及皮下组织,置入切口保护套,避免血液污染镜头。置入胸腔镜,显示器观察患者胸腔粘连与病变解剖情况。
所有患者均给予肺叶切除及系统淋巴结清扫术,电凝勾常规游离肺粘连,肺门周围胸膜完全被打开,完全游离结扎肺静脉、肺动脉及支气管,内径切割闭合器切割吻合,超声刀离断,血管夹夹闭。左侧肿瘤淋巴结清扫为第3组、第5~9组淋巴结,右侧肿瘤淋巴结清扫为第2~3组、第7~9组淋巴结,左右两侧均需对各级支气管淋巴结进行清扫。术后均给予胸外科常规处理,放置引流管,常规缝合,抗生素抗感染及静脉镇痛泵持续止痛等对症支持治疗。嘱患者尽早咳嗽及下床。术后无漏气,复查胸片提示双肺复张良好,且胸腔引流量<100 ml/d时方可拔管。所有患者随访6个月。
1.4 观察指标及疗效评定标准
①记录2组患者术中出血量、手术时间、淋巴结清扫术等术中指标情况及术后引流时间、引流量、住院时间等术后指标情况。②通过视觉模拟评分法(visual analogue scale,VAS)评估患者术后疼痛情况,评估时间分别为术后第1、3、5、7、30天,分值越高疼痛越严重[9]。③分别于术前、术后第1、5天比较2组患者C-反应蛋白(c-reactive protein,CRP)、降钙素原(procalcitonin,PCT)水平。④生活质量采用健康调查简表(the MOS item short from health survey,SF-36)评分进行评定,包括生理机能、生理职能、躯体疼痛、一般健康状况、精力、社会功能、情感职能7个方面,评分越高生活质量越好[10]。⑤观察记录患者术后肺部感染、胸腔积液等并发症发生情况。
1.5 统计学方法

2 结果
2.1 手术基本情况比较
所有患者均在胸腔镜下顺利完成手术,未出现中转开胸病例或增加切口病例。与对照组比较,观察组患者手术时间较长,但术后住院时间较短,组间比较均有统计学意义(t=2.883,P=0.005;t=-5.975,P=0.000)。观察组术中出血量、淋巴结清扫个数、术后引流时间及引流量均较对照组少,但差异无统计学意义(P>0.05)(表1)。
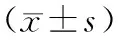
表1 2组手术基本情况比较
2.2 VAS评分比较
分别于术后第1、3、5、7、30天比较2组VAS评分,观察组均明显低于对照组,差异有统计学意义(P<0.05)(表2)。
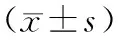
表2 2组术后VAS评分比较
2.3 CRP、PCT水平比较
分别于术前、术后第1、5天比较2组CRP、PCT水平。术前2组CRP、PCT水平均无统计学差异(P>0.05);术后第1天,2组CRP、PCT水平较术前均显著升高(P<0.05),组间比较观察组低于对照组(P<0.05);术后第5天,2组CRP、PCT水平均有所下降(P<0.05),组间比较观察组低于对照组(P<0.05)(表3)。
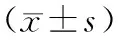
表3 2组CRP、PCT水平比较
注:*为与术前比较,P<0.05。
2.4 SF-36评分比较
术后3个月,观察组SF-36评分由术前(56.46±10.51)分显著提高至(67.85±11.16)分(P<0.01),且明显高于对照组的(62.38±10.92)分(P<0.05)。与术前比较,2组患者生理机能、躯体疼痛、精力及社会功能均明显提高(P<0.05或P<0.01),观察组生理职能、情感职能亦明显提高(P<0.05或P<0.01);而一般健康状况、精神健康则无明显差异(P>0.05)(表4)。
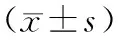
表4 2组SF-36评分比较
注:与治疗前比较,*为P<0.05,**为P<0.01;与对照组比较,#为P<0.05,##为P<0.01。
2.5 并发症发生情况比较
观察组肺部感染、胸腔积液等并发症发生率为18.92%,低于对照组的33.33%,但2组比较,无统计学差异(χ2=1.969,P=0.161)(表5)。

表5 2组不良反应比较/例
3 讨论
近年来,随着微创理念的逐步深入与成熟,VATS在外科手术中被广泛应用开展,如何在保证手术效果的同时,最大限度减少手术切口数量,发挥手术微创性,提高患者术后生活质量成为临床研究热点重点内容[11]。研究发现,单孔VATS治疗肺癌具有可行性,优点主要体现在以下几个方面:第一,机体免疫影响小,应激反应减少甚至避免,机体损伤下降;第二,手术损伤主要集中于某一肋间,有效减少常规术式对机体正常肌肉组织、血管及神经损伤,缓解术后疼痛的发生发展;第三,单孔对患者机体呼吸系统功能影响小,患者术后可尽快咳嗽并下床活动,控制术后并发症发生,促进患者术后康复[12]。
本研究对我院收治的73例肺癌患者分别给予单孔与传统“三孔”法VATS进行治疗,结果显示,观察组患者手术时间较长,但术后住院时间较短,两组术中出血量、淋巴结清扫个数、术后引流时间及引流量未见差异,与王新等[13]的研究结果基本相符。在对肺癌患者的手术治疗中,系统淋巴结清扫是改善预后,防止转移复发的重点,术后引流量也在一定程度上反映患者淋巴结清扫程度与范围;本研究2组术中淋巴结清扫个数及术后引流量均未见差异,提示2种术式治疗肺癌临床效果相当[14]。单孔VATS所有器械均在一个孔内进出,且术野范围及胸腔容积局限,增加了手术操作难度,Trocar缺失后腔镜更容易被污染,肺组织的牵拉、推动膈肌及心包难度的增加均导致手术时间延长[15]。但随着“学习曲线”说法的提出,认为术者在经过一定阶段的熟练操作及实践积累之后,可有效缩短单孔VATS手术时间[16]。患者术后疼痛影响机体肺功能康复训练,而疼痛并非全部来自于胸腔内的组织损伤,其与术中操作对切口肋间神经肌肉损伤、术后引流管对胸壁神经的刺激存在密切关系[17]。本研究分别于术后第1、3、5、7、30天比较2组VAS评分,观察组始终低于对照组,提示单孔VATS技术手术切口少,有效避免了对腋后线切口周围丰富的神经肌肉组织的损伤,使肋间神经损伤风险降低;与切口数量越少,患者术后疼痛评分越低的说法相符合[18]。2组并发症情况比较无统计学差异,与郝志鹏等[19]的研究结果基本相符,考虑2种术式对患者术后不良影响无明显差异,但单孔VATS组患者可尽早下床,肺功能恢复较快。
机体炎症反应的变化是评价腹腔镜手术功能学微创的重要环节。肺癌患者在行手术治疗之后,术后疼痛影响咳嗽力度,痰液等分泌物在肺内沉积,最终导致肺部感染发生[20]。单孔VATS可有效降低机体应激性严重反应,减少周围细菌的入侵;术后有效咳痰可促使分泌物尽快排出,降低肺部感染风险。CRP和PCT属于常用炎性标志物,有助于术后炎性并发症的早期判断,其水平升高的程度与感染的严重程度、组织损伤程度呈正相关[21]。CRP是反映细胞因子介导的全身炎性反应程度的蛋白质,作为急性时相反应的一个极灵敏的指标,血浆中CRP浓度在急性心肌梗死、创伤、感染、炎症、外科手术、肿癌浸润时迅速升高,客观反应手术应激反应对机体的损伤程度[22]。PCT是降钙素的前体,反映了全身炎症反应的活跃程度,敏感性、特异性较高。本研究术前2组CRP、PCT水平均无统计学差异,术后第1天,2组CRP、PCT水平较术前均显著升高,提示2种术式均对机体造成一定程度损伤,加重炎症反应。观察组在术后第1、5天的CRP、PCT水平均低于对照组,且在术后第5天降至术前水平甚至更低,提示单孔VATS可有效控制机体炎症反应,减少损伤程度。
综上所述,单孔VATS与3P-VATS治疗肺癌均可完全清扫淋巴结,临床疗效相当,但单孔VATS在此基础上可有效缩短住院时间,降低VAS评分及CRP、PCT水平,提高患者生活质量,值得推广。
[1] 李 琦.肺功能检查在肺癌中的应用〔J〕.中国实用内科杂志,2014,34(S1):22-23.
and development of the video-assisted thoracic surgery lobectomy technique:comparative study with conventional surgery in stage Ⅱ non-small cell lung cancer〔J〕.Arch Bronconeumol,2014,50(2):57-61.
[3] 谢 冬,姜格宁,赵佳平,等.单孔全胸腔镜治疗中央型肺部肿瘤5 例〔J〕.中华胸心血管外科杂志,2015,31(3):177-178.
[4] 李 畅,马海涛,何靖康,等.单操作孔肺叶切除术治疗周围型肺癌的临床研究〔J〕.中国肺癌杂志,2013,16(9):53-57.
[5] Ceppa DP,Kosinski AS,Berry MF,et al.Thoracoscopic lobectomy has increasing benefit in patients with poor pulmonary function:a Society of Thoracic Surgeons Database analysis〔J〕.Ann Surg,2012,256(3):487-493.
[6] 李 贲,郭志敏,周 斌,等.单操作孔胸腔镜下手术治疗早期非小细胞肺癌患者的效果研究〔J〕.实用癌症杂志,2015,30(3):432-434.
[7] Rocco G.One-port(uniportal) video-assisted thoracic surgical resections--a clear advance〔J〕.J Thorac Cardiovasc Surg,2012,144(3):S27-31.
[8] 周彩存.NCCN非小细胞肺癌指南更新(2011年V3)〔C〕.上海市肺科学会和美国ACCP联合会议,2011:47-48.
[9] 孙 兵.视觉模拟评分法(VAS)〔J〕.中华神经外科杂志,2012,28(6):645.
[10] 谭诗生,李 杭,罗 健,等.欧洲癌症研究与治疗组织研制的生活质量核心调查问卷第3版中文版生活质量调查问卷测评〔J〕.中国临床康复,2006,10(4):23-27.
[11] 马春平,陆亚东,丁 浩,等.全胸腔镜手术对Ⅰ期非小细胞肺癌的临床疗效研究〔J〕.实用癌症杂志,2013,28 (5) :495-498.
[12] Wang BY,Liu CY,Hsu PK,et al.Single-incision versus multiple-incision thoracoscopic lobectomy and segmentectomy:a propensity-matched analysis〔J〕.Ann Surg,2015,261(4):793-799.
[13] 王 新,王 雷,王化勇,等.单操作孔胸腔镜手术治疗非小细胞肺癌的临床分析〔J〕.中华腔镜外科杂志(电子版),2013,6(3):26-29.
[14] Puri V,Meyers BF.Video-assisted thoracoscopic surgery lobectomy for lung cancer〔J〕.Surg Oncol Clin N Am,2013,22(1):27-38.
[15] 尹逊亮,周勇安,赵 宁,等.单孔及多孔法胸腔镜手术治疗周围型非小细胞肺癌临床疗效的病例对照研究〔J〕.中国胸心血管外科临床杂志,2016,23(11):1044-1049.
[16] 王希文,赵俊刚.单孔胸腔镜肺癌根治术与传统三孔手术的对比分析〔J〕.重庆医学,2016,45(28):3959-3962.
[17] Althaus A,Hinrichs-Rocker A,Chapman R,et al.Development of a risk index for the prediction of chronic post-surgical pain〔J〕.Eur J Pain,2012,16(6):901-910.
[18] Young R,McElnay P,Leslie R,et al.Is uniport thoracosco-pic surgery less painful than multiple port approaches〔J〕.Interact Cardiovasc Thorac Surg,2015,20(3):409-414.
[19] 郝志鹏,蔡奕欣,付圣灵,等.单孔与三孔胸腔镜肺癌根治术对患者术后疼痛及短期生活质量的对比研究〔J〕.中国肺癌杂志,2016,19(3):122-128.
[20] Park BJ.Is surgical morbidity decreased with minimally invasive lobectomy〔J〕.Cancer J,2011,17(1):18-22.
[21] Dutta S,Fullarton GM,Forshaw MJ,et al.Persistent elevation of C-reactive protein following esophagogastric cancer resection as a predictor of postoperative surgical site infectious complications〔J〕.World J Surg,2011,35(5):1017-1025.
[22] Tschaikowsky K,Hedwig-Geissing M,Braun GG,et al.Predictive value of procalcitonin,interleukin-6,and C-reactive protein for survival in postoperative patients with severe sepsis〔J〕.J Crit Care,2011,26(1):54-64.

