Akt/mTOR通路在胃肠胰神经内分泌肿瘤中的表达及其意义
乐 静 赵 涛 刘爱林
胃肠胰神经内分泌瘤(gastroenteropancreatic neuroendocrine neoplasm,GEP-NEN)是起源于消化道弥散神经内分泌系统的一组异质性肿瘤群,显示了从缓慢生长、低度恶性,直至高转移性等恶性生物学行为[1]。Akt称蛋白激酶B(protein kinase B,PKB),是一种在进化上高度保守的丝氨酸/苏氨酸蛋白激酶,主要存在胞质中,是PI3K下游分子[2]。mTOR(mammalian target of rapamycin)是Akt信号分子下游雷帕霉素作用的靶点,可通过直接磷酸化或抑制结节性硬化复合物1/2形成复合物激活mTOR信号[3]。本研究选取在我院住院的胃肠胰神经内分泌肿瘤,分析Akt/mTOR信号通路的作用及意义。
1 材料与方法
1.1 一般资料
选取自2010年1月至2016年1 月在我院经病理证实的胃肠胰神经内分泌肿瘤60例作为实验组,包括男性35例,女性25例,年龄35~60岁,平均年龄(51.2±2.3)岁;20例患者肿块位于胃,18例患者肿块位于小肠,13例患者位于结肠,11例位于胰腺。同时取瘤旁组织60例。正常对照组30例,年龄31~70岁,平均年龄(54.2±4.5)岁,均取自于胃肠胰腺炎症的患者。所有入组患者术前均未接受过放疗、化疗、免疫等抗肿瘤治疗。患者在性别、年龄等方面无明显差异(P>0.05),具有可比性。
1.2 实验试剂及器材
Na2EDTA抗凝剂;Akt ELISA试剂盒;mTOR ELISA试剂盒;Akt封闭液+一抗,mTOR封闭液+一抗,兔抗鼠免疫组化二抗试剂盒;离心机(上海飞鸽);显微镜(日本Olympus);酶标仪(英国TECNA);脱水机(日本TIYODA);切片机(德国Leica);计算机图像分析系统(美国惠普)。
1.3 观察指标及检测方法
1.3.1 ELISA法检测入组患者血液中Akt、mTOR水平 入组患者抽取空腹静脉血,1500 r/min离心10 min后吸取上清,保存于低温冰箱中。计算板孔数;试剂盒常温放置30 min;标准品稀释;每个浓度均设5个复孔,加样;配液;洗涤;显色;终止;酶标仪于450 nm的波长处测量吸光值;绘制线性回归方程,计算样品浓度。
1.3.2 免疫组织化学法检测组织中Akt、mTOR的表达 福尔马林固定、脱水、透明;包埋、切片;热修复;过氧化氢阻断;正常山羊血清封闭;加一抗50 μl静置1 h;加二抗50 μl 静置10 min;显色、终止;复染、分化;封片。
1.3.3 判断标准 Akt、mTOR阳性结果判定以细胞核不染色,胞膜或胞质出现棕黄色颗粒为阳性,染色细胞数阴性(-):≤10%;弱阳性(+):>10%~25%;阳性(++):>25%~50%;强阳性(+++):>50%。
1.4 数据处理
采用SPSS17.0统计学软件进行数据处理,计数资料用χ2检验,计量资料用方差分析,以(均数±标准差)表示,多因素用Logistic回归模型,P<0.05 为差异有统计学意义。
2 结果
2.1 ELISA法检测入组患者血清中AKt、mTOR含量
抽取入组患者外周静脉血,检测血清AKt、mTOR含量,结果发现,实验组AKt为(1.57±0.12) ng/ml,mTOR为(0.06±0.03)ng/ml,均较对照组升高,差异有统计学意义(P<0.05);见表1。

表1 ELIASA法检测入组患者血液中AKt、mTOR含量
2.2 免疫组织化学法检测入组患者组织中AKt、mTOR的表达
对入组患者组织AKt、mTOR的表达进行检测,结果发现,实验组中AKt出现14例强阳性表达,30例阳性表达,阳性率为73.3%,mTOR出现13例强阳性表达(+++),33例阳性表达(++),阳性率高达76.7%,均较瘤旁组织、对照组高,差异有统计学意义(P<0.05);见表2。
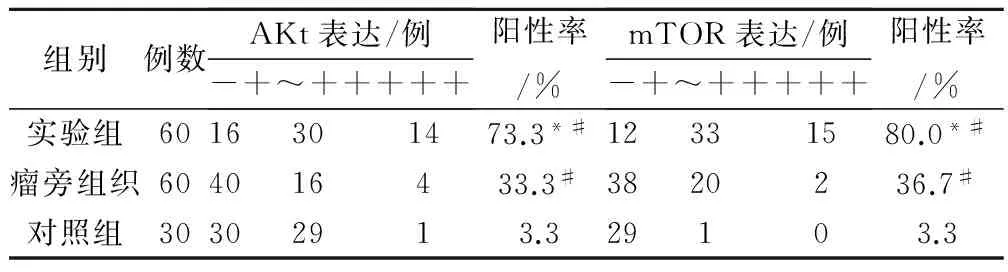
表2 IHC法检测入组患者脑组织中AKt、mTOR的表达
注:*与瘤旁组织比较,差异有统计学意义,P<0.05;#与正常对照组比较,差异有统计学意义,P<0.05。
2.3 实验组AKt、mTOR表达水平与临床病理特征的关系
60例患者中,AKt表达的有44例,mTOR表达的有48例。对实验组患者AKt、mTOR表达水平与性别、年龄、PS评分、肿瘤部位、分化程度、肿瘤大小、肿瘤数目、远处转移、生存时间等临床病理特征进行比较,结果发现,AKt、mTOR表达水平与胃肠胰神经内分泌肿瘤的分化程度、肿瘤大小、肿瘤数目、远处转移、患者生存时间有关(P<0.05),与年龄、性别、PS评分、肿瘤部位无关(P>0.05);低分化、肿瘤直径>3 cm、肿瘤数目多个、出现远处转移、患者生存时间≤5年的胃肠胰神经内分泌肿瘤患者,AKt、mTOR的表达较高;见表3。
2.4 实验组AKt、mTOR表达水平与临床病理特征的logistic多因素分析
对单因素分析中的临床病理特征进行logistic多因素分析,结果发现,分化程度、肿瘤大小、肿瘤数目、远处转移、生存时间均是独立危险因素,见表4。
3 讨论
神经内分泌肿瘤是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,据报道,胃肠道的神经内分泌肿瘤的发生率依次为阑尾38%、小肠29%、结肠13%、胃12%、直肠8%[4-5]。信号传导系统的缺陷和异常活化与肿瘤发生、发展、预后密切相关,Akt/mTOR信号通道是关键的细胞增殖相关信号通道之一,在乳腺癌、肺癌、胶质瘤等研究中已得到证实[6]。本研究选取在我院住院的胃肠胰神经内分泌肿瘤,分析Akt/mTOR信号通路的作用及意义。

表4 实验组AKt、mTOR表达水平与临床病理特征的logistic多因素分析
在本研究中,选取病理证实的胃肠胰神经内分泌肿瘤患者为实验组,胃肠胰腺炎症的患者为对照组,抽取入组患者外周静脉血,检测实验组的血清AKt、mTOR水平均较对照组升高。进一步检测实验组肿瘤组织、瘤旁组织及对照组胃、肠、胰腺组织的AKt、mTOR的表达,实验组中AK、mTOR蛋白表达的阳性率均高于瘤旁组织、对照组。这提示,在胃肠胰神经内分泌肿瘤患者的血清及组织中均存在AKt、mTOR的高度表达。Liu运用基因芯片技术发现与正常肝脏组织相比,肝癌细胞中Akt的表达明显升高[7]。Banumathy G 研究表明,PI3K/Akt /mTOR 信号通路在肝癌发病过程中被过度激活,mTOR呈高表达[8]。这与本研究结果近似。
本研究进一步对实验组患者AKt、mTOR表达水平与临床病理特征进行比较,AKt、mTOR表达水平与胃肠胰神经内分泌肿瘤的分化程度、肿瘤大小、肿瘤数目、远处转移、生存时间有关,与年龄、性别、PS评分、肿瘤部位无关;分化程度低、肿瘤直径>3 cm、肿瘤数目多个、出现远处转移、生存时间≤5年的胃肠胰神经内分泌肿瘤患者,AKt、mTOR的表达升高。在对喉癌的研究中指出,Akt/mTOR 信号通路被激发,在喉癌的发生发展中起到了重要的作用,Akt/mTOR的表达与肿瘤的恶性程度有关,Akt/mTOR过度表达者,恶性程度较高,影响预后[9]。对恶性胶质瘤和横纹肌肉瘤等组织的研究指出,Akt/mTOR信号通路的表达情况可以作为肿瘤恶性程度的指标之一,对患者的预后也具有相应的指导意义[10]。
综上所述,在胃肠胰神经内分泌肿瘤患者的血清及组织中均存在AKt、mTOR的高度表达,表达水平与胃肠胰神经内分泌肿瘤的分化程度、肿瘤大小、肿瘤数目、远处转移、生存时间有关。临床上可进一步对AKt/mTOR信号传导通路进行研究,探索其机制。
[1] 中国胃肠胰神经内分泌肿瘤病理专家组.中国胃肠胰神经内分泌肿瘤病理学诊断共识意见〔J〕.中华病理学杂志,2011,40(4):257-262.
[2] 俞 媛,陈晓蓉.PI3K/Akt/mTOR信号转导通路在肝细胞癌发生发展中的作用〔J〕.临床肝胆病杂志,2014,30(9):954-957.
[3] 张丹丹,李庆林.PI3K/Akt/mTOR信号通路与肿瘤〔J〕.安徽医药,2012,16(3):281-283.
[4] 杨 宏,张翠英.胃肠胰神经内分泌肿瘤诊治进展〔J〕.现代中西医结合杂志,2013,22(18):2040-2043.
[5] 盛伟琪.胃肠胰神经内分泌肿瘤病理诊断的规范和进展〔J〕.中国癌症杂志,2013,23(6):401-407.
[6] Martelli AM,Evangelisti C,Chiarini F,et al.The phosphatidylinositol3-kinase/Akt/mTOR signaling network as a therapeutic target inacute myelogenous leukemia patients〔J〕. Oncotarget,2010,1(2):89-103.
[7] Liu LX.Gene expression profiles of hepatoma cell line HLE〔J〕.World J Gastroenterol,2003,9(4):683-687.
[8] Banumathy G.Signaling pathways in renal cell carcinoma〔J〕 .Cancer Biol Ther,2010,10(7):658-664.
[9] 季冬梅,李 进. 靶向PI3K/Akt/mTOR通路在胃癌中的研究进展〔J〕. 肿瘤,2014,34(2):191-196.
[10] Emanuel FP,Virginia E,Robyn PA,et al.Phosphoprotein pathway mapping:Akt/mammalian target of rapamycin activation is negatively associated with childhood rhabdomyosarcoma survival〔J〕 Cancer Res,2007,67(7):3431-3440.

