SOX4表达与恶性黑素瘤临床病理特征及其转移的关系
李 林
恶性黑素瘤的恶性程度较高,是1种危害人类健康的皮肤肿瘤。近年,伴随生活环境和饮食习惯的改变,该病的发病率呈逐年增加趋势[1]。目前恶性黑素瘤的发生侵袭和转移的机制尚有待于阐明。SOX4基因是SOX(SRY-like HMG box)是1类重要核转录因子,参与细胞的增殖、分化等功能,与肿瘤病情发展密切相关[2]。基因研究发现,SOX4基因在恶性黑素瘤中的具体作用尚未明确,本文检测研究SOX4在恶性黑素瘤组织中的表达, 探讨其在恶性黑素瘤发生、转移中的临床意义。
1 资料与方法
1.1 一般资料
本组共纳入恶性黑素瘤患者70例,均为本院皮肤科收治的组织标本,其中男性41例,女性29例;年龄30~70岁,平均(52.17±7.95)岁;病程3个月~2.5年,平均(13.49±3.88)个月;原发黑素瘤 39例,转移性黑素瘤 31例;浸润深度根据Clark法[3]分级:Ⅰ~Ⅱ期27例;Ⅲ~Ⅳ期43例。Breslow[4]分级:Ⅰ~Ⅱ期31例;Ⅲ~Ⅳ期39例。恶性黑素瘤诊断:所有标本经组织病理和免疫组化检查(S100、HMB45均为阳性)证实。纳入标准:①符合恶性黑素瘤诊断者;②年龄>18岁;③首次发病者;④患者知情。排除标准:①合并其他类型肿瘤者;②伴心、肝肾等器官严重障碍者;③患有其他类型皮肤病者;④资料遗失者。同期收集正常皮肤组织30例作为对照组,其中男性17例,女性13例;年龄35~70岁,平均(50.85±7.99)岁。所有正常皮肤标本者体检(心电图、血液生化等)提示均正常。两组患者间的性别、年龄比较,P均>0.05,两组患者间具有可比性。
1.2 免疫组织化学染色
标本处理:组织标本经4%中性甲醛固定过夜,常规脱水,石蜡包埋,连续切片,片厚5 μm,敷于多聚赖氨酸预先处理的玻片上,晾干,进行免疫组织化学染色。染色方法:切片脱蜡至水,3%双氧水室温孵育约10 min,PBS浸泡2次,5 min/次,5%~10%正常山羊血清室温孵育30 min,倾去血清,勿洗;滴加一抗(兔抗人SOX4)工作液,4 ℃过夜,PBS冲洗3次;用含有生物素标记二抗的工作液室温孵育30 min,PBS冲洗3次,用辣根酶标记链霉卵白素工作液在室温孵育30 min;PBS冲洗后DAB 显色,自来水充分冲洗,复染;脱水,透明,封片。
1.3 结果判断
阳性反应为恶性黑素瘤组织呈棕褐色或棕黄色颗粒,高倍镜下(×400)随机选3个视野,计数每个视野下阳性细胞,依据SOX4的染色强度计分和判断标准:无色(0分),淡黄色(1分),棕黄色(2分),棕褐色(3分)。阳性细胞百分率不着色为0分,<10%为1分,10%~50%为2分,>50%为3分。上述两类积分相乘为最后积分:0~1分为(一),2~3分为(+),4~6分为(++),>6分为(+++)[5]。积分判定由2名病理科医生进行。
1.4 分析指标
①比较两组研究对象的SOX4阳性积分。②分析SOX4阳性积分与恶性黑素瘤临床病理特征的相关性。③分析SOX4表达与恶性黑素瘤转移的关系。
1.5 统计学方法
应用SPSS 17.0软件包进行分析,用表示计量资料,比较进行t检验;计数资料行χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 两组SOX4阳性表达积分比较
恶性黑素瘤组患者的SOX4阳性表达积分明显高于对照组,比较有统计学意义(P<0.01)。见表1。

表1 两组SOX4阳性表达积分比较分]
2.2 SOX4阳性表达与恶性黑素瘤临床特征的关系
恶性黑素瘤组织中SOX4阳性表达与患者年龄、性别无明显相关(P>0.05),与Breslow分级、Clark分级和溃疡形成显著相关(P<0.01)。见表2。

表2 SOX4阳性表达与恶性黑素瘤临床病理特征的关系(例,%)
2.3 SOX4阳性表达与恶性黑素瘤转移的关系
3组恶性黑素瘤患者SOX4阳性表达率分别为69.23%、95.45%、100.00%,转移组明显高于原位组,差异有统计学意义(P<0.01)。见表3。
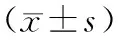
表3 SOX4阳性表达与恶性黑素瘤转移的关系
3 讨论
恶性黑素瘤源于神经嵴黑素细胞,具有高侵袭、高转移等临床特征。目前临床治疗恶性黑素瘤的方法包括化学治疗、手术和生物治疗等,由于恶性黑素瘤细胞对化疗药物具有较好的耐受性,且转移性高,常规化疗无法有效杀灭癌细胞[6]。研究表明,在早期阶段对恶性黑素瘤给予手术为主,患者的预后好[7]。因此,探讨恶性黑素瘤的早期临床特征相关标志物或与其病情发展、转移相关指标具有重要意义。近年,与恶性黑素瘤临床特征相关的标志物陆续得到报道,如肿瘤相关巨噬细胞[8]、血管内皮细胞生长因子-C[9]、缺氧诱导因子1[10]及金属蛋白酶抑制剂4[11]等,然而恶性黑素瘤的发生、发展及转移涉及多种因子、蛋白和基因,对恶性黑素瘤作出全面、精确的早期诊断,探求其他有效的标志物是当前临床面临的重要医学问题。
SOX4为SOX 转录因子家族成员,在肿瘤细胞的增殖、凋亡或分化中发挥了双重作用(促癌和抑癌效应)[12]。研究表明,SOX4在多种肿瘤组织中的表达呈升高表达,与肿瘤的发展发展联系密切[12]。越来越多研究发现,SOX4在许多肿瘤如乳腺癌、肺癌、结肠癌及肝癌中的表达显著升,目前虽然SOX4在肿瘤病情中发挥作用的具体机制尚不清楚[13]。本研究观察发现,恶性黑素瘤患者的SOX4阳性表达积分明显高于对照组(P<0.01)。因此,SOX4可能与恶性黑素瘤的发生发展联系密切。为了进一步探讨SOX4表达与恶性黑素瘤临床病理特征及其转移的关系,笔者分析了SOX4阳性表达与恶性黑素瘤患者的年龄、性别、分期、浸润等的关系,结果发现:恶性黑素瘤组织SOX4阳性表达与与年龄、性别无明显相关(P>0.05),与Breslow分级、Clark分级和溃疡形成有显著性差异(P<0.01)。因此,SOX4表达与恶性黑素瘤临床病理特征联系密切。
晚期恶性黑素瘤的临床治疗效果较差,患者的生存率和生存时间均较低,恶性黑素瘤病灶细胞转移是其主要因素之一。恶性黑素瘤具有高度侵袭性,可向身体任何部位转移,其中约1/3的恶性黑素瘤可发生远处转移,如可转移至肺、肾上腺、胃及脑等部位,这些患者的预后取决于恶性黑素瘤的转移位置[14]。故笔者分析SOX4阳性表达与恶性黑素瘤转移的相关性,将所有患者分为原位组、局部转移组和远处转移组,结果显示:3组恶性黑素瘤患者的SOX4阳性表达率分别为69.23%、95.45%、100%,转移组明显高于原位组,差异有统计学意义(P<0.01)。因此,SOX4阳性表达改变是恶性黑素瘤转移的相关生物学指标。
SOX4参与肿瘤发生、发展的机制尚待阐明。SOX4在多种肿瘤中呈上调表达,其可促进细胞增殖和抑制细胞凋亡,以此促进肿瘤发生,SOX4促进肿瘤干细胞增殖介导了肿瘤发展和转移[12]。在黑色素瘤中SOX4能够结合NF-κB p50启动子的上游靶位,抑制p50表达,达到干扰肿瘤细胞的侵袭和转移的效果。SOX4表达与恶性黑素瘤发生、发展及其转移的调节机制有待于进一步探讨。
综上所述,恶性黑素瘤患者组织标本中SOX4呈上调表达,且与患者的临床病理特征呈显著性相关,是临床评价其转移和预后的重要标志物。
[1] 马文宇,吴邓婷.中药植物多糖对恶性黑素瘤作用的实验研究进展〔J〕.皮肤病与性病,2016,38(1):33-35.
[2] 杨会杰,魏 民,庞雅青,等.SOX4在乳腺癌组织中的表达及临床意义〔J〕.中国现代普通外科进展,2014,17(6):459-461.
[3] 刘辅仁.实用皮肤科学〔M〕.北京:人民卫生出版社,2005:1044.
[4] Kanzler MH,Mraz-Gernhard S.Treatment of primary cutaneous melanoma〔J〕.JAMA,2001,285(14):1819-1821.
[5] Bosman FT,de Goeij AF,Rousch M.Quality control in immunocytochemistry:experiences with the oestrogen receptor assay〔J〕.J Clin Pathol,1992,45(2):120-124.
[6] Li W,Yu Y,Wang H,et al.Evaluation of the prognostic impact of postoperative adjuvant radiotherapy on head and neck mucosal melanoma:a meta-analysis〔J〕.BMC Cancer,2015,15:758.
[7] 张衍波,何梅芳,刘博武,等.恶性黑素瘤治疗和研究进展〔J〕.中华保健医学杂志,2015,17(3):251-253.
[8] 殷 芳,吴 飞,陈 佳,等.TAMs在皮肤恶性黑素瘤组织中的浸润及与STAT3、VEGF蛋白表达的关系〔J〕.中华全科医学,2013,11(6):840-843.
[9] 陈燕辉,于建斌,张江安.VEGF-C在皮肤恶性黑素瘤中的表达及其意义〔J〕.医药论坛杂志,2012,33(5):33-34.
[10] 周 璐,胡 彬,黄莹雪,等.缺氧诱导因子1α在肢端恶性黑素瘤组织中的表达〔J〕.中华皮肤科杂志,2014,47(9):615-618.
[11] 黄莹雪,周 璐,张 耩,等.基质金属蛋白酶抑制剂4在皮肤恶性黑素瘤中的表达及其与肿瘤发生、侵袭和转移的相关性〔J〕.中华皮肤科杂志,2013,46(8):565-569.
[12] 董 菲,孙成铭.SOX4在肿瘤中的研究进展〔J〕.现代肿瘤医学,2016,24(9):1473-1476.
[13] 潘 欣,何 昆,张维娜,等.SOX4能与p53蛋白发生相互作用〔J〕.生物技术通讯,2008,19(6):817-819.
[14] 梁 鹏,陈学忠,宋建民,等.恶性黑素瘤的治疗进展〔J〕.中华皮肤科杂志,2012,45(4):293-295.

