白蛋白结合型紫杉醇与紫杉醇脂质体治疗复发性卵巢癌的临床研究
思美丽 吴文湘
卵巢癌是生殖系统常见恶性肿瘤,可发生于幼女至绝经期前的任何年龄段,其发病率位居女性生殖道肿瘤第3位,而死亡率位居第1位,5年生存率仅为25%~30%。对于复发卵巢癌患者,目前国际上尚无标准治疗方案,而手术治疗时,因要考虑年龄、缓解期、孤立的可切除病灶、患者身体状况综合评价、有无转移等众多因素及禁忌证,不宜作为首选治疗方法,因此疗效显著、不良反应小的化疗方案的开发对于治疗复发性卵巢癌意义重大。紫杉醇是治疗妇科肿瘤常见化疗药物,但传统使用方法具有不良反应大等缺陷,近年来科学家以降低毒性、提高疗效为出发点研制出了脂质体型、白蛋白结合型等新剂型紫杉醇,且其各自在复发性卵巢癌中的显著疗效及安全性得到了众多临床研究证实[1-2],但关于两者在复发性卵巢癌中的疗效和安全性的差异的相关研究较少见。因此本研究拟对比分析白蛋白结合型紫杉醇与紫杉醇脂质体治疗复发性卵巢癌的疗效和安全性差异。
1 资料与方法
1.1 一般资料
以2013年1月至2016年6月榆林市第二医院和北京大学第一医院收治的60例复发性卵巢癌患者为研究对象,所有患者均经病理检查确诊为卵巢癌,经影像学检查确定存在至少1个可测量病灶,预计生存期在3个月以上,Karnofsky(KPS)功能状态评分在60分以上,病历资料完整,均初诊后在本院接受肿瘤细胞灭活手术和(或)化疗后疗效达到完全缓解水平,无其他恶性肿瘤疾病史;复发的迹象和证据根据相关诊疗标准判断[3],初治至复发时间大于6个月。排除骨髓功能障碍者,存在肝、肾功能异常,心电图、血常规异常者,对研究药物过敏者,存在化疗禁忌证者,在入组前4周内接受过放疗或化疗者。将60例患者根据入组先后顺序分为观察组和对照组,每组30例。观察组患者年龄32~65岁,平均年龄(52.1±8.6)岁,体重40~75 kg,平均体重(59.8±10.6)kg;对照组患者年龄32~63岁,平均年龄(51.2±9.6)岁,体重40~73 kg,平均体重(58.0±10.3)kg,KPS评分60~79分,平均(64.9±67.2)分。2组一般资料比较,差异无统计学意义(P>0.05)。 2组的病理类型、临床分期、复发病灶数、有无腹水、血清肿瘤标志物CA125水平等病理特征资料比较,差异均无统计学意义(P>0.05)。见表1。本研究经医院伦理委员会批准,所有患者及家属均知情同意。
1.2 方法
对照组:给予紫杉醇脂质体联合奈达铂治疗。第1天,紫杉醇脂质体(厂家:南京绿叶思科药业有限公司,国药准字H20030357,规格:30 mg)130~170 mg/m2,溶于500 mL 5%的葡萄糖溶于静脉滴注,3 h静脉滴注完毕;第2天,紫杉醇脂质体联合奈达铂,紫杉醇脂质体用药量同第1天,奈达铂(厂家:江苏奥赛康药业股份有限公司,国药准字H20064295,规格:50 mg)85~105 mg/m2,溶于500 mL 0.9%的氯化钠溶液中静脉滴注,滴注时间不少于1 h。

表1 2组病理特征资料比较(例,%)
观察组:给予白蛋白结合型紫杉醇联合奈达铂治疗。第1天,白蛋白结合型紫杉醇(厂家:美国 Abraxis BioScience,H20091059,规格:100 mg)260 mg/m2,先取100 mg药物溶于20 mL 的0.9%氯化钠溶液中,专用输液器缓慢滴注30 min,确定无明显反应后将剩余药物与0.9%氯化钠溶液按5∶1配制后静脉滴注,30 min经静脉滴注完毕。
同时2组所有患者均给予奈达铂(国药准字H20064295,江苏奥赛康药业股份有限公司,规格:50 mg)90 mg/m2溶于500 ml生理盐水注射液,行静脉滴注。
2组患者均于治疗开始前12 h及6 h按照紫杉醇用药说明书给予地塞米松、西咪替丁等预防过敏的正规处理。化疗之后继续给予1500~2000 mL 的0.9%的氯化钠溶液补液,以保证足够尿量,降低化疗药物对肾小管的影响,治疗期间均给予全程心电检测。2组均3周为1个疗程,每例患者至少化疗2个疗程,最多不超过8个疗程。
1.3 观察指标
近期临床疗效:2组患者均于2个疗程结束后行CT、MRI、彩超等影像学及血清肿瘤标志物(CA125)检查,根据WHO实体客观瘤的疗效评价标准评价近期疗效。完全缓解(CR):所有可见病灶均完全消失,CA125降至正常水平(<35 U/ml),并维持4周以上;部分缓解(PR):肿瘤病灶体积缩小50%以上,CA125降低一半以上,维持4周以上;稳定(SD):病灶体积缩小不足50%;进展(PD):病灶体积增大或出现新病灶。生活质量:采用KPS量表评价2组治疗前及治疗结束后3个月时的生活质量,总分0~100分,分值越高,生活质量越高。不良反应:根据WHO的抗肿瘤药物急性与亚急性不良反应分度评价标准评价2组治疗期间的血液系统、胃肠道、肾和膀胱、神经系统的不良反应。
1.4 统计学方法
采用SPSS17.0统计学软件,计量资料以均值标准差表示,采用t检验;计数资料以%表示,采用卡方检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 2组临床疗效比较
治疗2个疗程后,观察组的总有效率高于对照组,但差异无统计学意义(P>0.05);观察组的CR率显著高于对照组(P>0.05)。见表2。

表2 2组临床疗效比较(例,%)
2.2 2组生活质量比较
治疗前,观察组和对照组的KPS评分分别为(65.3±6.1)分和(64.9±6.2)分,差异无统计学意义(P>0.05);治疗后观察组和对照组的KPS评分分别为(75.2±5.5)分和(70.5±5.9)分,均较治疗前显著升高(P<0.05),且观察组治疗后的KPS评分显著高于对照组(t=-23.192,P<0.05)。见表3。
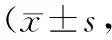
表3 2组KPS评分比较分)
2.3 2组不良反应发生情况比较
经统计分析,2组的中心粒细胞减少、血小板减少、血红蛋白减少、谷丙转氨酶升高的发生率比较,差异均无统计学意义(P>0.05);但观察组0级白细胞减少的发生率显著高于对照组(χ2=7.200,P<0.05),Ⅲ~Ⅳ级恶心呕吐、腹泻的发生率显著低于对照组(χ2=9.317、χ2=9.231,P<0.05)。见表4。
3 讨论
卵巢癌最常见临床症状为下腹部不适,其中60%的患者一侧腹部会出现包块,但无触痛,无特别症状,因此常被患者忽视,等出现突发腹痛、恶心、呕吐等急发症状时,患者病情往往已进展至晚期[4],且目前临床尚缺乏早期有效的诊断方法,因此约70%的患者在诊断时已处于晚期,而对于此类患者经最大限度肿瘤细胞减灭术联合紫杉醇和铂类等化疗后,其中又有70%左右的患者会在治疗后2年内复发[5]。对于复发的卵巢癌患者在诊治时应遵循及时发现、缓解一般症状,改善患者生存质量,延长生存时间的基本治疗原则[6]。虽然目前临床尚无对于复发卵巢癌统一有效的治疗方法,但足量的化学治疗仍然是目前延长复发性卵巢癌患者生存期、改善生活质量的主要手段[7]。

表4 2组不良反应发生情况比较(例,%)
注:*为与对照组比较,P<0.05。
紫杉醇是从短叶红豆杉植物皮中提取的紫杉烷类抗癌药物,抗肿瘤活性的作用机制为干预癌细胞的微管蛋白,使癌细胞的有丝分裂停止,细胞生长终止,促进癌细胞萎缩、凋亡,但紫杉醇水溶性极低,因此为了解决紫杉醇的水溶性问题,紫杉醇脂质体和白蛋白结合型紫杉醇应运而生[8]。紫杉醇脂质体是将紫杉醇经脂质体包裹在卵磷脂中,不仅解决了紫杉醇的水溶性问题,且脂质体本身毒副作用小,对癌细胞和淋巴结还具有较强的靶向识别作用[9]。因脂质体的磷脂膜分解与磷酸酯酶的含量呈正比关系,而肿瘤组织中磷酸酯酶水平要显著高于正常组织,因此可提高紫杉醇在肿瘤组织的药物浓度,进而提高临床治疗效果,降低毒副作用[10]。白蛋白结合型紫杉醇系将紫杉醇经纳米技术与人血白蛋白结合,形成130 nm的颗粒,自2005年在美国问世后,广泛应用于各种恶性肿瘤的治疗中。白蛋白与血管细胞膜表面的相关受体结合后通过胞吞作用将结合的紫杉醇送入细胞内。白蛋白在机体中的一个主要生理功能为运输营养物质,而肿瘤细胞的增殖、分化速度较正常细胞快,摄取营养物质亦较正常细胞丰富,因此与白蛋白结合更多,进而提高紫杉醇在肿瘤组织内聚集浓度[11-12]。
本研究中,2组的病理类型、临床分期、复发病灶数、有无腹水、血清肿瘤标志物CA125水平等病理特征资料比较,差异均无统计学意义(P>0.05),进而排除了病理特征对研究结果的干扰。治疗2个疗程后,观察组的CR率显著高于对照组(P<0.05),提示,与紫杉醇脂质体比较,白蛋白结合型紫杉醇与奈达铂联合治疗复发卵巢癌的近期临床疗效更显著,与程海荣等[13]研究结果基本一致。本研究还进一步观察了2种制剂对患者生活质量的影响,结果显示,治疗后观察组和对照组的KPS评分均较治疗前显著升高(P<0.05),且观察组治疗后的KPS评分显著高于对照组(P<0.05),提示白蛋白结合型紫杉醇在改善患者生活质量方面的效果更加显著。观察组白细胞减少、周围神经炎(即0级)的发生率显著高于对照组(P<0.05),恶心呕吐、腹泻的Ⅲ~Ⅳ级发生率显著低于对照组(P<0.05),提示与紫杉醇脂质体比较,白蛋白结合型紫杉醇的毒副作用更小,安全性更高。但本研究仍然存在不足,其为单中心研究,且样本量较少,未对远期疗效进行对比,因此可能结果存在一定偏倚。
综上所述,与紫杉醇脂质体比较,白蛋白结合型紫杉醇治疗复发性卵巢癌的临床疗效更高,可显著改善患者的生活质量,且不良反应较少,安全性较高。
[1] Yoshioka S,Ota C,Moriguchi Y.Efficacy and safety of neoadjuvant chemotherapy containing nanoparticle albumin-bound paclitaxel(NabPTX) in operable human epidermal growth factor receptor 2-positive breast cancer〔J〕.Gan To Kagaku Ryoho,2016,43(5):579-582.
[2] 梁 旭,李惠平,邸立军,等.白蛋白结合型紫杉醇治疗晚期难治性乳腺癌的疗效及安全性分析〔J〕.中国癌症杂志,2014,24(11):836-845.
[3] 沈 铿,郎景和.复发性卵巢恶性肿瘤的诊治规范(建议)〔J〕.中华妇产科杂志,2003,38(11):717-719.
[4] Skates SJ,Xu FJ,Yu YH,et al.Toward an optimal algorithm for ovarian cancer screening with longitudinal tumor markers〔J〕.Cancer,2015,76(S10):2004-2010.
[5] Rose PG.Surgery for recurrent ovarian cancer〔J〕.Semin Oncol,2000,27(3 Suppl 7):17-23.
[6] Matsumoto K,Onda T,Yaegashi N.Pharmacotherapy for recurrent ovarian cancer:current status and future perspectives〔J〕.Jpn J Clin Oncol,2015,45(5):408-410.
[7] Havrilesky LJ,Alvarez SA,Ehrisman JA,et al.Patient preferences in advanced or recurrent ovarian cancer〔J〕.Cancer,2015,120(23):3651-3659..
[8] 张倩雯,蒋志文,刘 浩.紫杉醇新剂型的研究进展〔J〕.蚌埠医学院学报,2015,40(1):137-140.
[9] 周宏萍,刘 耘.紫杉醇脂质体在妇科恶性肿瘤治疗中药代动力学与不良反应的关系〔J〕.现代肿瘤医学,2015,23(19):2841-2844.
[10] 武梦娇,王 峰,宋丽杰,等.紫杉醇脂质体或常规紫杉醇联合S-1治疗进展期胃癌:药代动力学、疗效及安全性的比较〔J〕.肿瘤,2016,36(3):303-309.
[11] Tanaka S,Iwamoto M,Kimura K,et al.Phase Ⅱ study of neoadjuvant anthracycline-based regimens combined with nanoparticle albumin-bound paclitaxel and trastuzumab for human epidermal growth factor receptor 2-positive operable breast cancer〔J〕.Clin Breast Cancer,2015,15(3):191-196.
[12] 曾 靖,张 蓉,黄曼妮,等.白蛋白结合型紫杉醇联合铂类治疗晚期或复发性妇科肿瘤的临床分析〔J〕.癌症进展,2014,12(4):387-393.
[13] 程海荣,关 慧,陈 杰.白蛋白结合型紫杉醇与紫杉醇脂质体治疗复发性卵巢癌近期疗效与安全性分析〔J〕.实用妇产科杂志,2015,31(3):229-232.

