ER、VEGF、TGF-β1在增生期子宫内膜良恶性肿瘤中的表达及其相关性研究
李桃英 高珊珊 刘鹏森 朱宝菊
近年来,我国妇女增生期子宫内膜肿瘤的发病率不断增高,多数子宫内膜癌患者可在早期确诊,早期手术治疗的治愈率较高。但目前仍有少数特殊病理类型发展较快,短时间内转移率较高,且复发率高,影响着女性的生殖健康。我们用基因芯片分析了增生期子宫内膜肿瘤基因表达谱,发现雌激素受体(ER)、血管内皮生长因子(VEGF)和转化生长因子-β1(TGF-β1)是上调表达最为显著的内分泌分子[1]。最新研究提示ER、VEGF、TGF-β1参与了多种生理病理过程,包括细胞生长调节、炎症反应、细胞间黏附以及免疫调节,其异常表达可能在增生期子宫内膜肿瘤的形成和发展中可能起重要作用[2]。因此,本课题拟用分子生物学和免疫组织学技术,分析ER、VEGF、TGF-β1在增生期子宫内膜良恶性肿瘤患者中的表达情况,探讨与增生期子宫内膜良恶性肿瘤表达的关系,总结ER、VEGF、TGF-β1是否可作为增生期子宫内膜良恶性肿瘤早期诊断、术前辅助诊断和病情监测标记物,揭示ER、VEGF、TGF-β1与增生期子宫内膜良恶性肿瘤的预后关联性,为增生期子宫内膜良恶性肿瘤的早期诊治提供理论依据。
1 材料与方法
1.1 病例的收集
纳入我院2013年7月至2016年7月妇科行增生期子宫内膜良恶性肿瘤病例样本共计48例,其中良性肿瘤20例,恶性肿瘤28例,年龄为40~65岁,平均年龄为(52.36±6.53)岁。对所有手术治疗的患者进行随访观察,平均随访时间为12个月。同时纳入健康对照组女性患者30例,其一般资料与增生期子宫内膜良性及恶性肿瘤组比较差异无统计学意义,具有可比性。收集标本前该临床试验研究通过了医院伦理委员会的批准,所有病例患者签订知情同意书。
1.2 RNA提取及RT-PCR反应
对48例增生期子宫内膜良恶性肿瘤组织进行RNA提取,采用RNU6作为内参进行校正。采用QIAquick RNA Extraction Kit(购自QIAGEN公司,德国)检测ER、VEGF、TGF-β1的相对表达量。第一步是通过茎环引物来合成互补DNA,对ER、VEGF、TGF-β1的表达水平采用二步法进行检测,采用RNA逆转录反应体系进行,总的RNA浓度调整2 ng/μl,在PCR管加入10 μl的逆转录缓冲液,最后加入5 μl的逆转录引物,在冰上混匀之后反应5 min,温度时间递减,接着进行梯度变性反应,采用Platinum SYBR Green qPCR反应体系为2×的 PCR Taqman Universal的混合液,通过逆转录体系进行反应,Taqman RNA的特异性引物,将体积扩增至20 μl,cDNA共5 μl加入到去RNA酶的水当中,通过循环反应递减的扩张之后,采用荧光实时定量反应,对实验结果进行分析,按照PCR操作说明,需要进行第二次检测。ER、VEGF、TGF-β1的相对表达量应用△Ct=CtER、VEGF、TGF-β1-CtRNU6的计算公式计算。
1.3 Western blotting方法
取病理组织提取100 mg总蛋白。凝胶电泳,半干法转膜,加ER、VEGF、TGF-β1一抗(1∶500),4 ℃孵育过夜;37 ℃孵育1h的辣根过氧化物酶标记的羊抗兔二抗(1∶1000)。以ECL光化学法显色,根据吸光度采用彩色图像分析系统进行检测。
1.4 免疫组化染色检测ER、VEGF、TGF-β1表达
ER、VEGF、TGF-β1抗体按1∶200稀释,采用SP法对子宫内膜组织标本及对照组组织标本进行免疫组织化学染色,PBS代替一抗作为阴性对照,已知阳性组织切片作为阳性对照,以出现淡黄色至棕褐色颗粒为阳性判断标准,显微镜下选取5个视野进行观察。
1.5 统计学检测
应用SPSS 20.0统计软件进行数据分析,ER、VEGF、TGF-β1阳性表达组间率的比较用卡方检验,ER、VEGF、TGF-β1的相对表达量组间均数比较采用t检验,统计学差异的以P<0.05表示。
2 结果
2.1 增生期子宫内膜肿瘤血清学ER、VEGF、TGF-β1的RNA相对表达量
增生期子宫内膜肿瘤组ER、VEGF、TGF-β1mRNA的表达水平均高于对照组,且恶性肿瘤组高于良性肿瘤组,组间比较差异具有统计学意义,见表1。
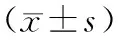
表1 增生期子宫内膜肿瘤血清ER、VEGF、TGF-β1的相对表达量比较
注:①为与对照组比较,P<0.05;②为与良性肿瘤组比较,P<0.05。
2.2 增生期子宫内膜肿瘤血清学ER、VEGF、TGF-β1的蛋白相对表达量
增生期子宫内膜肿瘤组ER、VEGF、TGF-β1蛋白的表达值均高于对照组,且蛋白表达量恶性肿瘤组高于良性肿瘤组,组间比较差异有统计学意义,见表2。
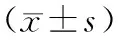
表2 增生期子宫内膜肿瘤血清ER、VEGF、TGF-β1的蛋白相对表达量
注:①为与对照组比较,P<0.05;②为与良性肿瘤组比较,P<0.05。
2.3 免疫组化检测结果
子宫内膜组织中ER、VEGF、TGF-β1阳性表达水平明显高于对照组(P<0.05),且恶性肿瘤组高于良性肿瘤组,两组比较差异具有统计学意义,见表3。
2.4 ER、VEGF、TGF-β1表达与增生期子宫内膜恶性肿瘤临床参数的相关性
ER、VEGF、TGF-β1表达与增生期子宫内膜恶性肿瘤的预后相关(P<0.05);ER、VEGF、TGF-β15表达与患者性别、年龄无关(P>0.05),见表4。

表3 ER、VEGF、TGF-β1 在子宫内膜组织及对照组中的表达情况/例
①为与对照组比较,P<0.05;②为与良性肿瘤组比较,P<0.05。

表4 ER、VEGF、TGF-β1表达与增生期子宫内膜肿瘤临床参数的相关性/%
3 讨论
增生性子宫内膜癌是1种常见的恶性妇科肿瘤,对于女性的生殖健康以及生活质量甚至生命安全等均造成严重的危害。子宫内膜癌占女性恶性生殖道肿瘤的约20%~30%[3],并且其发病率呈现上升和年轻化趋势。由于良性肿瘤具有恶变的可能,因此治疗方法上应当给予彻底手术治疗[4-6]。增生期子宫内膜恶性肿瘤的显著特点为早期症状不明显,给诊断较为困难,给患者及家庭带来了沉重的经济和社会负担[7-8]。
近年来血管因子可能在增生期子宫内膜良恶性肿瘤发病过程中起重要作用,血管因子在细胞增生、迁移发生过程中的重要意义受到学术界的重视[9],目前增生期子宫内膜良恶性肿瘤的子宫内膜间质中血管数比分泌期子宫内膜增多,关于该病血管因子方面的研究较少。形态学分析子宫内膜基底层血管显示子宫内膜肿瘤病患者血管数量、面积于增殖期和分泌期均较对照组显著增加,提示血管生成的改变可能为增生性子宫内膜疾病的发病机制之一[10]。证实VEGF及其家族成员不仅在肿瘤血管生成,首先从肿瘤细胞的分泌物中分离出来,在其它生理和病理的血管生成中都是必不可少的诱导因子[11]。ER它在组织中的表达反映了该组织的血管生成活性,是参与调控女性机体激素水平的重要激素[12]。研究表明,ER在增生期子宫内膜良恶性肿瘤的发病过程中起重要作用。增生期子宫内膜良恶性肿瘤的血管生成涉及到一系列细胞刺激因子和抑制因子,是1个复杂的过程,研究表明TGF-β1可活化血管因子,具有多种生物学功能,是1种以抑制免疫为主的负性因子,使增生期子宫内膜良恶性肿瘤得以逃避机体的免疫监视[13]。以上3种因子对促进新生血管的形成可能起共同作用,可以说具有作为诊断标志物的潜力,其异常表达可能在该病的形成和发展中可能起重要作用。
通常细胞发生病变转化时会出现相关基因的表型及其相关分子的改变,与正常细胞的生长特征不同,这些变化都可能成为细胞恶化的主要诱因,这也为我们寻找新的增生期子宫内膜良恶性肿瘤作用标志物及靶点提供了一定的线索[14]。本研究通过深入研究ER、VEGF、TGF-β1作病情监测、诊断(早期诊断)生物标记物的可能性;研究ER、VEGF、TGF-β1共表达的状况和消长关系,观察3个指标的互补应用的可能性。结果显示,增生期子宫内膜良恶性肿瘤与ER、VEGF、TGF-β1表达的相对表达量存在相关性;增生期子宫内膜肿瘤组ER、VEGF、TGF-β1mRNA、蛋白、阳性细胞表达量高于对照组,且恶性肿瘤组高于良性肿瘤组表达情况,组间比较差异具有统计学意义。3者的相对表达量水平与增生期子宫内膜良恶性肿瘤的复发具有着相关性。为增生期子宫内膜良恶性肿瘤的早期防治提供新的思路和药物作用的靶标,也对理解该病的分子机制和开发新的治疗药物提供理论依据,值得进一步深入探讨。
[1] 曹泽毅.中华妇产科学(临床版)〔M〕.北京:人民卫生出版社,2010:618-633.
[2] Arora V,Quinn MA.Endometrial cancer〔J〕.Best Pract Res Clin Obstet Gynaecol,2012,26(3):311-324.
[3] Bornstein J,Bentley J,Bösze P,et al.2011 colposcopic terminology of the international federation for cervical pathology and colposcopy〔J〕.Obstet Gynecol,2012,120(1):167-171.
[4] Chen Q,Guo F,Liu S,et al.Calcium channel blockers prevent endothelial cell activation in response to necrotic trophoblast debris:possible relevance to pre-eclampsia〔J〕.Cardiovasc Res,2012,96(3):484-493.
[5] Savelli L,Testa AC,Mabrouk M,et al.A prospective blinded comparison of the accuracy of transvaginal sonography and frozen section in the assessment of myometrial invasion in endometrial cancer〔J〕.Gynecol Oncol,2012,124(3):549-552.
[6] Gadre SS,Gupta SG,Gadre AS.Descriptive analytical study looking for agreement between colposcopic cervical findings and cervical exfoliative cytology〔J〕.Int J Reprod Contracept Obstet Gynecol,2013,2(3):404-409.
[7] Jacobs I,Gentry-Maharaj A,Burnell M,et al.Sensitivity of transvaginal ultrasound screening for endometrial cancer in postmenopausal women:a case-control study within the UKCTOCS cohort〔J〕.Lancet Oncol,2011,12(1):38-48.
[8] Akbayir O,Corbacioglu A,Numanoglu C,et al.Combined use of preoperative transvaginal ultrasonography and intraoperative gross examination in the assessment of myometrial invasion in endometrial carcinoma〔J〕.Eur J Obstet Gynecol Reprod Biol,2012,165(2):284-288.
[9] 吴 甜.子宫内膜癌临床及MRI分期与手术病理分期的对比研究〔J〕.中国医药指南,2013,11(6):459-460.
[10] 方 敏.子宫内膜异位症患者血清及组织CA125、TNF-α、VEGF水平联合检测的临床意义〔J〕.中国实验诊断学,2014,18(12):2027-2028.
[11] 齐之迎,尹利荣.子宫内膜异位症盆腔痛患者血清雌二醇与TNF-α水平变化的研究〔J〕.天津医药,2014,42(2):138-140.
[12] LE Donne M,Alibrandi A,Ciancimino L,et al.Endometrial pathology in breast cancer patients:Effect of different treatments on ultrasonographic,hysteroscopic and histological findings〔J〕.Oncol Lett,2013,5(4):1305-1310.
[13] Pantham P,Rosario R,Chen Q,et al.Transcriptomic analysis of placenta affected by antiphospholipid antibodies:following the TRAIL of trophoblast death〔J〕.J Reprod Immunol,2012,94(2):151-154.
[14] Fotopoulou C,Savvatis K,Kraetschell R,et al.Systematic pelvic and aortic lymphadenectomy in intermediate and high-risk endometrial cancer:lymph-node mapping and identification of predictive factors for lymph-node status〔J〕.Eur J Obstet Gynecol Reprod Biol,2010,149(2):199-203.

