靶向沉默异黏蛋白基因对膀胱癌细胞凋亡的影响及其作用机制
尹合奎,袁敬东
1阳新县妇幼保健院,湖北黄石 435200;2武汉市第一医院,湖北武汉 430000
膀胱癌是发生在膀胱黏膜上的泌尿系统恶性肿瘤,发病率在我国泌尿生殖系统肿瘤中占首位。目前认为遗传、吸烟和接触芳香类化学物质等是导致膀胱癌的主要原因[1]。世界上每年死于膀胱癌的人数约为15万,我国2015年膀胱癌的发病人数和死亡人数分别为8.05万和3.29万[2-3],多数患者就诊时已出现转移,导致预后效果很差,寻找新的有效治疗手段已成为一种迫切需要。研究表明,在膀胱癌中存在异常表达的特定基因,且与膀胱癌的发生发展密切相关,可能作为膀胱癌治疗的新靶点[4]。异黏蛋白(metadherin,MTDH)是近年来发现的一种癌基因,在乳腺癌、胃癌和肝癌等多种肿瘤细胞中过表达,与多种肿瘤的发生发展及预后密切相关[5-10]。有研究发现,MTDH在膀胱癌中过表达[11]。目前关于MTDH基因在膀胱癌中的作用机制并不清晰,RNA干扰(RNA interference,RNAi)技术是一种通过小的双链RNA(small interference RNA,siRNA)促使体内特定基因mRNA降解,实现基因沉默或关闭的常用方法。本研究通过siRNA干扰技术沉默MTDH基因,探讨其对膀胱癌BIU-87细胞凋亡的影响及其作用机制,为深入研究MTDH在膀胱癌细胞生物学功能及其分子机制提供理论依据。
材料和方法
1 实验材料 人膀胱上皮永生化细胞株SVHUC-1和人膀胱癌细胞株BIU-87购于中科院上海研究所。10%胎牛血清购于杭州四季青公司,胰蛋白酶和DMEM培养基购于美国Hyclone公司。兔抗MTDH单克隆抗体、兔抗甘油醛-3-磷酸脱氢 酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体和辣根过氧化物酶标记的羊抗兔IgG(IgG-HRP)抗体均购于美国Sigma公司。兔抗B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)单克隆抗体和兔抗Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)单克隆抗体购于美国Sigma公司。膜联蛋白-V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒和二喹啉甲酸(bicinchoninic acid,BCA)蛋白含量检测试剂盒分别购于上海碧云天生物技术有限公司和南京凯基生物科技有限公司。Lipofectamine 2000转染试剂、总RNA提取试剂盒、逆转录试剂盒和蛋白提取试剂盒均为美国Invitrogen公司产品。MTDH1-siRNA、MTDH2-siRNA、MTDH3-siRNA、Control-siRNA和PCR扩增引物序列由上海吉玛公司合成。MTDH1-siRNA正义链序列为5'-GCCAUCUGUAAUCUUAUCATT-3',反义链序列为5'-UGAUAAGAUUACAGAUGGCTT-3';MTDH2-siRNA正义链序列为5'-GCUGUUCGAACACCUCAA ATT-3',反义链序列5'-UUUGAGGUGUUCGAACA GCTT-3';MTDH3-siRNA正义链序列为5'-GCCG UAAUCAACCCUAUAUTT-3',反义链序列为5'-AU AUAGGGUUGAUUACGGCTT-3';Control-siRNA 正义链序列为5'-UUCUCCGAACGUGUCACGUTT-3',反义链序列为5'-ACGUGACACGUUCGGAGAATT-3'。
2 细胞培养、转染及分组 取保存于液氮中的膀胱癌BIU-87细胞和膀胱上皮永生化SV-HUC-1细胞,于37℃水浴中复苏后,种植于含有10%胎牛血清的DMEM培养基中,在温度为37℃、体积分数为5% CO2和湿度为95%的恒温培养箱中常规培养。待细胞生长密度为80%以上时,加入0.25%胰酶消化,以1∶2传代培养。取对数生长期BIU-87细胞,经0.25%胰蛋白酶消化后,调整细胞浓度以10 000/ml接种于6孔细胞板中,将其随机分组:以转染MTDH1-siRNA序列的细胞为siRNA MTDH1组,转染MTDH2-siRNA序列的细胞为siRNA MTDH2组,转染MTDH3-siRNA序列的细胞为siRNA MTDH3组,转染Control-siRNA序列的细胞为siRNA NC组,以不做任何处理的细胞为NC组。按照脂质体转染说明书的操作步骤转染上述各组细胞,转染后继续培养6 h,更换培养基,在常规条件下继续培养48 h后收集细胞进行后续实验。
3 RT-PCR检测MTDH mRNA的表达 收集对数生长期BIU-87细胞和SV-HUC-1细胞,培养48 h后,根据Trizol试剂说明书提取细胞总RNA,以BCA蛋白浓度检测试剂盒检测RNA浓度。采用逆转录试剂盒进行逆转录合成cDNA。以cDNA为模板进行PCR扩增。扩增条件:95℃预变性5 min(1个循环),95℃变性30 s(40个循环),60℃退火30 s(40个循环),72℃延伸45 s(40个循环),72℃总延伸5 min(1个循环)。总反应体系为20 μl。以GAPDH为内参,计算BIU-87细胞和SV-HUC-1细胞中MTDH mRNA的相对表达量。其中MTDH上游引物序列为5'-GGGGAAGGAGTTGGAGTGAC-3',下游引物序列为5'-GTAGACTGAGAAACTGGCT CAGCAG-3';GAPDH上游引物为5'-CGGAGTCAA CGGATTTGGTCGTAT-3',下游引物5'-AGCCTTCT CCATGGTGGTGAAGAC-3'。采用同样方法检测培养 48 h的 siRNA MTDH1组、siRNA MTDH2组、siRNA MTDH3组、siRNA NC组和NC组细胞中MTDH mRNA的相对表达量。
4 Western blot检测MTDH蛋白的表达 收集培养48 h后的BIU-87细胞和SV-HUC-1细胞,按照细胞蛋白提取试剂盒说明书提取细胞蛋白,BCA法检测提取的蛋白样品的浓度及纯度。以每孔50 μg蛋白样品,上样到十二烷基硫酸钠聚丙烯酰胺凝胶中电泳,转印至聚偏二氟乙烯膜,经5%脱脂奶粉封闭1 h后,与稀释1∶800的特异性一抗体(兔抗MTDH单克隆抗体和兔抗人GAPDH单克隆抗体)在4℃孵育24 h后,再与稀释1∶1 000倍的二抗(IgG-HRP)37℃孵育2 h。以化学发光法显色,Bio-Rad凝胶电泳成像仪拍照。以GAPDH为内参,采用Quantity One软件进行条带灰度分析,以MTDH蛋白条带的灰度/GAPDH蛋白条带灰度的比值表示BIU-87细胞和SV-HUC-1细胞中MTDH蛋白表达量。同样方法检测siRNA MTDH1组、siRNA MTDH2组、siRNA MTDH3组、siRNA NC组和NC组细胞中MTDH蛋白的相对表达量。
5 流式细胞仪检测细胞凋亡 收集转染48 h的siRNA MTDH 组 (即 siRNA MTDH3组 )、siRNA NC组和NC组细胞,调整细胞浓度为5 000/ml,经预冷的磷酸盐缓冲液洗涤,加入500 μl结合缓冲液重悬细胞,根据Annexin-V-FITC/PI凋亡试剂盒说明书步骤进行操作,以流式细胞仪检测各组细胞的细胞凋亡率,实验重复3次。
6 Western blot检测Bcl-2和Bax蛋白表达 取NC组、siRNA NC组、siRNA MTDH组(即siRNA MTDH3组)细胞培养48 h后,以细胞蛋白提取试剂盒提取各组细胞蛋白,再按照上文中的实验步骤检测凋亡相关蛋白Bcl-2和Bax的表达情况。
7 数据处理 所得数据均采用SPSS21.0软件进行统计学分析,以-x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
结 果
1 MTDH在膀胱癌BIU-87细胞中高表达 图1和表1结果显示,与膀胱上皮永生化SV-HUC-1细胞相比,膀胱癌BIU-87细胞中MTDH mRNA和蛋白表达量均显著升高,差异有统计学意义(P<0.05)。
2 MTDH-siRNA下调膀胱癌BIU-87细胞中MTDH的表达 图2和表2结果显示,与NC组相比,siRNA MTDH2和siRNA MTDH3组细胞中MTDH mRNA和蛋白表达量明显降低(P<0.05),且siRNA MTDH3组较siRNA MTDH2组降低幅度要大;siRNA NC组与siRNA MTDH1中MTDH mRNA和蛋白表达量差异无统计学意义(P>0.05)。由于siRNA MTDH3组中MTDH的表达下降最为显著,故后续选用siRNA MTDH3进行实验。
3 MTDH基因沉默可诱导膀胱癌BIU-87细胞凋亡 转染MTDH-siRNA 48 h后,流式细胞仪检测结果(图3)显示,NC组、siRNA NC组和siRNA MTDH组中BIU-87细胞凋亡率分别为9.95%±1.26%、10.21%±1.58%和38.86%±2.52%。NC组、siRNA NC组和siRNA MTDH组中BIU-87细胞凋亡率经单因素方差分析差异有统计学意义(P=0.000),与NC组细胞凋亡率相比,siRNA MTDH组显著升高(P=0.000), siRNA-NC组差异无统计学意义(P> 0.05)。

表1 SV-HUC-1细胞和BIU-87细胞中MTDH mRNA和蛋白的相对表达Tab. 1 Relative expression of MTDH, mRNA and protein in SV-HUC-1 cells and BIU-87 cells (n=5)
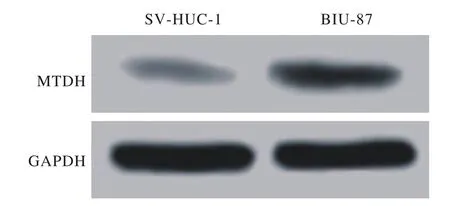
图1 Western blot检测SV-HUC-1细胞和BIU-87细胞中MTDH蛋白表达结果Fig. 1 Expression of MTDH protein in SV-HUC-1 cells and BIU-87 cells detected by Western blot

图2 Western blot检测转染MTDH-siRNA后膀胱癌BIU-87细胞MTDH蛋白表达结果Fig. 2 Detection of MTDH protein expression in bladder cancer BIU-87 cells transfected with MTDH-siRNA by Western blot
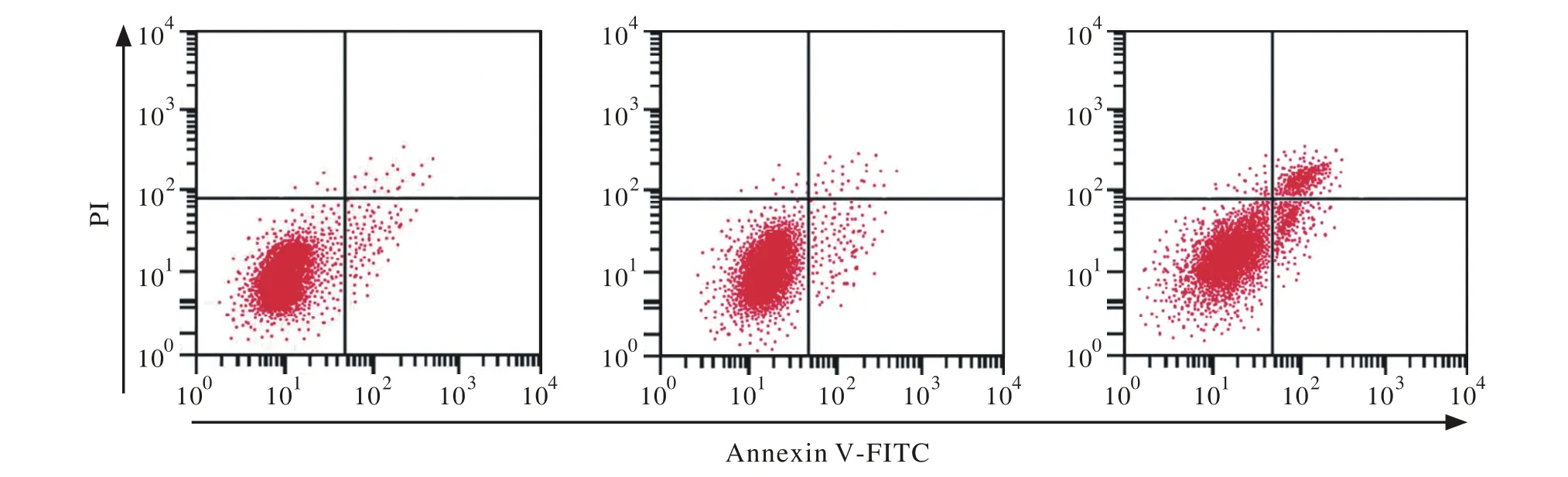
图3 转染siRNA-MTDH对膀胱癌BIU-87细胞凋亡的影响 左为NC组,中为siRNA NC组,右为siRNA MTDH组Fig. 3 Effect of siRNA-MTDH transfection on apoptosis of bladder cancer cell line BIU-87 Left: NC group; Middle: siRNA NC group; Right: siRNA MTDH group
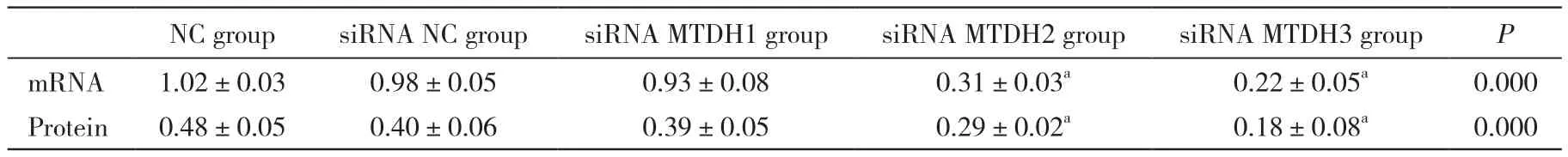
表2 转染MTDH-siRNA对膀胱癌BIU-87细胞MTDH mRNA和蛋白表达的影响Tab. 2 Effect of transfection of MTDH-siRNA on expression of MTDH mRNA and protein in bladder cancer BIU-87 cells (-x±s, n=5)
4 MTDH基因沉默可上调Bax和下调Bcl-2蛋白表达 表3和图4结果显示,与NC组相比,转染MTDH-siRNA后BIU-87细胞中p-Akt和Bcl-2蛋白表达量显著降低,p53和Bax蛋白表达量则显著升高,差异有统计学意义(P<0.05)。siRNA NC组与NC组相比,p53、p-Akt、Bcl-2和Bax蛋白表达量差异无统计学意义(P>0.05)。
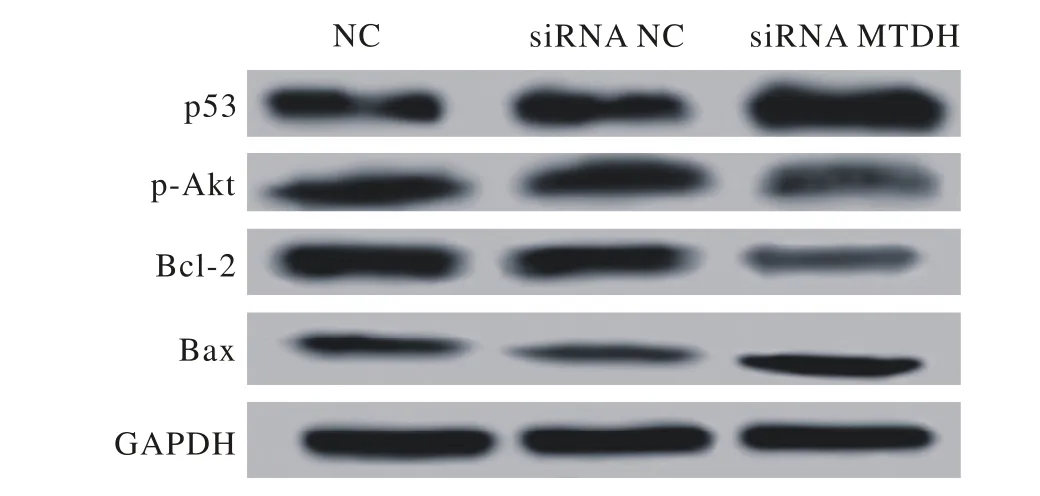
图4 转染MTDH-siRNA对p53、p-AKT、Bcl-2和Bax蛋白表达的影响Fig. 4 Effect of transfection of MTDH-siRNA on the expression of p53, p-AKT Bcl-2 and Bax proteins
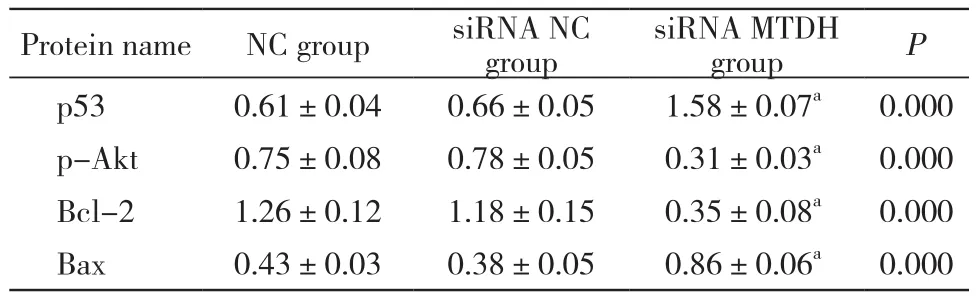
表3 转染MTDH-siRNA后BIU-87细胞中p53、p-AKT、Bcl-2和Bax蛋白的相对表达量Tab. 3 Relative expression of p53, p-AKT Bcl-2 and Bax proteins in BIU-87 cells after transfection with MTDH-siRNA (n=5)
讨 论
MTDH基因最早被发现于人胚胎初级星形胶质细胞,该基因位于人类8q22染色体上,由12个外显子和11个内含子构成,分布在胞膜、胞核、胞质及一些特定的核膜、核质和核仁中[12]。MTDH基因在多种肿瘤细胞中表达异常,可通过多种信号通路参与细胞生物学行为,被认为是一个提高化疗疗效、减少转移风险和调控人恶性肿瘤的潜在治疗靶点[13]。Meng等[14]研究发现敲除MTDH基因能够促进死亡受体TRAIL配体和HDAC抑制剂LBH589联合诱导的子宫内膜癌细胞死亡。Wang等[15]通过成功构建和转染重组质粒使乳腺癌MDA-MB-231细胞中MTDH基因的表达下降,结果发现敲除MTDH基因可显著抑制MDA-MB-231细胞增殖、运动和迁移。膀胱癌是一种威胁人们生命和健康的恶性肿瘤,其常见的组织病理类型有尿路上皮癌、鳞状细胞癌和腺细胞癌,其中尿路上皮癌占90%左右。膀胱癌的发生发展是一个复杂的过程,其发病机制尚不完全明确,寻找新的有效的分子靶点对膀胱癌的筛查、预后和治疗具有重要意义。Zhou等[16]研究发现MTDH基因在膀胱癌中呈现高表达,推测其与膀胱癌患者病情进展及整体存活率低密切相关。为了探讨MTDH基因与膀胱癌细胞凋亡的相关性,本研究通过siRNA干扰技术沉默膀胱癌BIU-87细胞中MTDH基因的表达,观察MTDH基因沉默后对BIU-87细胞凋亡的影响,结果发现BIU-87细胞凋亡率明显升,提示MTDH基因沉默可诱导膀胱癌细胞凋亡。
Bcl-2蛋白家族是目前公认的与细胞凋亡密切相关的蛋白家族,Bc1-2蛋白为抑凋亡蛋白,Bax蛋白为促凋亡蛋白,在细胞凋亡的基因调控过程中起着重要作用;野生型p53是一种抑癌基因,而其突变后则成为癌基因,失去了对细胞生长及凋亡的调控作用;Akt是经典PI3K/Akt信号通路中重要的激酶,活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白,调节细胞的增殖和凋亡等生理过程[17-19]。Bc1-2、Bax、p53在膀胱癌中异常表达,与肿瘤细胞的病理分级密切相关,并且升高p53表达可诱导细胞膀胱癌细胞凋亡;并且经过Akt抑制剂处理后的膀胱癌细胞增殖能力明显受到抑制,凋亡能力明显增强[20-22]。Bc1-2、Bax、p53和Akt通过激活一系列下游基因或蛋白在膀胱癌肿瘤细胞的凋亡过程中发挥着重要的调控作用。杜成等[23]在研究转移黏附基因下调对乳腺癌SKBR-3细胞增殖和凋亡的影响的实验中发现,下调MTDH基因表达可诱导乳腺癌SK-BR-3细胞凋亡,其作用机制可能与Bcl-2的表达下调有关。Zou等[24]研究发现,MTDH shRNA可能通过降低抗凋亡蛋白Bcl-2的表达和增加促凋亡蛋白Bax表达诱导非小细胞肺癌A549细胞凋亡。Li等[25]研究发现,敲除MTDH后,抑制肝癌细胞生长,并诱导细胞凋亡,其作用机制可能与促进PTEN和p53的表达、抑制Akt磷酸化有关。为了探讨MTDH基因在膀胱癌细胞凋亡中的作用机制,本研究通过Western blot检测沉默MTDH基因后BIU-87细胞中Bcl-2和Bax蛋白的表达,结果发现,Bcl-2蛋白的表达明显下降,Bax蛋白的表达明显上升。结果提示,MTDH基因沉默诱导BIU-87细胞凋亡,其作用机制可能与上调Bax蛋白的表达和下调Bcl-2蛋白的表达有关。
综上所述,MTDH基因在膀胱癌细胞凋亡过程中具有重要作用,本研究通过siRNA干扰技术沉默MTDH基因的表达后,可通过上调Bax和下调Bcl-2蛋白的表达诱导BIU-87细胞凋亡。因此我们推测,MTDH基因可能是治疗膀胱癌的一个潜在靶点,为MTDH基因在膀胱癌的治疗提供了新的方向。
1 Burger M, Catto JW, Dalbagni G, et al. Epidemiology and risk factors of urothelial bladder cancer[J]. Eur Urol, 2013, 63(2):234-241.
2 Cancer Genome Atlas Research Network. Comprehensive molecular characterization of urothelial bladder carcinoma[J]. Nature, 2014,507(7492): 315-322.
3 Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
4 殷小涛, 高江平. 膀胱肿瘤靶向治疗现状及研究进展[J]. 解放军医学院学报, 2017, 38(1): 75-78.
5 Tokunaga E, Nakashima Y, Yamashita N, et al. Overexpression of metadherin/MTDH is associated with an aggressive phenotype and a poor prognosis in invasive breast cancer[J]. Breast Cancer, 2014,21(3): 341-349.
6 蒋莉萍, 余海红, 肖凤. MTDH在胃癌中的表达及其临床意义[J]. 诊断病理学杂志, 2015, 22(5): 304-306.
7 Sarkar D. AEG-1/MTDH/LYRIC in liver cancer[J]. Adv Cancer Res, 2013, 120 : 193-221.
8 Qian B, Yao Y, Liu C, et al. SU6668 modulates prostate cancer progression by downregulating MTDH/AKT signaling pathway[J].Int J Oncol, 2017, 50(5): 1601-1611.
9 Yang C, Zheng S, Liu Q, et al. Metadherin is required for the proliferation, migration, and invasion of esophageal squamous cell carcinoma and its meta-analysis[J]. Transl Res, 2015, 166(6):614-626.e2.
10 刘兆喆, 曹恒, 丁震宇, 等. 下调MTDH基因表达对乳腺癌细胞转移潜能影响机制研究[J]. 中华肿瘤防治杂志, 2014, 21(8):575-579.
11 Nikpour M, Emadi-Baygi M, Fischer U, et al. MTDH/AEG-1 contributes to central features of the neoplastic phenotype in bladder cancer[J]. Urol Oncol, 2014, 32(5): 670-677.
12 Shi X, Wang X. The role of MTDH/AEG-1 in the progression of cancer[J]. Int J Clin Exp Med, 2015, 8(4): 4795-4807.
13 Emdad L, Das SK, Dasgupta S, et al. AEG-1/MTDH/LYRIC :signaling pathways, downstream genes, interacting proteins, and regulation of tumor angiogenesis[J]. Adv Cancer Res, 2013, 120 :75-111.
14 Meng X, Brachova P, Yang S, et al. Knockdown of MTDH sensitizes endometrial cancer cells to cell death induction by death receptor ligand TRAIL and HDAC inhibitor LBH589 co-treatment[J]. PLoS ONE, 2011, 6(6): e20920.
15 Wang S, Shu JZ, Cai Y, et al. Establishment and characterization of MTDH knockdown by artificial MicroRNA interference - functions as a potential tumor suppressor in breast cancer[J]. Asian Pac J Cancer Prev, 2012, 13(6): 2813-2818.
16 Zhou J, Li J, Wang Z, et al. Metadherin is a novel prognostic marker for bladder cancer progression and overall patient survival[J]. Asia Pac J Clin Oncol, 2012, 8(3): e42-e48.
17 Volkmann N, Marassi FM, Newmeyer DD, et al. The rheostat in the membrane : BCL-2 family proteins and apoptosis[J]. Cell Death Differ, 2014, 21(2): 206-215.
18 Flores ER. Commentary on "Apoptosis, p53, and Tumor Cell Sensitivity to Anticancer Agents"[J]. Cancer Res, 2016, 76(23):6763-6764.
19 Mayer IA, Arteaga CL. The PI3K/AKT Pathway as a Target for Cancer Treatment[J]. Annu Rev Med, 2016, 67 : 11-28.
20 郭巍, 陈美霓, 王爱红, 等. P53、Bcl-2和Bax在膀胱癌的表达及意义[J]. 山西医科大学学报, 2014, 45(3): 180-183.
21 于立春, 盛玉文, 曲更庆, 等. p53基因与PTEN基因共转染对膀胱癌T24细胞凋亡的影响[J]. 解放军医学院学报, 2013, 34(8): 886-889.
22 陈洪波, 江克华, 胡晓辉, 等. Akt抑制剂鱼藤素对膀胱癌细胞生长的影响[J]. 国际泌尿系统杂志, 2014, 34(4): 551-555.23 杜成, 刘兆喆, 丁震宇, 等. 转移粘附基因下调对乳腺癌SKBR-3细胞增殖和凋亡的影响[J]. 中华内分泌外科杂志,2013, 7(5): 359-363.
24 Zou Y, Qin X, Xiong H, et al. Apoptosis of human non-small-cell lung cancer A549 cells triggered by evodiamine through MTDH-dependent signaling pathway[J]. Tumour Biol, 2015, 36(7):5187-5193.
25 Li WF, Ou Q, Dai H, et al. Lentiviral-Mediated Short Hairpin RNA Knockdown of MTDHInhibits Cell Growth and Induces Apoptosis by Regulatingthe PTEN/AKT Pathway in Hepatocellular Carcinoma[J].Int J Mol Sci, 2015, 16(8): 19419-19432.

