醒脑静对Aβ诱导的SH-SY5Y细胞凋亡的保护作用及机制
李卫萍, 杜菊梅, 张 磊, 申艳方, 陈向荣, 王 茹
阿尔茨海默病(Alzheimer’s disease,AD)是一类好发于70岁以上人群的进行性发展的神经系统退行性疾病,多表现为认知障碍、精神及行为异常、生活工作能力退化等。在疾病进展过程中,β-淀粉样蛋白 (Aβ) 在人体内大多以聚合物、单体及不溶性纤维存在,大脑中产生或沉积过量的Aβ会引发错误的折叠,导致神经元损伤,与退行性病变相关,同时过量的Aβ可激活一系列的病理事件(血脑屏障破坏、微循环变化)及炎症反应,最终导致神经元细胞变性和死亡,是阿尔茨海默病发生的病理基础[1]。目前阿尔茨海默病的治疗主要是控制伴发的神经、精神症状,包括使用一些抗焦虑、抗抑郁、抗精神病药等以及使用益智类及改善认知功能的药物。醒脑静作为脑代谢赋活药物通过扩张脑血管、增加脑皮质细胞对氧及其他生物素的利用发挥作用[2],醒脑静注射液是在安宫牛黄丸的基础上改制形成的水溶性注射液,包含了麝香、冰片、栀子、郁金等中药成分[3]。麝香开窍,止痛,有破血化淤功效;冰片气清香,味辛凉,主散郁火,能透骨热,常与麝香配伍;栀子清热,泻火,凉血;郁金行气解郁,清心凉血,有镇静、止血、消肿等作用[3]。醒脑静的有效成分极易通过血脑屏障直接作用于神经细胞和神经元发挥作用,常用于中风昏迷、脑梗死、颅脑外伤及阿尔茨海默病的治疗[4~6],对脑组织起到保护作用。本实验通过检测不同浓度醒脑静对Aβ 25~35诱导的人神经母细胞瘤SH-SY5Y细胞凋亡模型的影响,初步探讨醒脑静治疗阿尔茨海默病的机制。
1 材料与方法
1.1 主要细胞系及细胞培养 人神经母细胞瘤细胞(SH-SY5Y)系购自中国科学院上海细胞库,细胞培养在含10% 胎牛血清的DMEM培养液中(含青霉素100 kU/L,链霉素100 μg /ml),于37 ℃、5% CO2条件培养于无菌孵箱,每2 d更换1次培养液,当细胞融合度达到80%~90%时,0.25%Trypsin-0.03%EDTA 消化传代细胞。
1.2 Aβ的孵育 Amyloid β-Protein Fragment 25~35,系购自sigma公司,使用1.8 ml重蒸水将1 mg Aβ 25~35溶解成浓度为500 μmol/L的母液,于37 ℃条件下孵育7 d以形成聚集形式的Aβ 25~35,根据要求制备工作液用于实验,母液-20 ℃冷冻保存备用。
1.3 AD细胞模型构建及醒脑静实验分组 采用Aβ 25~35诱导SH-SY5Y细胞制备阿尔茨海默病凋亡细胞模型,选取对数生长状态的SH-SY5Y细胞,实验前1 d更换1%血清DMEM培养液饥饿培养处理,使细胞达到同步化状态,去除血清、双抗等其他因素对细胞的影响,24 h后给予浓度为:25 μmol/L的Aβ 25~35刺激,作用于细胞24 h,使SH-SY5Y细胞达到细胞凋亡模型状态,根据细胞形态及生长状态判断造模是否成功。
醒脑静实验分组:对照组:SH-SY5Y细胞用DMEM完全培养基正常培养;造模组:SH-SY5Y细胞加入终浓度为25 μmol/L的 Aβ 25~35培养24 h;Aβ 25~35+醒脑静组:不同浓度的醒脑静(2 ml/L、4 ml/L、8 ml/L)分别预处理SH-SY5Y细胞3 h,随后加入25 μmol/L的Aβ 25~35共同培养24 h。
1.4 细胞形态的观察 选取处于对数生长状态的SH-SY5Y细胞,胰蛋白酶消化后制成细胞悬液,以(1~1.5)×106个/ml 的浓度接种于6孔板,每孔接种4 ml混匀的细胞悬液,分对照组与实验组,实验前1 d给予无血清处理以排除血清及双抗对实验结果影响,实验组加入Aβ 25~35使Aβ终浓度分别维持在0 μmol/L、12.5 μmol/L、25 μmol/L、50 μmol/L,对照组加等量培养液,24 h后观察Aβ 25~35对SH-SY5Y细胞的影响,用显微镜观察细胞形态变化,记录并拍照。
1.5 MTT细胞增殖实验 选取处于对数生长状态的SH-SY5Y细胞,胰蛋白酶消化后制成细胞悬液,以(1~1.5)×104个/ml 的浓度接种于96孔板,每孔接种200 μl混匀的细胞悬液,分别设置5个副孔,去掉最大及最小的吸光度值所在副孔,其他三孔求平均值则为该组的吸光度值;设置1组为空白对照组,空白对照组只加培养液及MTT液,不接种细胞。接种96孔板5块,分别在每天同一个固定时间向待检测96孔板每孔加入20 μl,5 mg/ml MTT溶液,其余未检测96孔板在孵箱中继续培养,定期更换培养液。待检测96孔板加入MTT液37 ℃,5% CO2孵育4 h后移去培养液,排枪每孔加入150 μl DMSO,在490 nm波长下酶联免疫仪检测各孔吸光度值,绘制细胞生长曲线。
1.6 流式细胞仪检测细胞凋亡 不同处理组细胞经胰酶消化后制备单细胞悬液,PBS漂洗3遍,收集细胞沉淀,加入固定液固定,调整细胞浓度为不少于1×106个/ml,使用Annexin V-FITC/PI双染法细胞凋亡检测试剂盒检测,流式细胞仪分析细胞凋亡情况。
1.7 Western blot法检测bcl-2、bax水平 取处理48 h后不同组细胞,PBS冲洗后置于冰上裂解(含有cocktail的1*ripa裂解液)20 min,经枪头吹打后置于超声裂解3 min,12000 r/min离心15 min,收集总蛋白,BCA法蛋白定量。取样品50 μg进行SDS-聚丙乙烯酰胺凝电泳,待转至纤维素膜后,10%脱脂牛奶封闭1 h,一抗(Bcl-2抗体、Bax抗体)4 ℃过夜孵育,次日室温复温30 min后,TBST洗膜3~5次,每次3 min,室温孵育二抗1 h,置于TBST中,洗膜3~5次,增强化学发光法(ECL)发光。
2 结 果
2.1 Aβ25~35诱导SH-SY5Y细胞凋亡模型 分别给予SH-SY5Y细胞不同浓度Aβ 25~35[0(对照组)、12.5 μmol/L、25 μmol/L、50 μmol/L Aβ 25~35],使其作用于细胞24 h,诱导细胞凋亡模型,MTT法检测各组细胞存活情况(见图1A),电子显微镜观察各组细胞形态变化,记录并拍照(见图1B)。结果可见:与对照组相比,随着Aβ 25~35造模剂浓度的增加,细胞存活率逐渐下降,在Aβ 25~35浓度为50 μmol/L时细胞存活率约为50%;显微镜观察对照组细胞形态呈梭形,核形规则,密度均匀,细胞数量较多,随着Aβ 25~35造模剂浓度的增加,Aβ造模组细胞由梭形变为不规则方形,突起变短,同时细胞大小固缩且分布不均,细胞数目减少(见图1B)。综合Aβ 25~35对细胞的毒性及杀伤作用,结合查阅文献,选定25 μmol/L为Aβ 25~35诱导SH-SY5Y细胞凋亡模型的最适宜浓度。经25 μmol/L Aβ 25~35诱导SH-SY5Y细胞24 h后凋亡模型造模成功。
2.2 醒脑静对Aβ25~35诱导的SH-SY5Y细胞增殖的影响 MTT法检测不同浓度的醒脑静(2 ml/L、4 ml/L、8 ml/L)对Aβ 25~35诱导的SH-SY5Y细胞增殖的影响,结果发现:加入醒脑静组细胞(Aβ 25~35+2 ml/L醒脑静、Aβ 25~35+4 ml/L醒脑静、Aβ 25~35+8 ml/L醒脑静)的增殖情况较单纯造模组细胞增殖明显增强,并且随着醒脑静浓度的增加,其增殖水平逐渐增加,差异有统计学意义(见图2)。说明醒脑静可以通过促进Aβ诱导的SH-SY5Y细胞增殖拮抗Aβ 25~35诱导细胞凋亡,具有保护作用。
2.3 醒脑静对Aβ 25~35诱导的SH-SY5Y细胞凋亡的影响 与对照组相比,Aβ 25~35造模组细胞凋亡率明显高于对照组,充分说明Aβ 25~35诱导细胞凋亡模型构建成功,同时Aβ 25~35+2 ml/L醒脑静、Aβ 25~35+4 ml/L醒脑静、Aβ 25~35+8 ml/L醒脑静组SH-SY5Y细胞的凋亡率较造模组降低,并且随着醒脑静浓度的增加,细胞存活率增加,总体凋亡率下降,差异有统计学意义(见图3)。说明醒脑静可以抑制Aβ 25~35诱导的人神经母细胞瘤SH-SY5Y细胞凋亡,其对Aβ诱导的SH-SY5Y细胞凋亡具有保护作用。
2.4 醒脑静对Aβ25~35诱导的SH-SY5Y细胞Bcl-2、Bax表达的影响 与对照组相比,Aβ 25~35造模组细胞Bcl-2含量明显减少,Aβ 25~35诱导细胞凋亡模型成功,抗凋亡蛋白Bcl-2含量随着醒脑静浓度的增加表达含量增加;与对照组相比Aβ 25~35造模组细胞Bax含量明显升高,同时促凋亡蛋白Bax含量随着醒脑静浓度的增加表达含量下降,说明醒脑静可以通过上调Bcl-2蛋白的表达和抑制Bax的表达,导致两者比值失调,抑制Aβ 25~35诱导的SH-SY5Y细胞凋亡过程,其对Aβ诱导的SH-SY5Y细胞凋亡具有保护作用(见图4)。

图1 Aβ25~35诱导SH-SY5Y细胞凋亡模型
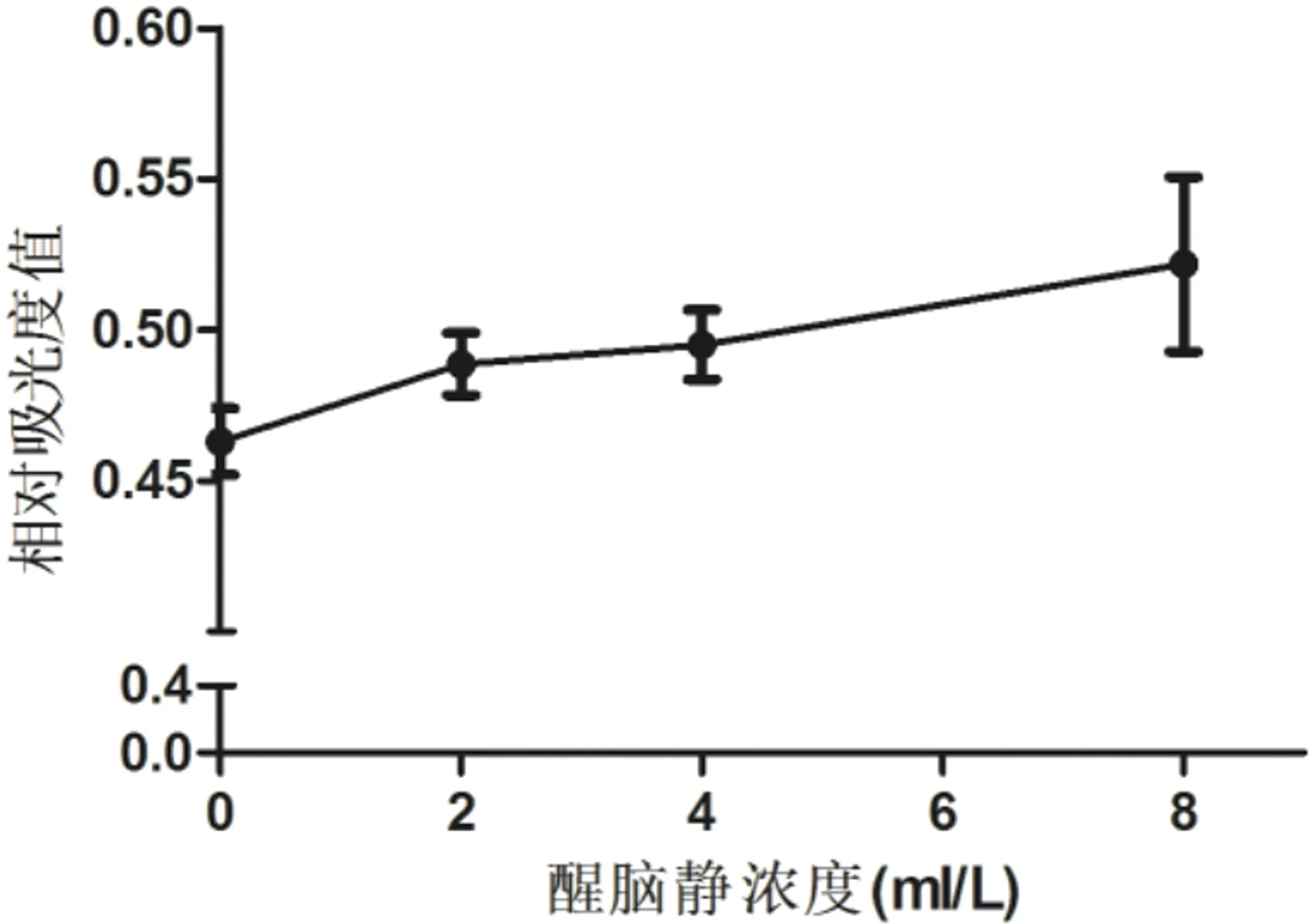
图2 醒脑静对Aβ 25~35诱导的SH-SY5Y细胞增殖的影响
3 讨 论
阿尔茨海默病的特征性病理变化是细胞外β淀粉样蛋白(Aβ)沉积形成老年斑(SP)和细胞内tau蛋白异常磷酸化导致神经原纤维缠结(NFT)形成[7]。现阶段可通过Aβ 1~42、Aβ 1~40或Aβ 25~35淀粉样蛋白刺激模拟AD老年斑形成构建阿尔茨海默病研究模型[8,9],Nestheide等[10]研究表明Aβ淀粉样蛋白可通过诱导凋亡相关基因Bcl-2、Bax及P53等导致神经元缺失。
研究证实,多种中草药具有清除氧自由基和抑制炎症反应作用[11],醒脑静作为这一类醒脑开窍药物的代表,可用于治疗各类脑炎、脑病[12,13]。有研究证实醒脑静注射液有十分明确的抑制脑缺血-再灌注损伤和防治脑神经细胞凋亡作用[14]。张焕等[15]在对认知功能障碍大鼠的研究中证实醒脑静注射液可增加海马区nNOS表达、降低血清β-淀粉样蛋白含量,从而保护海马组织形态的完整性,改善老年认知功能障碍大鼠的空间学习记忆能力。

图3 醒脑静对Aβ 25~35诱导的SH-SY5Y细胞凋亡的影响
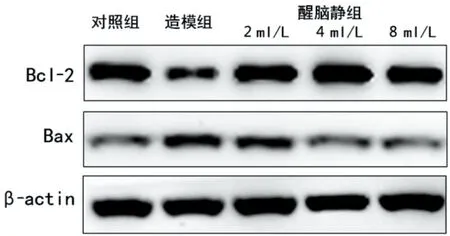
图4 醒脑静对Aβ 25~35诱导的SH-SY5Y细胞Bcl-2、Bax表达的影响
细胞凋亡信号转导通路主要包括膜受体通路和线粒体通路这两条,醒脑静可对神经细胞凋亡中的多个环节进行干预以减少神经细胞的凋亡,包括抑制凋亡诱导的启动、拮抗凋亡执行蛋白酶活化和调节凋亡相关基因表达等[16,17]。细胞凋亡在促凋亡蛋白和抗凋亡蛋白的调控下发生,两种蛋白相互拮抗维持动态平衡对于细胞凋亡发挥重要作用[18]。Bcl-2家族包括促凋亡蛋白Bax和抗凋亡蛋白Bcl-2,由Bcl-2/Bax组成的异源二聚体形成动态平衡调节体系,其比率决定是否发生细胞凋亡,比值越低越容易发生细胞凋亡,Bcl-2及Bax这一动态平衡调节作为P53调控的重要靶点,组成了P53介导的线粒体依赖凋亡途径[18,19]。本实验通过建立Aβ 25~35诱导的SH-SY5Y细胞凋亡模型,给予不同浓度醒脑静处理造模组细胞,探讨不同浓度醒脑静对Aβ 25~35诱导的人神经母细胞瘤SH-SY5Y细胞凋亡途径的保护作用及其机制。实验结果显示Aβ 25~35作用于SH-SY5Y细胞后引起了细胞凋亡,醒脑静通过降低促凋亡蛋白的表达,提高抗凋亡蛋白的表达,从而抑制细胞凋亡,进一步通过western blot的方法推测其通过作用于Bcl-2、Bax这类凋亡相关蛋白发挥保护作用。
[1]任 红,廖 红. 以淀粉样蛋白Aβ为靶点治疗阿尔茨海默病的研究进展[J]. 中国临床药理学与治疗学,2012,(10):1172-1178.
[2]李亚明. 中医药防治阿尔茨海默病的思路与方法[J]. 中国临床康复,2005,(24):144-146.
[3]罗 侃,刘苏中,徐 润,等. 临床应用醒脑静注射液的综合总结[J]. 中国中医急症,1997,(3):119-120.
[4]Wu L,Zhang H,Xing Y,et al. Meta-analysis of the effects of Xingnaojing injection on consciousness disturbance[J]. Medicine,2016,95(7):e2875.
[5]Yang CS,Lin YZ,Guo Q,et al. Chinese herbal medicine Xingnaojing injection for hypoxic ischemic encephalopathy in newborns:a systematic review and meta-analysis[J]. Chin J Integr Med,2015,(5):1-9.
[6]涂 悦,杨细平,商崇智,等. 醒脑静对颅脑创伤的保护作用[J]. 中国应用生理学杂志,2014,30(3):230-232.
[7]周 飞,李 毅,吴昌学,等. SH-SY5Y细胞α7尼古丁受体蛋白抑制对tau蛋白及p38 MAPK通路的影响及其与AD发病机制的关系[J]. 中风与神经疾病杂志,2017,34(2):137-140.
[8]高曲文,陈俊抛,田时雨,等. β淀粉样蛋白诱导脑内神经元凋亡及褪黑素的保护作用[J]. 中华神经科杂志,2000,33(1):7-9.
[9]罗 磊,杜艳军,孙国杰. Aβ(1~40)、Aβ(1~42)与Aβ(25~35)在阿尔茨海默病模型复制中的评价[J]. 中国老年学杂志,2014,(9):2585-2587.
[10]Nestheide S,Bridge JA,Barnes M,et al. Pharmacologic inhibition of epigenetic modification reveals targets of aberrant promoter methylation in Ewing sarcoma[J]. Pediatr Blood Cancer,2013,60(9):1437-1446.
[11]王瑞婷,董雅洁,左彦珍,等. 黄芩茎叶总黄酮对阿尔茨海默病大鼠海马神经元Bax和Bcl-2蛋白表达的影响[J]. 中国老年学杂志,2016,36(10):2337-2340.
[12]Peng W,Yang J,Wang Y,et al. Systematic review and meta-analysis of randomized controlled trials of xingnaojing treatment for stroke[J]. Evid Based Complement Alternat Med,2014,2014(1):210851.
[13]吕 苏,李 佳,曹宝平,等. 醒脑静注射液治疗脓毒症相关脑病的临床观察[J]. 中国中西医结合杂志,2015,35(7):792-795.
[14]傅 强,崔华雷,孙中吉. 醒脑静注射液对脑缺血再灌注诱导的脑神经细胞凋亡防治作用的实验研究[J]. 中国中西医结合急救杂志,2000,7(3):144-146.
[15]张 焕,苑 韬,时艳杰,等. 醒脑静对麻醉后老年认知功能障碍大鼠学习记忆及海马区nNOS、血清β-淀粉样蛋白的影响[J]. 辽宁中医药大学学报,2016,(6):5-7.
[16]李江茹,潘陈为,林 巍,等. 醒脑静注射液在神经细胞凋亡中作用的研究进展[J]. 实用医学杂志,2013,29(2):171-173.
[17]Yang Z,Wang Y,LI CL,et al. Pre-treatment with a Xingnaojing preparation ameliorates sevoflurane-induced neuroapoptosis in the infant rat striatum[J]. Mol Med Rep,2015,11(3):1615-1622.
[18]王 彤,刘存志,刘玉珍,等. Bcl-2/bax基因调控机体细胞凋亡的机制研究进展[J]. 中国老年学杂志,2008,28(16):1658-1660.
[19]Wei G,Huang YC,Li F,et al. prescription of traditional Chinese medicine,prevents autophagy in experimental stroke by repressing p53-DRAM pathway[J]. BMC Complement Altern Med,2015,15(1):377.

