LX007减少脂多糖介导的小胶质细胞内活性氧生成的机制研究
曹 翔, 金岳心子, 李 飞, 徐 运
小胶质细胞是脑组织中固有的巨噬细胞,对环境的变化十分敏感,在中枢神经系统的免疫反应中发挥重要作用[1,2]。生理条件下,小胶质细胞行使保护、支持、营养和修复等功能;而在病理条件下,小胶质细胞过度活化,通过释放多种细胞因子如一氧化氮(nitric oxide,NO)、白细胞介素(interleukin,IL)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和活性氧(reactive oxygen species,ROS)来发挥细胞毒效应,这些都是导致神经退行性疾病如阿尔茨海默病(Alzheimers disease,AD)、帕金森综合征(Parkinson disease,PD)、多发性硬化(multiple sclerosis,MS)以及缺血性脑卒中(Cerebral ischemic stroke)进展的重要原因[3]。因此,调节小胶质细胞的功能状态、抑制异常的激活,对于这类疾病的转归具有积极的作用。
我们的团队在以往的研究中合成了一类N-苄基苯胺衍生物,通过一系列的体内、外实验证实其具有脑缺血再灌注损伤的保护作用[4]。机制上是通过选择性阻断神经型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)与突触后膜致密物-95(postsynaptic density protein 95,PSD-95)的偶联,抑制缺血后NO的病理性释放,对缺血损伤相关疾病的治疗具有重要意义。但这类化合物对小胶质细胞的激活是否具有直接的抑制效果还不清楚。在本研究中,我们利用原代小胶质细胞,探究此类化合物的一个新成员——4-[(5-溴-3-氯-2-羟基苯基)氨基]-2-羟基苯甲酸(命名为LX007,见图1)对脂多糖(Lipopolysaccharide,LPS)诱导ROS生成的抑制作用,并初步探讨其潜在机制。

图1 LX007化学结构
1 材料和方法
1.1 试剂 LPS购自美国Sigma公司,DMEM培养基、青霉素-链霉素溶液购自Gibco公司,南美胎牛血清来自BI公司,CCK-8、活性氧检测试剂盒购自碧云天公司,HO-1和Nrf2抗体购于Abcam公司,GAPDH抗体和细胞核质分离试剂盒购于巴傲得生物科技有限公司。
1.2 LX007的合成 反应釜内加入乙醇25 ml、5-溴-3-氯-2-羟基苯基 2.35 g和4-氨基-2-羟基苯甲酸1.53 g,搅拌并加热回流30 min,之后停止反应,冷却至室温(22~25 ℃)析出红色固体。于茄形瓶内加入乙醇25 ml,硼氢化钠0.8 g以及制得的红色固体,搅拌反应待溶液澄清后滴加水25 ml,有类白色物质析出,过滤后干燥得白色粉末LX007(2.8 g)。1HNMR (300 MHz,DMSO-d6):9.73(s,1H),8.92(s,1H),7.46(d,1H,J = 2.1 Hz),7.26(d,1H,J=2.1 Hz),6.83(t,1H,J=7.8 H),6.03~5.94(m,3 H),4.20(s,2 H)。IR (KBr,cm-1):3336,1597,1497,1461,838,728,684,541。MS(ESI):m/z=371.9[M+H]+。
1.3 细胞培养 实验方法参考之前研究[5],简述如下:将刚刚出生1~2 d的乳小鼠(北京维通利华实验动物技术有限公司)在无菌条件下处死,取脑组织,剥离软脑膜和血管后加入适量胰酶(10个脑子加入6 ml左右),置于37 ℃细胞培养箱内10 min消化。过75 μm滤器后离心,用完全培养基重悬细胞后计数,分种在75 cm2培养瓶中。36~48 h待细胞贴壁后第一次全换液,6~7 d待星形胶质细胞铺满瓶底后第二次换液,继续培养至10 d后摇板分离收集原代小胶质细胞。利用特异性抗体Ibal-1检测,阳性率大于95%后可用于后续实验。
1.4 CCK-8法检测细胞活性 将原代小胶质细胞以每孔4×103个细胞的密度接种于96孔板,待细胞生长过夜贴壁后,与不同浓度LX007(0~50 μmol/L)共孵育24 h,然后每孔加入10 μl CCK-8工作液,37 ℃孵育2 h后置于Bio-Rad iMark酶标仪(美国伯乐公司)中,在450 nm波长下检测吸光度值。
1.5 ROS水平检测 不同浓度的LX007预处理原代小胶质细胞1 h后,加入0.1 ng/ml LPS刺激12 h,去除上清液后利用PBS润洗细胞3次,加入DCFH-DA(终浓度为10 μmol/L),在37 ℃避光孵育30 min。孵育结束后再利用PBS润洗细胞3次,采用Accuri C6流式细胞仪(BD公司)在激发光488 nm和发射光525 nm下检测ROS的表达,最后利用FlowJo 10.0软件进行分析。
1.6 细胞核质分离与免疫印迹 将药物处理完毕的细胞用PBS润洗3次,加入细胞质裂解液置于冰上孵育20 min,3000 rpm/min离心15 min,上清即为细胞质蛋白。沉淀部分加入和裂解液再在冰上孵育20 min,12500 rpm/min离心15 min,上清液为核蛋白。每组样品取等量的蛋白进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳1.5~2 h后100 V恒压转膜2 h。接着利用含有5%脱脂奶粉的TBS溶液封闭1 h,4 ℃一抗孵育过夜。次日用相应种属来源的二抗室温孵育1 h,ECL发光试剂进行显色反应,用Image J图像分析系统分析实验结果。
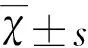
2 结 果
2.1 低浓度的LX007对原代小胶质细胞活性无显著影响 用0~50 μmol/L浓度的LX007作用于原代小胶质细胞24 h后,cck-8试剂盒检测细胞活力,结果如表1所示,30 μmol/L及以下浓度的LX007对细胞没有毒性,不会影响细胞的活力,但是高于等于40 μmol/L浓度后,LX007显著降低了原代小胶质细胞的活力。因此,本实验所用LX007的剂量在30 μmol/L范围内。

表1 LX007对原代小胶质细胞活性的影响
与对照组相比*P<0.05 and **P<0.01
2.2 LX007减少LPS引起的细胞内ROS表达 不同浓度的LX007预处理成熟的原代小胶质细胞1 h,接着加入LPS共同刺激12 h,流式细胞仪检测细胞ROS的表达后发现,空白对照组原代小胶质细胞ROS含量很低,单独使用30 μmol/L的LX007刺激的细胞ROS含量与对照组没有显著性差异。而LPS刺激组,ROS含量显著增加,但随着LX007预处理剂量的增加,原代小胶质细胞ROS的表达水平逐渐降低,差异具有统计学意义(见图2)。
2.3 LX007增加HO-1的表达 血红素氧合酶1(heme oxygenase 1,HO-1)是公认的具有抗氧化功能的分子,在许多疾病中起着重要的保护作用。因此,我们进一步观察LX007减少ROS表达是否通过影响HO-1的表达。同样,我们利用不同浓度的LX007预处理原代小胶质细胞1 h,紧接着用LPS共刺激24 h,Western blot检测各组中HO-1的表达。结果发现,HO-1的表达随着LX007预处理浓度的增加而增加(见图3),说明LX007具有提高HO-1表达的能力。
2.4 LX007抑制LPS诱导的原代小胶质细胞Nrf2的核/质转位 HO-1的表达通常是由核因子E2相关因子(nuclear factor erythroid 2-related factor 2,Nrf2)诱导的,我们接下来的研究发现,对照组原代小胶质细胞内的Nrf2主要在核内表达,而LPS刺激后,Nrf2从胞核转位到胞浆。LX007的预处理显著的抑制这一现象的产生(见图4),使得更多的Nrf2在核内行使转录功能。

图2 LX007减少LPS引起的细胞内ROS表达。与对照组比较**P<0.01;与LPS组比较#P<0.05,##P<0.01

图3 LX007增加HO-1蛋白的表达。与对照组比较*P<0.05,**P<0.01
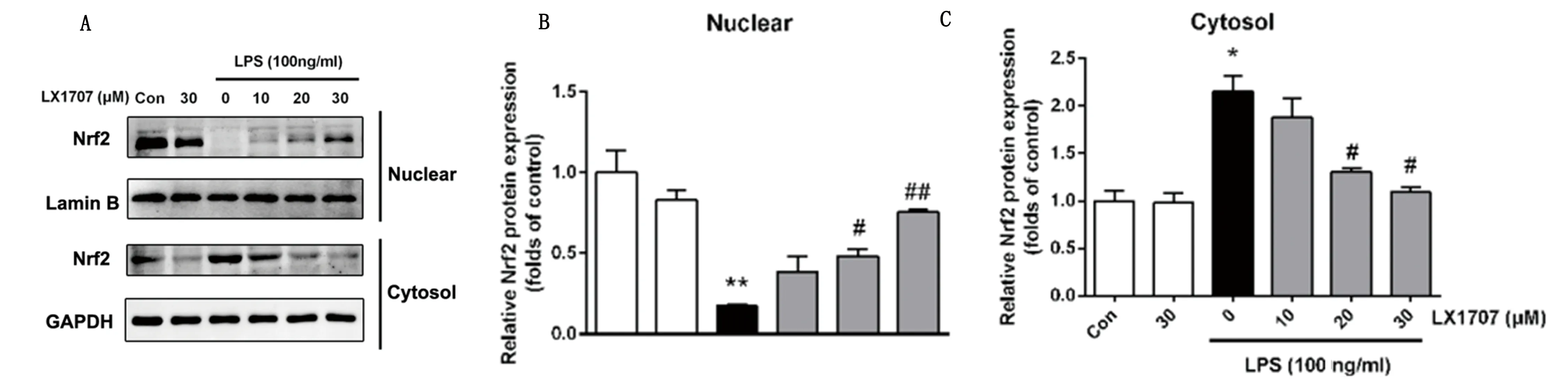
图4 LX007抑制LPS诱导的原代小胶质细胞Nrf2的核/质转位。与对照组比较,*P<0.05,**P<0.01;与LPS组比较,#P<0.05,##P<0.01
3 讨 论
氧对于活细胞而言是必不可少的,但过量又很危险。脑组织是体内氧负荷最大的器官之一,细胞过氧化能力增强时会引起ROS的大量积累,过多的ROS能通过激活一系列的信号传导通路,引发许多病理学改变,是引发多种神经系统疾病的重要原因[6,7]。早期对小胶质细胞的研究发现,其异常的活化会导致ROS的生成,持续的ROS释放介导脂质和其它大分子过氧化,进而诱导神经元凋亡程序启动[8]。
在正常生理状态下,Nrf2与Keap1(Kelch-like ECH-associated protein-1)蛋白结合处于非活化的状态,当细胞受到外界刺激,Nrf2会与Keap1解离并与ARE(antioxidant response element)结合,启动下游抗氧化蛋白等基因转录和表达,从而抵御外来的有害刺激[9,10]。在AD患者中,Nrf2的表达显著低于正常人[10]。同样在APP/PS1转基因小鼠体内,伴随着Aβ沉积的出现,Nrf2总蛋白降低,Nrf2-ARE通路受到抑制,但是运用Nrf2的激活剂之后能够减少Aβ的毒作用[11,12]。这些说明Nrf2的表达和功能在AD的病理和生理过程中起着重要的作用。HO-1是受到Nrf2信号通路调控的下游靶基因之一,其功能是作为抗氧化蛋白酶参与维持机体的氧化还原平衡[13,14]。过表达HO-1发现可以保护多巴胺神经元对抗MPTP(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine,1-甲基-4-苯基-1,2,3,6-四氢吡啶)介导的神经毒性[15]。双氧水的刺激可以诱导小胶质细胞产生大量的ROS,当细胞预先用腺苷处理后,ROS的表达显著降低。进一步实验解释了这一现象,腺苷的预处理能通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和Nrf2信号通路增加了HO-1的表达,进而改善超氧化与炎症反应[16]。
我们的研究团队合成了一类N-苄基苯胺衍生物,这类化合物是由一个疏水性A环和一个具有羧基的亲水性B环连接而成。既往的研究着重关注ZL006号化合物,发现其具有脑缺血再灌注损伤的保护作用,主要是通过直接干预nNOS与PSD-95的偶联,但化合物对小胶质细胞的作用却没有报道。本研究选用另一个类似结构的化合物—4-[(5-溴-3-氯-2-羟基苯基)氨基]-2-羟基苯甲酸(LX007),探究其对LPS刺激引起的小胶质细胞活性氧生成的抑制作用。实验利用DCFH-DA荧光探针进行检测,发现LPS刺激组小胶质细胞内ROS含量明显升高,LX007预处理后能显著减少ROS的生成,并且具有剂量依赖性。我们推测LX007降低细胞内LPS诱导的ROS水平可能与LX007促进了抗氧化通路有关。于是,在接下来的实验中,我们检测了HO-1蛋白的表达,发现随着LX007预处理浓度的增加,HO-1的表达量也随之增多。与此同时,研究还发现调控HO-1表达的Nrf2蛋白核质转移也受到影响,LX007处理后更多的Nrf2进入核内,具有表达更多抗氧化物质的潜力。综上所述,化合物LX007预处理具有减少LPS刺激引起的小胶质细胞活性氧生成的能力,可能与LX007通过影响Nrf2/HO-1信号通路调控氧化应激有关。本研究丰富了该类化合物在神经退行性疾病防治和治疗方面运用的实验依据。
[1]Arcuri C,Mecca C,Bianchi R,et al. The pathophysiological role of microglia in dynamic surveillance,phagocytosis and structural remodeling of the developing CNS[J]. Front Mol Neurosci,2017,10:191.
[2]Aguzzi A,Barres BA,Bennett ML. Microglia:scapegoat,saboteur,or something else[J]? Science,2013,339(6116):156-161.
[3]Perry VH,Holmes C. Microglial priming in neurodegenerative disease[J]. Nat Rev Neurol,2014,10(4):217-224.
[4]Zhou L,Li F,Xu HB,et al. Treatment of cerebral ischemia by disrupting ischemia-induced interaction of nNOS with PSD-95[J]. Nat Med,2010,16(12):1439-1443.
[5]Weng L,Zhang H,Li X,et al. Ampelopsin attenuates lipopolysaccharide-induced inflammatory response through the inhibition of the NF-kappaB and JAK2/STAT3 signaling pathways in microglia[J]. Int Immunopharmacol,2017,44:1-8.
[6]Lan AP,Chen J,Chai ZF,et al. The neurotoxicity of iron,copper and cobalt in Parkinson’s disease through ROS-mediated mechanisms[J]. Biometals,2016,29(4):665-678.
[7]Deshmukh P,Unni S,Krishnappa G,et al. The Keap1-Nrf2 pathway:promising therapeutic target to counteract ROS-mediated damage in cancers and neurodegenerative diseases[J]. Biophys Rev,2017,9(1):41-56.
[8]Block ML,Zecca L,Hong JS. Microglia-mediated neurotoxicity:uncovering the molecular mechanisms[J]. Nat Rev Neurosci,2007,8(1):57-69.
[9]Seo JY,Pyo E,Park J,et al. Nrf2-mediated HO-1 induction and antineuroinflammatory activities of halleridone[J]. J Med Food,2017,20(11):1091-1099.
[10]Ramsey C,Glass CM,Lindl K,et al. Expression of Nrf2 in neurodegenerative diseases[J]. J Neuropathol Exp Neurol,2007,66(1):75-85.
[11]Kanninen K,Malm TM,Jyrkkänen HK,et al. Nuclear factor erythroid 2-related factor 2 protects against beta amyloid[J]. Mol Cell Neurosci,2008,39(3):302-313.
[12]Branca C,Ferreira E,Nguyen TV,et al. Genetic reduction of Nrf2 exacerbates cognitive deficits in a mouse model of Alzheimer’s disease[J]. Hum Mol Genet,2017,26(24):4823-4835.
[13]De-Vries H,Witte MD,Rozemuller A,et al. Nrf2-induced antioxidant protection:a promising target to counteract ROS-mediated damage in neurodegenerative disease[J]. Free Radic Biol Med,2008,45(10):1375-1383.
[14]Qiang W,Cahill JM,Liu J,et al. Activation of transcription factor Nrf-2 and its downstream targets in response to moloney murine leukemia virus ts1-induced thiol depletion and oxidative stress in astrocytes[J]. J Virol,2004,78(21):11926-11938.
[15]Hung SY,Liou HC,Kang KH,et al. Overexpression of heme oxygenase-1 protects dopaminergic neurons against 1-methyl-4-phenylpyridinium-induced neurotoxicity[J]. Mol Pharmacol,2008,74(6):1564-1575.
[16]Min KJ,Kim JH,Jou I,et al. Adenosine induces hemeoxygenase-1 expression in microglia through the activation of phosphatidylinositol 3-kinase and nuclear factor E2-related factor 2[J]. Glia,2008,56(9):1028-1037.

