P物质融合毒素的质粒构建及其原核表达*
朱晓霞,张露萍,叶亚婷,严蓉蓉,代吕霞,曹 康
1.成都医学院 检验系(成都 610500);2.成都医学院 临床医学系(成都 610500);3.成都医学院 临床技能中心(成都 610500); 4.成都医学院 病原生物学教研室(成都 610500);5.海洋石油总医院(天津 300452)
Cholix Toxin是在2008年发现的来源于非O1株和非O139株的霍乱弧菌的一种毒素。Cholix Toxin、白喉毒素(DT)和铜绿假单胞菌外毒素A(exotoxin A,ExoA)同属于特异性延长因子2(elongation factor 2,eEF2) ADP-核糖基转移酶毒素。Cholix Toxin是一种含有A亚单位和B亚单位的毒素,有3个结构域,分别在受体结合、膜易位和酶催化中起作用。Cholix Toxin催化ADP-核糖基团从NAD+转移到翻译后修饰的eEF2中的组氨酸残基(白喉酰胺),eEF2是与核糖体相关的必需的翻译延长因子。Cholix Toxin抑制了靶细胞蛋白质的合成,并最终导致靶向受体细胞破碎死亡[1-6]。P物质是世界上发现最早的一种神经肽,其广泛分布于细神经纤维内[7-8]。脑内P物质参与了情绪、运动、感觉等一系列活动调节,并与焦虑症、抑郁症、精神分裂症的发病机理有关[9]。
目前有报道[10-11]表明,P物质受体在很多肿瘤细胞中高表达,本研究试图将P物质和Cholix Toxin的毒性部位相连接构建出重组融合表达质粒pET-CTR-PS,进而表达获得重组融合蛋白CTR-PS,为研究重组融合蛋白CTR-PS对肿瘤细胞的靶向杀伤作用打下基础。
1 材料与方法
1.1 材料
表达质粒pET32a(+)和pET28-CT由A.Rod Merrill 博士(加利福利亚大学斯科利普斯海洋研究所)赠送,大肠杆菌DH5α和表达菌株BL21(DE3)均为本实验室保存,Cholix Toxin抗体为本实验室自制;限制性内切酶购自Fermentas公司;pMD19-T载体、T4 DNA Ligase 酶、T4 Ligase Buffer购自PROMEGA公司;凝胶DNA回收试剂盒、小量质粒提取试剂盒购自OMEGA公司;Western-blot试剂购自晶美公司。
1.2 方法
1.2.1 重组质粒pET-CTR-PS的构建与鉴定 设计合成两端分别带EcoRI和SacI酶切位点的Cholix Toxin引物,用PCR方法以pET28-CT为模板,特异性扩增 Cholix Toxin的催化活性部分CTR。上游引物CTR-EcoR I:GAATTCATGGC ACTTGCTGCTCATCGAG;下游引物CTR-Sac I:GAGCTCTTTCAGTTCATCTTTTCGCTCTTT ATAAG。扩增之后连入pMD19-T载体构建T-CTR质粒。人工合成带XhoI和HindⅢ酶切位点的P物质DNA,序列为5'-AGCTGG CGGCGGCGGCAGCCGCCCGAAACCGCAGCAG TTCTTCGGTCTGATG-3',5'-TCGAGTTAA CCCATCAGACCGAAGAACTGCTGCGGTTTC GGGCGGCTGCCGC-3',将其克隆到pET32a中得到重组质粒pET-PS。T-CTR和pET-PS分别经EcoRI和SacI双切酶,将回收得到的Cholix Toxin片段与pET-PS的载体大片段相连,构建得到重组质粒pET-CTR-PS。
1.2.2 重组质粒鉴定 抽提质粒后,对经琼脂糖凝胶电泳检测为阳性克隆的质粒进行双酶切鉴定和测序鉴定,鉴定成功的质粒命名为T-CTR、pET-PS和pET-CTR-PS。
1.2.3 重组质粒pET-CTR-PS诱导表达条件的优化 用0.1 mM IPTG诱导,18 ℃, 200 r/min培养20 h为参考,优化条件,3瓶分别标记为A、B、C瓶。A瓶用于不同IPTG浓度优化,当OD600为0.6时,以每管10 mL分装12管,分别用0、0.02、0.04、0.06、0.08、0.1、0.2、0.3、0.4、0.6、0.8、1.0 mM IPTG加以诱导,均表达20 h,定为1组;当OD600为0.6时,B瓶分装13管,每管10 mL用于最优表达时间的选择,均用0.2 mM IPTG诱导,分别表达0、2、4、6、8、10、12、14、16、18、20、24、48 h定为2组;C瓶用于不同温度优化,OD600为0.6时,以每管10 mL分装9管,分别在温度为14、16、18、20、22、25、30、35、37 ℃时,用0.2 mM IPTG 诱导,37 ℃培养20 h,定为3组。然后收集细菌体,冰浴超声破菌,离心收集上清,用SDS-PAGE做蛋白表达结果检测。
1.2.4 重组CTR-PS蛋白的Western-blot分析 将超声上清SDS-PAGE电泳,转移印迹到PVDF膜上,5%脱脂奶粉室温封闭过夜,然后加人经10%脱脂奶粉1∶2 000稀释的一抗鼠抗Cholix Toxin抗体4 ℃孵育1 h后,洗膜5次,5 min/次,弃去TBST,经1∶2 000 10%脱脂奶粉稀释的二抗羊抗鼠IgG, 4 ℃孵育1 h,TBST洗膜,最后用化学发光显色,于凝胶成像系统中曝光拍照。
2 结果
2.1 Cholix Toxin基因的 PCR 扩增结果
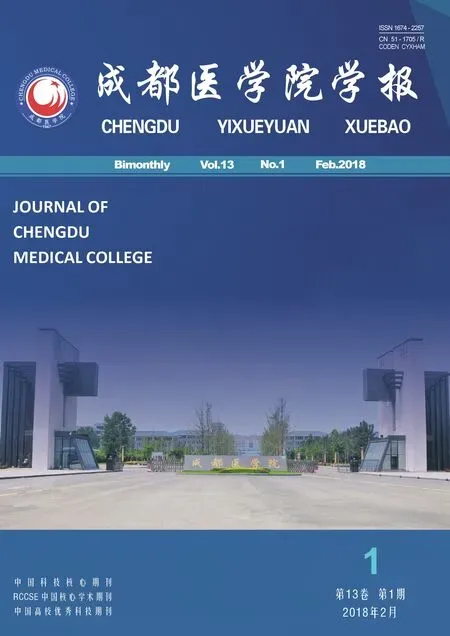
经过 PCR 扩增得到了与预期大小一致的Cholix Toxin 基因片段(约 1.1 kb)(图 1)。
2.2 Cholix Toxin 基因的 T 克隆载体构建及其酶切鉴定结果
将PCR得到的Cholix Toxin 基因CTR插入pMD19-T 载体中,得到T-CTR质粒,重组质粒用EcoRI和SacI双酶切鉴定,酶切后的片段大小与设计大小一致。取酶切鉴定阳性克隆送擎科生物公司测序, Blast对比测序结果表明:成功构建了T-CTR(图2)。
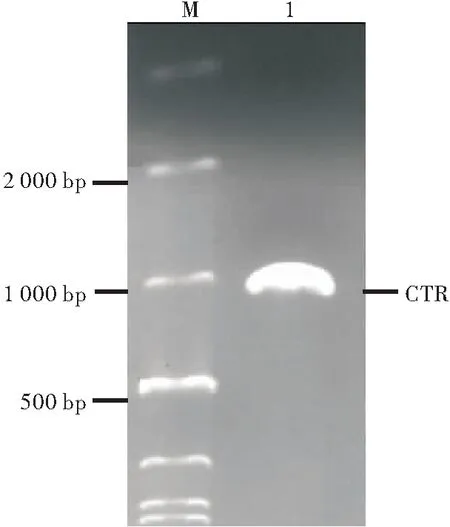
图1 Cholix Toxin基因 PCR 扩增产物电泳分析注: M:DNA分子量标准; 1:Cholix Toxin的PCR产物
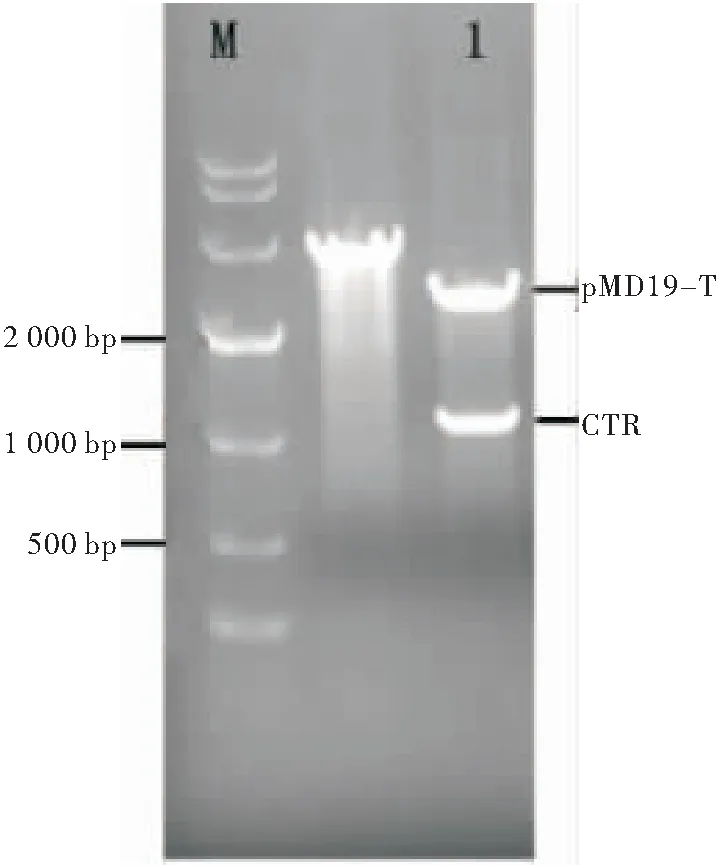
图2 T-CTR重组质粒的双酶切鉴定
注: M:DNA分子量标准; 1:由EcoRI和SacI双酶切的重组质粒T-CTR
2.3 质粒pET-PS鉴定
由于P物质分子量非常小,在电泳过程中很快就泳出了凝胶,在成像中无法观测到,所以直接采取测序鉴定,送擎科生物公司测序。经Blast比对,序列完全正确。
2.4 pET-CTR-PS 原核表达重组质粒的构建及鉴定结果
用限制性内切酶 EcoRI和SacI从T-CTR 切下CTR序列,并插入经过同样双酶切的pET-PS中。酶切鉴定正确的pET-CTR-PS 质粒送擎科生物公司测序。经Blast比对,序列完全正确(图3)。
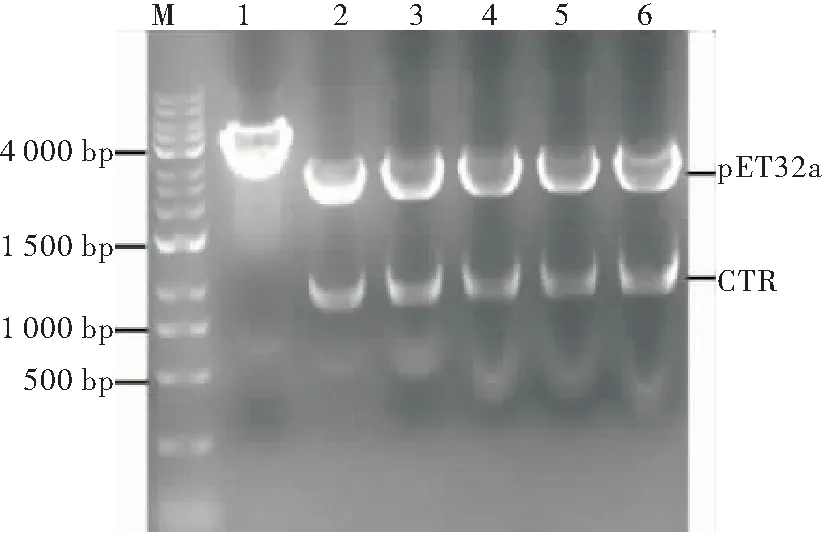
图3 pET-CTR-PS重组质粒的双酶切鉴定
注: M:DNA分子量标准; 1:未被EcoRI和SacI双酶切的重组质粒pET-CTR-PS;2~6:由EcoRI和SacI双酶切的重组质粒pET-CTR-PS
2.5 融合蛋白 pET-CTR-PS 的诱导表达
pET-CTR-PS 重组蛋白的理论大小约为 66 kD,将重组质粒pET-CTR-PS转化入宿主菌BL21(DE3)内,经 IPTG诱导表达带有His标签的重组蛋白,表达菌体经过一系列处理后,进行SDS-PAGE电泳,用考马斯亮蓝染色观察结果,结果显示,获得的表达蛋白与预期大小一致。这表明重组表达质粒转化入宿主菌,经过IPTG诱导后,成功表达出了重组pET-CTR-PS蛋白。受时间、诱导温度及载体等影响,菌株在高温条件下将快速表达目的蛋白,这样可溶性蛋白将不易形成,使蛋白发生不正确构象,从而形成包涵体。经一系列对比,18 ℃,0.02 mmol/L IPTG诱导20 h上清蛋白表达量最佳,SDS-PAGE 电泳结果如下所示(图4)。

图4 重组质粒pET-CTR-PS表达产物的SDS-PAGE结果
注:M:蛋白分子量标准;1:IPTG诱导前大肠杆菌培养物pET32a(+)裂解物的沉淀; 2:IPTG诱导后大肠杆菌培养物pET32a(+)的裂解物的沉淀; 3:未经IPTG诱导的大肠杆菌培养物pET-CTR-PS裂解物的沉淀;4:IPTG诱导大肠杆菌培养物pET-CTR-PS 20 h后的裂解物的上清; 5:IPTG诱导大肠杆菌培养物pET-CTR-PS 20 h后的裂解物的沉淀
2.6 pET-CTR-PS重组蛋白的Western-blot分析结果
pET-CTR-PS重组蛋白 Western-blot分析结果显示,在约66 kD处有一条清晰特异的条带,表明在大肠杆菌中pET-CTR-PS高效表达并具有免疫活性(图 5)。

图5 pET-CTR-PS重组蛋白的Western-blot分析结果注: 1: IPTG诱导的pET-CTR-PS; 2: IPTG诱导的pET32a(+)
3 讨论
P物质是由11个氨基酸组成的肽, P物质的酰胺部分对其与受体的高亲和力结合发挥着重要作用。 P物质受体不仅广泛存在于中枢和周围神经系统,还在各种类型的肿瘤中表达,如成神经母细胞瘤和星形细胞瘤等一系列肿瘤周围脉管系统相关的实体瘤[12-13]。Cholix Toxin的催化结构域催化eEF2的ADP-核糖基化,从而抑制蛋白质合成,导致细胞死亡。Cholix Toxin等DT相关蛋白的细胞毒作用需经靶细胞受体介导,经细胞内吞,酸化作用后进入细胞质溶胶中发挥作用。相关文献[14]报道,Cholix Toxin融合蛋白的细胞毒作用可通过神经肽作为融合毒素的靶向配体,并通过翻译修饰将其无活性前体形式转化为活性形式。传统的抗生素药物具有很强的毒副作用,其常在治疗同时诱导耐药突变,而特异性毒力治疗剂不但可以中和毒力因子的细胞毒性,还避免引起与目前抗生素相关的宿主群体的不良影响[15]。因此,本研究试图将P物质和Cholix Toxin的毒性部位融合表达用以靶向治疗肿瘤。
为了获得高表达的重组蛋白,本研究选用了具有T7 启动子的pET32a (+)作为原核表达载体,其具有Amp 抗性标记,还能表达转录终止信号[16]。本研究设置了未转化的不含来自质粒的Amp抗性基因的菌体为空白对照,因此非阳性重组子在含Amp的LB平板上无法生长,提高了阳性重组子的选中率。运用双酶切构建重组质粒的方法使插入片段与载体定向连接,可有效地避免基因的反向连接,同时也可有效防止线状质粒末端的自连[17]。菌体诱导培养过程中发现,甘油保存菌种时间越长,菌体活性越差,即需较长复苏时间才能达到所需的菌量浓度。考虑在菌种保存中,存在基因拷贝数丢失或各种原因导致菌体破坏。由于菌种诱导后能表达pET-CTR-PS重组蛋白,排除了菌体破坏的可能性。因此,将保存的同管菌种重新平板划线,再挑取单个菌落培养,结果菌体活性有很大提升。
本研究以BL21(DE3)表达pET-CTR-PS,在大肠杆菌中高效表达组氨酸 (6×His) 融合标签,组氨酸标签对表达的蛋白质的活性及结构影响很小,为纯化蛋白提供了便利[18-19]。本研究中所用感受态细胞为大肠杆菌BL21(DE3),以此为表达宿主,将重组质粒pET-CTR-PS 电转化感受态细胞BL21 ( DE3)。 IPTG 从0.01~1 mmol/L不同浓度诱导,以不加IPTG的转化菌为对照,诱导温度从低到高,可溶性蛋白表达量越来越低,而不溶性包涵体表达量越来越高。这是因为大肠杆菌细胞质内高水平表达的蛋白含硫氨基酸或含脯氨基酸含量高,诱导温度过高或胞内 PH 越接近蛋白的等电点等,均会导致形成不溶性的包涵体聚集物,不完全折叠的多肽链促进了疏水序列分子间的相互作用,最终导致目的蛋白的错误折叠和聚集。由于表达的Cholix Toxin N 端携带了部分载体蛋白,包括了硫氧还原蛋白和6个组氨酸等,所以其蛋白的分子量约为 66 kD,比Cholix Toxin 蛋白本身分子量大。为了确认pET-CTR-PS是所需要的融合蛋白,本研究用Western-blot做进一步验证,结果显示,这一蛋白条带可与相应抗体结合,在杂交膜上呈阳性印迹反应。
本研究成功构建了pET-CTR-PS原核表达重组子,并在表达菌中获得了可溶性高表达。为研究Cholix Toxin的毒性催化部位在P物质介导下的靶向肿瘤治疗机制奠定了基础。
[1]J rgensen R, Purdy A E, Fieldhouse R J,etal. Cholix toxin, a novel ADP-ribosylating factor from Vibrio cholerae[J]. J Biol Chem, 2008, 283(16): 10671-10678.
[2]Purdy A E, Balch D, Lizárraga-Partida M L,etal. Diversity and distribution of cholix toxin, a novel ADP-ribosylating factor from Vibrio cholerae[J]. Environ Microbiol Rep, 2010, 2(1): 198-207.
[3]Fieldhouse R J, J rgensen R, Lugo M R,etal. The 1.8 cholix toxin crystal structure in complex with NAD+and evidence for a new kinetic model[J]. J Biol Chem, 2012, 287(25): 21176-21188.
[4]Lugo M R, Merrill A R. A comparative structure-function analysis of active-site inhibitors of Vibrio cholerae cholix toxin[J]. J Mol Recognit, 2015, 28(9): 539-552.
[5]Cancino J, Jung J E, Luini A. Regulation of Golgi signaling and trafficking by the KDEL receptor[J]. Histochem Cell Biol, 2013, 140(4): 395-405.
[6]Turgeon Z, Jorgensen R, Visschedyk D,etal. Newly Discovered and Characterized Antivirulence Compounds Inhibit Bacterial Mono-ADP-Ribosyltransferase Toxins[J]. Antimicrobial Agents and Chemotherapy, 2010, 55(3): 983-991.
[7]方富贵, 章孝荣. P物质研究进展[J]. 动物医学进展, 2005, 26(1): 6-8.
[8]李伟红, 姜恩魁. P物质的研究现状[J]. 锦州医学院学报, 1999, 20(2): 64-67.
[9]张世红, 赵晏. P物质的免疫调节作用[J]. 生理科学进展, 2002, 33(3): 235-238.
[10] 王双彪, 姜达. P 物质/NK1受体系统在肿瘤进展中的作用[J]. 南昌大学学报(医学版), 2016, 56(1): 98-100.
[11] 石欣, 裴斐, 高乃荣, 等. P物质及其受体在胰腺癌细胞中的表达[J]. 中华实验外科杂志, 2003, 20(2): 166-167.
[12] 赵岭岭,陈桦,王继刚, 等. P物质与受体nk-1在结肠癌中的表达及定位(英文)[J]. 现代生物医学进展,2010,10(8):1515-1517.
[13] 刘婧, 姜恩魁. P物质和P物质受体[J]. 锦州医学院学报, 2001, 22(1): 57-59.
[14] Fisher C E, Sutherland J A, Krause J E,etal. Genetic construction and properties of a diphtheria toxin-related substance P fusion protein: in vitro destruction of cells bearing substance P receptors[J]. Proc Natl Acad Sci USA, 1996, 93(14): 7341-7345.
[15] Lugo M R, Merrill A R. Pocket analysis of the full-length cholix toxin. An assessment of the structure-dynamics of the apo catalytic domain[J]. J Biomol Struct Dyn, 2015, 33(11): 2452-2468.
[16] 李婧. pET32a-XBP1u蛋白的原核表达、纯化及多克隆抗体的制备[D]. 重庆:重庆医科大学, 2009:27-28.
[17] 王炯蓉, 李志忠, 王芳,等. 抗菌肽DCD-1L在大肠杆菌中的表达及活性鉴定[J]. 生物技术, 2013(6):40-41.
[18] 霍海龙, 赵跃, 王锐, 等. 绿色荧光蛋白基因原核表达质粒pET32a-AcGFP1的构建及其在大肠杆菌中的高效表达[J]. 云南农业大学学报, 2012, 27(6): 820-825.
[19] 朱芳, 邓思, 罗立新. 分选酶A在pET32a(+)原核表达载体中的表达和鉴定[J]. 生物技术通报, 2011(6): 218-222.