高中必修化学“离子方程式”教学:现状、策略与案例分析
杨梓生+吴菊华


摘要:阐述了高中必修化学“离子方程式”的教学内容与学习要求,回顾了一线教师的教学现状,分析学牛难以掌握离子方程式书写技能的原因;认为“离子方程式”教学的关键在丁促进离子方程式意义理解、建构微粒相互作用的认识思维,并以此指导离子方程式的书写;以学习心理学理论为指导,提出促进意义理解从而掌握书写规则的“离子方程式”教学四个阶段,并对各阶段的教学活动与学习任务进行了规划;总括了“化学用语”类概念教学的关键。
关键词:离子方程式;意义理解;书写规则;概念教学;教学设计
文章编号:1005-6629(2017)8-0033-04
中图分类号:G633.8
文献标识码:B
1“离子方程式”教学要求及现状分析
1.1教学内容与学习要求
“离子方程式”是高中化学必修课程的重要内容,是学习与表征电解质在水溶液中相互作用的重要工具。它和“化学方程式”一样,属于反映与表征物质性质及其变化的“化学用语”类基本概念,包含了“离子方程式”概念以及“离子方程式书写”的化学技能两部分内容。因此,“离子方程式”的学习,不仅需要理解“离子方程式”概念的内涵意义,而且还要掌握“离子方程式书写”的技能。从理论上讲,概念的内涵意义和书写技能高度相关,前者是后者的基础、后者是前者的外在表现。因此,对于“离子方程式”的教学,应将“离子方程式”概念及其書写视为一个系统,并在把握概念内涵意义基础上开展书写教学。
1.2教学现状及原因分析
目前,教师执教该内容的普遍方式是:在演示实验(往氯化钡溶液中滴加稀硫酸)的基础上,要求学生观察现象并书写化学方程式;接着,从电解质电离角度分析点拨,归纳离子反应的概念及其条件,指出离子反应可用离子方程式表示;之后,以上述反应为例,通过“写、拆、删、查”等步骤完成离子方程式书写,并安排书写训练;最后,总结离子反应实质、离子方程式书写的方法与步骤。这样的教学将重点放在离子方程式书写及其训练上,并认为先告诉学生书写规则再强化书写训练是一种便捷高效、提高成绩的方法。
事实证明,这样的教学无法让学生很好地掌握这一技能,导致学生在“离子方程式书写”、“离子方程式可以表示一类反应”的认识上存在困难。因为,教师没有关注“离子方程式”概念教学,只是在简单交代“用实际参加反应的离子符号来表示反应的式子叫做离子方程式”的基础上.直奔离子方程式书写步骤与要求。由于学生缺乏对电解质溶液微粒及作用的探究与思考,没能领悟“离子方程式”概念的内涵意义及其内隐的认识思维,虽然暂时记住了书写离子方程式的程序,但只能知其然(书写步骤要求)而不知其所以然(书写步骤要求背后隐含的认识思维)。
2 “离子方程式”教学关键及教学策略
2.1 “离子方程式”的教学关键及认识过程
化学用语类概念反映(内隐)了化学学科表达物质性质及其变化的特有思维方式。那么,“离子方程式”这一化学用语类概念反映了怎样的认识思维?由于离子方程式是表征电解质溶液中离子相互作用及其结果的符号系统,是电解质溶液相互作用的现象和本质的认识工具,因而反映了审视电解质溶液系统哪些微粒发生作用、怎样作用及作用结果如何的“微粒作用观”的认识思维。
显然,“离子方程式”反映的上述认识思维,决定书写离子方程式时必须考虑溶液系统存在何种离子、哪些离子发生作用及其作用结果如何等,并按相应逻辑组织并转化为书写规则。因此,离子方程式书写规则是“微粒作用观”认识思维的外显化。而认识“离子方程式”概念反映的思维,理应从离子方程式意义人手。只有明确离子方程式用参加反应离子的符号来表示反应、揭示了电解质溶液作用的本质与规律等,才可能立足于微粒及其作用的角度、从离子反应的本质与条件等方面去思考与分析电解质溶液反应、建立“宏观一微观一符号”三重表征的化学学科思维。
由于“微粒作用观”是离子方程式书写规则的思维内核,而理解离子方程式内涵意义又是建构“微粒作用观”认识思维的基础,因此“离子方程式”教学的关键,在于引导学生领悟“离子方程式”内涵意蕴、建构审视电解质溶液反应的认识思维,进而把握离子方程式书写规则。这三个方面的认识要求与认识思路如图1。
2.2促进意义理解与规则掌握的教学策略
学习心理学理论指:教学的挑战在于无法将学习任务强加给学生,需要引导学生自觉融入学习。而自觉融入学习的前提是让学生意识到认知冲突或价值,形成积极的学习心向。在此基础上,指导学生在学习活动中增进意义理解、炼制知识体系,并将自己炼制的知识体系应用到具体情境中,在问题解决中建构认识思维、完善知识体系并进一步领悟知识意义。根据这一理论,可采用图2所示教学思路与策略开展教学,最终达成对“离子方程式”意义理解与书写规则的掌握。
采用上述流程开展教学,应先创设情境,引发学生关于化学反应表示方法的认知冲突及对“离子方程式”的注意,形成为何学习、如何书写“离子方程式”的学习意向;接着,通过设置相关任务,引导学生观察思考、分析加工,认识“离子方程式”功能价值,增进“离子方程式”意义理解,并进一步驱动如何书写离子方程式的学习意向;在此基础上,通过分析与讨论,提出书写离子方程式的思路方法,并开展模仿实践,建构离子方程式的书写规则;最后,引导学生在具体情境中运用习得的规则去分析、解决问题,进一步丰富、完善并达到自动化阶段,从而掌握熟练的书写技能、深化对离子方程式意义的理解。
3 “离子方程式”教学的活动规划
根据前文分析,促进意义理解与规则掌握的“离子方程式”教学主要包含四个阶段,各阶段教学预期目标与任务安排简介如下
3.1阶段一:注意与预期,形成学习心向
任务1:(1)写出HC1和NaOH溶液反应的化学方程式;(2)该反应也可用“H++OH-=H2o”这一“离子方程式”表示。①指出两种化学反应表达方式的差异;②结合电解质电离的知识,谈谈对离子方程式及其书写的认识。endprint
设计意图:引导学生对比感知化学方程式和离子方程式表示中和反应的差异,并在分析基础上发现离子方程式并未标注Na+和Cl-等微粒,从而引发认知冲突,形成开展为何不需要表示这些离子的探究学习心向。在此基础上,给出“结合电解质电离”的思路提示并交流讨论,发现反应前后体系中均存在Na+和Cl-,表明未参与反应,初步感知离子方程式表达微粒间真实作用、用真实参与反应的离子表达化学反应的意义和书写要求,初步建立从微粒视角分析物质反应的基本思路。
3.2阶段二:观察与分析,促进意义理解
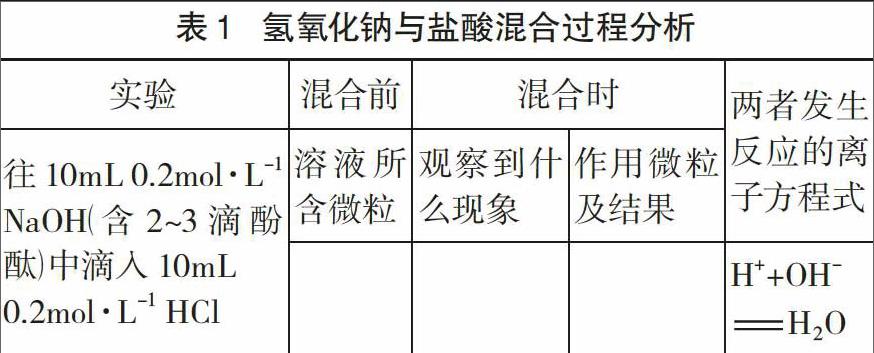
任务2:用离子方程式“H++OH-=H2o”表示HC1和NaOH反应,意味着H+与OH-参与反应并生成H2o、Na+和Cl-并未参与反应。(1)观察下列实验并描述现象:①取lOmL 0.2mol·L-1的NaOH溶液(含2~3滴酚酞),分三次加入体积共lOmL的0.2mol·L-1的盐酸,并测最终所得混合溶液的pH及电导率;②用同一装置测20mLO.lmol·L-1的NaCl溶液的pH及电导率,并与①对比(注:如果学生情况较好,也可以让学生自行设计);(2)哪些事实现象证明用“H++OH-=H2o”表示HCl和NaOH反应的前述分析是可靠的;(3)结合前述分析并填写表1,进一步谈对“离子方程式”的认识。
设计意图:结合实验活动并获取溶液pH及电导率相等的事实,确证H+与OH-参与反应而Na+和Cl-未參与反应的推理,进一步认识到前阶段感知的离子方程式意义及书写要求等的正确性与合理性;同时,根据表格呈现的电解质溶液反应的分析思路,深化对离子方程式反映电解质溶液反应微观本质的认识,建立审视电解质溶液系统哪些微粒发生作用、怎样作用及作用结果如何的“微粒作用观”的认识思维,加深对电解质溶液反应的宏观、微观和符号三方面及其相关关系的认识。
任务3:HC1与KOH、H2So4与NaOH也能发生反应。(1)结合电解质在水溶液中行为及相互作用的分析,思考可用怎样的离子方程式来表示这两个反应?(2)对比前述三个反应,你将发现它们的离子方程式有何特点?从反应物和生成物的类别、反应类型上看,它们有何共同之处?
任务4:总结对离子方程式的认识,并谈谈用离子方程式表示化学反应有何优点。
设计意图:将初步建立的审视电解质溶液反应的“微粒作用观”认识思维迁移到新的情境中,结合对其他具体的中和反应的微观作用的分析,认识到三个不同的中和反应微观本质相一致并能用同一离子方程式表示,深化对“微粒作用观”分析思维的理解、感悟到离子方程式能表示一类化学反应;领悟到离子方程式连接宏观现象与微观本质的内涵意义,体验到离子方程式具有表达简洁、反映本质、可表示一类反应的优点,认识到掌握好离子方程式书写的重要性和必要性。
3.3阶段三:模仿与加工,建构书写规则
任务5:结合对离子方程式的认识并参照表1,思考书写离子方程式时要考虑哪些方面?请以BaCl2,与Na2Co3溶液反应的离子方程式书写为例来谈谈。
任务6:按照你的思路,书写Ba(OH)2与Na2So4溶液、H2So4与Na2Co3溶液反应的离子方程式。
任务7:请概括总结如何书写离子方程式的思路与步骤。
设计思路:根据表1关于分析电解质溶液反应思路的外显步骤和离子方程式表达真实参与反应离子的认识,在模仿分析基础上,书写BaCl2与Na22Co3溶液反应的离子方程式,初步建构“分析溶液所含微粒一确定参与反应的微粒一表达微粒作用及其结果”的离子方程式书写思路;在此基础上,应用建构起来的书写思路指导Ba(OH)2与Na2So4溶液、H2So4与Na2Co3溶液反应的离子方程式的书写,检验与完善离子方程式的书写思路与规则,深化对离子方程式连接宏观现象与微观本质的理解。
3.4 阶段四:迁移与应用,完善规则并熟练运用
任务8:请写出 H2So4与Ba(OH)2溶液反应的离子方程式。
任务9:对于硫酸与氢氧化钡溶液反应,同学们写出了“H++s(o4)2-+Ba2++OH-=BaS04+H2o”和“2H++s(o4)2-+Ba2++2oH-=BaS04+2H2o”两个不同的表达式。请思考:(1)两个不同表达式是否符合前述概括的离子方程式书写要求?(2)对于这两个离子方程式,究竟哪个才是正确的?为什么?[注:若学生难以判断,可先给予如下任务铺垫:现有1L O.lmol·L-1的H2so4、Ba(OH)2溶液,将两者混合,参与反应的四种离子的物质的量之比是多少?](3)通过分析,你对离子方程式书写又有何新认识?
设计意图:根据前面建构的书写思路,学生能够关注参与反应离子的种类,但对数目或配比则容易忽视。因而,本阶段试图让学生自行尝试书写H2SO4与Ba(OH)2溶液反应的离子方程式,并经过任务9的定量分析讨论,认识到离子方程式的书写不仅要关注谁来参与反应、反应结果如何的问题,而且还要关注参与反应离子配比的问题。至此,学生将建构起完备的书写思路。
任务10:对于“Ba2++c(o3)2-=BaCO3”这一离子反应,它能代表哪些不同的盐之间发生反应?请结合盐的组成及在水溶液中的行为,谈谈你的认识。
设计意图:给出具体的离子方程式,要求学生从物质组成及其在水溶液中行为的角度进行逆向分析,推断该离子方程式所能代表的具体反应,不仅能够检测学生对离子反应条件、离子方程式书写等的掌握情况,而且深化对离子方程式可表示一类反应的认识,同时有助于学生理解离子方程式还能够反映物质组成、性质、反应及其相互关系,拓展对离子方程式意义的认识。
4结语
中学化学课程中有许多“化学用语”类概念,如“化学方程式”、“离子方程式”、“热化学方程式”、“水解方程式”等。这些概念具有掌握概念涵义、学习书写技能的多重要求。由于此类化学概念内隐着研究与表征物质性质及其变化的认识思维,而其内隐的认识思维恰恰是掌握书写技能的前提和基础,因此教学时不能仅仅关注书写技能而忽视对概念意义及其思维的深刻理解,否则将难以有效达成教学目标。此类概念教学的关键,显然要引导学生在具体情境中通过观察与分析、训练与应用,从而建立起相应的物质性质及其变化的认识思路、建立起“宏观一微观一符号”三者内在逻辑,实现从宏观、微观和符号三个层次上认识“化学用语”类概念.突破化学用语学习的“瓶颈”并予以科学、规范地表达。

