新疆不同产地红花多糖含量测定及抗氧化活性研究
任丽君, 袁 洁, 姚 军
(1新疆昌吉职业技术学院, 新疆 昌吉 831100; 新疆医科大学2厚博学院, 新疆 克拉玛依 834000; 3药学院, 乌鲁木齐 830011)
红花为菊科植物红花(CarthamustinctoriusL.)的干燥管状花,具有散瘀止痛,活血通经等功效,是我国的传统中药[1]。由于新疆独特的气候条件,红花的产量占全国的80%[2],主要分布于塔城、伊犁及和田地区。研究表明,红花中富含黄酮类、甾体类、脂肪酸及多糖类等多种化学成分[3-4]。目前国内外研究对红花中红/黄色素报道较多[5-6],而对其多糖成分研究较少。植物多糖是植物细胞代谢产生的聚合度超过10个的聚糖,具有降血糖、降血脂、抗氧化、调节机体免疫能力等药理作用[7-10]。目前对红花多糖的研究主要集中在免疫调节作用及抗肿瘤作用[11-13],关于抗氧化方面的研究鲜有报道。本研究以新疆特色药材红花为研究对象,采用响应面法优化红花多糖的水提醇沉工艺,比较了塔城、伊犁、和田3个不同产地红花中多糖的含量,并进行了体外抗氧化活性研究,现报道如下。
1 仪器与试药
1.1仪器752N型紫外可见分光光度计(上海精密科学仪器有限公司),HWS-26型电热恒温水浴锅(上海一恒科学仪器有限公司),ESJ210-4A型分析天平(苏州江东精密仪器有限公司),RE-2000A型旋转蒸发器(上海亚荣生化仪器厂),L-420型台式低速自动平衡离心机(湖南湘仪实验仪器开发有限公司)。
1.2试剂蒽酮(上海科非实业有限公司,批号130602),硫酸铜(北京百灵威科技有限公司,批号160403),抗坏血酸(天津市天新精细化公开发中心,批号078211),硫酸亚铁(天津市福晨化学试剂厂,批号457891),葡萄糖(天津市科密欧化学试剂有限公司,批号160811),DPPH(上海梯希爱化成工业发展有限公司,批号160532),无水乙醇(天津市富宇精细化工有限公司,批号160706);丙酮(天津市富宇精细化工有限公司,批号151210),试剂均为分析纯。
1.3药材红花药材于2016年7月购买自新疆医科大学附属中医医院中药房,产地分别为塔城、伊犁及和田,经新疆医科大学生药教研室帕丽达教授鉴定为菊科植物红花(CarthamustinctoriusL.)的干燥花。
2 方法与结果
2.1红花多糖供试品溶液的制备及含量测定称取2 g粉碎后的红花于250 mL的圆底烧瓶中,按设定的料液比、提取温度及提取时间提取2次,合并滤液。将滤液减压浓缩至原体积的1/4,加入95%乙醇至滤液中乙醇终浓度为80%,于4℃静置24 h,4 000 r/min离心20 min,所得沉淀用无水乙醇、丙酮、无水乙醚依次洗涤,经干燥后得红花粗多糖。精密量取已配置好的红花多糖溶液1 mL,按下述方法测定吸光度,带入回归方程计算出多糖的质量浓度。按下式计算红花多糖的提取率:

2.2葡萄糖对照品溶液的制备称取34.7 mg无水葡萄糖对照品,置于100 mL容量瓶中,加蒸馏水溶解定容至刻度,摇匀,即得质量浓度为0.347 mg/mL的对照品溶液。
2.3标准曲线的制备量取“2.2”项下对照品溶液0.05、0.10、0.15、0.20、0.25、0.30 mL,分别置于5 mL具塞刻度试管中,加水至1.0 mL,摇匀,在冰水浴中缓慢滴加0.2%蒽酮-硫酸溶液至刻度,混匀,放冷后置水浴中保温10 min,在582 nm波长下测其吸光度,以等量蒸馏水代替葡萄糖对照品溶液为空白[14]。以吸光度(A)为纵坐标,葡萄糖质量浓度(C)为横坐标,进行线性回归。得回归方程A=0.036C+0.080,r=0.999 0,葡萄糖浓度在3.3~19.8 μg/mL范围内线性关系良好。
2.4红花粗多糖提取的单因素试验
2.4.1 不同料液比对红花多糖提取率的影响 提取温度80℃、提取时间1.5 h条件下,设定料液比分别为1∶20、1∶35、1∶:50、1∶65、1∶80(g/mL)时对多糖提取率的影响。红花多糖的提取率随料液比的增加呈现先上升后下降的趋势,在料液比1∶65时达到峰值,提取率为3.32%。但是料液比在1∶50~1∶65,多糖提取率增加极其缓慢,综合考虑实验成本,料液比以1∶50(g/mL)为宜,见图1。

图1 料液对与多糖提取率的影响
2.4.2 不同提取温度对红花多糖提取率的影响 在料液比1∶50 (g/mL)、提取时间1.5 h条件下,设定提取温度分别为60、70、80、90、100℃时对多糖提取率的影响。多糖提取率在60~90℃范围内随温度逐渐增高,但是超过90℃时,提取率降低,见图2。
2.4.3 不同提取时间对红花多糖提取率的影响 在料液比1∶50 (g/mL)、提取温度80℃条件下,研究提取时间分别为0.5、1.0、1.5、2.0、2.5 h时对多糖提取率的影响。提取时间在0.5~2 h,多糖提取率随时间的延长而增大,但是提取时间在1.5~2 h,多糖提取率只增加了0.02%,综合考虑实验中能源消耗,提取时间以1.5 h为宜,见图3。
2.5响应面法优化红花多糖的提取工艺
2.5.1 试验设计与结果 在单因素实验的基础上,采用中心组合实验原理,以料液比(A)、提取温度(B)、提取时间(C)为自变量,红花多糖提取率(Y)为评价指标,对提取工艺进行优化,试验设计及结果见表1、2。
2.5.2 模型拟合 利用Design-Expert8.0软件对表2所示数据进行多元回归拟合,得到二次响应面回归方程为:Y=3.42+0.030A+0.12B+0.11C+0.035AB+0.050AC+0.035BC-0.49A2-0.20B2-0.10C2。模型项中P<0.01,表明该模型达到极显著水平,模型选择正确。二次项模型中A2项P<0.01,具有统计学意义,模型中其他项P均<0.05,具有统计学意义。各因素对多糖提取率的影响从大到小依次为提取温度>提取时间>料液比,见表3。

表1 响应面分析因素与水平
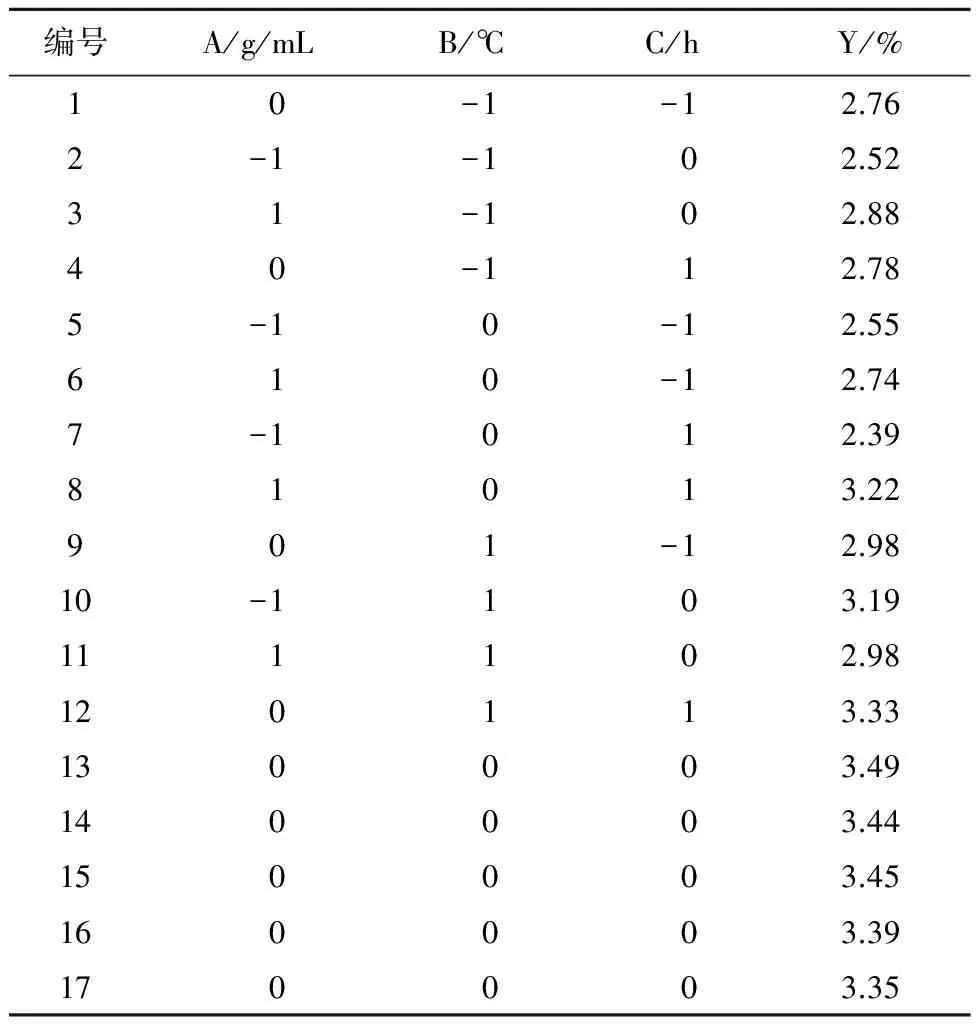
表2 响应面分析方案及结果
2.5.3 各因素交互作用对多糖提取率的响应面分析 根据回归方程,可以得到影响红花多糖提取的各因素两两交互作用的响应曲面,从响应曲面的弯曲程度可以得出各因素交互作用对多糖提取率的影响,影响由大到小依次为:料液比与提取温度、料液比与提取时间、提取温度与提取时间。结合二次回归方程的数学分析结果,提取红花多糖的最佳条件为料液比1∶51(g/mL),提取温度94℃,提取时间1.8 h,预计红花粗多糖的提取率为3.48%。对最佳工艺条件进行验证试验,结果红花多糖平均提取率为(3.46±0.84)%,见图4~6。

表3 回归方程方差分析结果
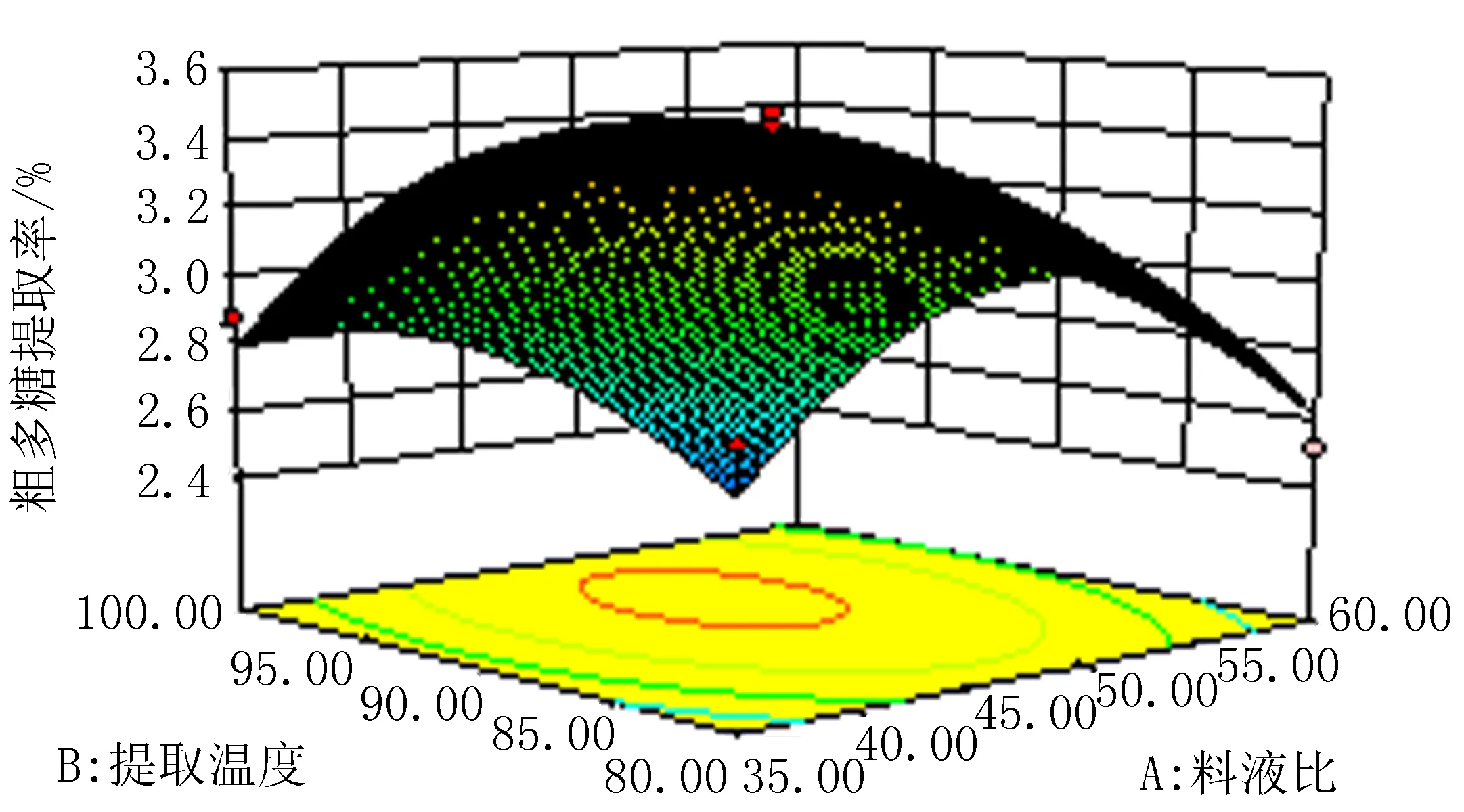
图4 料液比与提取温度对多糖提取率的影响

图5 料液比与提取时间对多糖提取率的影响
2.6不同产地红花多糖的含量测定按照红花多糖的最佳提取条件测定塔城、伊犁及和田3个产地红花中多糖的含量,分别为(32.7±6.2)、(34.6±8.4)、(28.9±7.6)mg/g。以3个产地中红花多糖含量最高的伊犁红花为对象,进行红花多糖的体外抗氧化活性研究。

图6 提取温度与提取时间对多糖提取率的影响
2.7红花多糖的体外抗氧化活性
2.7.1 红花多糖对DPPH·的清除作用 用蒸馏水配制质量浓度分别为3.0、4.5、6.0、7.5、9.0 μg/mL的红花多糖样品溶液和阳性对照Vc溶液。将上述溶液各2 mL分别与已配制好的2×10-4mol/L DPPH乙醇溶液2 mL 加入同一具塞管中,再继续加入无水乙醇1 mL,摇匀。反应30 min后在517 nm处测定其吸光度为Ai,以2 mL蒸馏水代替样品溶液同法测其吸光度为A0,以2 mL无水乙醇代替DPPH溶液同法测其吸光度为Aj,按公式DPPH·清除率(%)=A0-(Ai-Aj)/A0×100%,计算多糖对DPPH·的清除率。
在3.0~9.0 μg/mL实验浓度范围内,红花多糖和Vc随质量浓度的增加,其对DPPH·的清除作用逐渐增强,并呈现一定的量效关系。红花多糖质量浓度在9.0μg/mL时清除率最大,达到64.18%。等质量浓度,红花多糖对DPPH·的清除率低于Vc,见图7。

图7 红花多糖及Vc对DPPH·的清除作用
2.7.2 红花多糖对·OH的清除作用 将1.0 mL不同浓度(3、6、9、12、15 μg/mL)的多糖溶液与2 mL FeSO4(2.0 mmol/L)、3mL水杨酸乙醇溶液(2.0 mmol/L)和2mL H2O2(2.0 mmol/L)混合,37℃水浴加热反应30 min后,于510 nm处测其吸光度为A2。以等体积的蒸馏水代替样品作空白对照,测其吸光度为A1,等量的Vc代替样品作阳性对照。按公式·OH清除率(%)=(A1-A2)/A1×100%,计算多糖对·OH的清除率。在实验浓度范围内,对·OH的清除作用随着红花多糖和Vc质量浓度的增加而增强。在低质量浓度3 μg/mL时,红花多糖对·OH的抑制率仅为5%,当红花多糖质量浓度为15 μg/mL时,其对·OH的清除率达44%,可见红花多糖对·OH的清除作用随浓度变化幅度较大。整体来看,Vc对·OH清除能力要强于红花多糖,见图8。
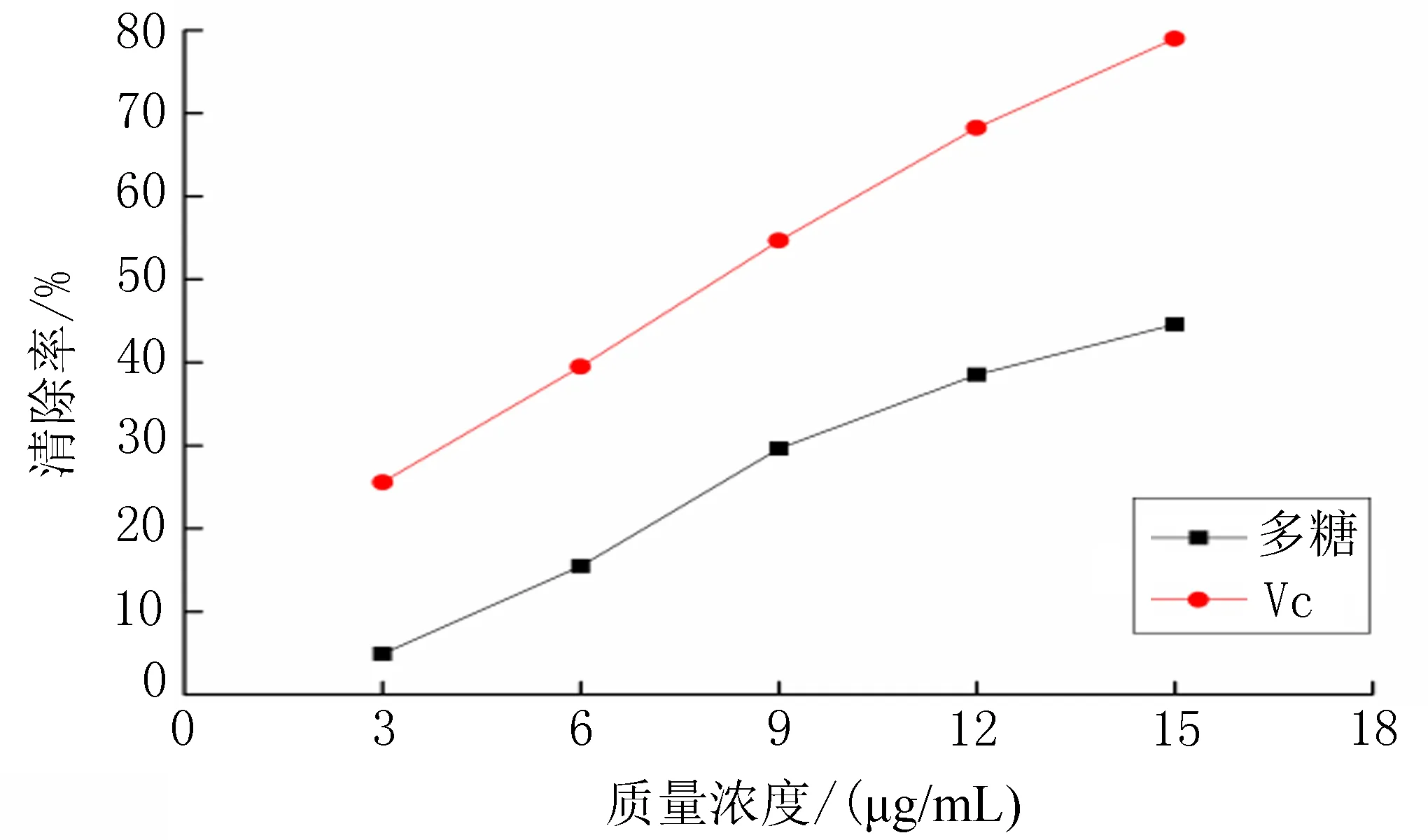
图8 红花多糖及Vc对·OH的清除作用
2.7.3 红花多糖对铜离子还原能力的测定 将5.0 mL不同浓度的多糖溶液(3.0、4.5、6.0、7.5、9.0 μg/mL)与1.25 mL 新亚铜试剂(7.5 mmol/L)和1 mL CuSO4(0.01 mol/L)混合,再缓慢加入3.75 mL醋酸铵缓冲液(0. 2mol/L、pH=7.0),混匀。静置30 min,于450 nm处测定其吸光度。每组实验平行测定3次,平均吸光度为A,最大吸光度为Amax。以等体积的蒸馏水代替样品作空白对照组,测其吸光度为A0,以等量的Vc代替样品作阳性对照。按公式铜离子还原能力(%)=(A-A0)/(Amax-A0)×100%,计算多糖对铜离子的还原能力。红花多糖和Vc对铜离子还原能力随着浓度的增加而增强,在浓度为9.0μg/mL时,达到最大值,其中红花多糖对铜离子还原能力为84.7%,Vc对铜离子还原能力为95.4%。见图9。

图9 红花多糖及Vc对铜离子的还原能力
3 讨论
本实验以料液比、提取温度、提取时间为自变量,多糖的提取率为评价指标,采用响应面法分析优化红花多糖的提取工艺,得到红花多糖最佳提取工艺条件为料液比1∶51(g/mL),提取温度94℃,提取时间1.8 h,预计红花粗多糖的提取率为3.48%。各因素对红花多糖提取率的影响依次为提取温度>提取时间>料液比。不同产地红花多糖的含量存在差异,以伊犁红花的多糖含量最高,其次是塔城红花,和田红花最低。这一结果可能与各产地生态环境的差异有关,如土壤、光照、降水量等。红花多糖的体外抗氧化活性研究结果显示,在高浓度时,其对DPPH·和·OH具有清除能力,对铜离子具有较强的还原能力。虽然等质量浓度的红花多糖体外抗氧化活性不及Vc,但是毒性远低于人工合成抗氧化剂,因此有望被开发成为天然的抗氧化剂应用于医药及食品行业。
[1] 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京:中国医药科技出版社, 2015: 151.
[2] 彭云承.伊犁河谷红花生产现状及发展对策[J].新疆农垦科技, 2015,38 (2): 13-14.
[3] 薛晓珍, 张敏. 新疆红花的主要营养成分及利用价值[J]. 中国食物与营养, 2005, 12(1): 403-405.
[4] 刘玉明, 杨峻山, 刘庆华. 红花化学成分研究[J]. 中药材, 2005, 28(4): 288-289.
[5] 周洁. 红花红色素研究进展[J]. 粮食与油脂, 2011, 18(4): 46-47.
[6] 王忠全, 丁卓伶. 红花黄色素临床应用研究进展[J]. 中国药业, 2014,22 (16): 125-127.
[7] 李志孝, 黄成钢, 蔡育军, 等. 天门冬多糖的化学结构及体外抗氧化活性[J]. 药学学报, 2000, 35(5): 358-362.
[8] 吴梅,谭睿. 黄芪多糖研究进展[J]. 川北医学院学报, 2013, 28(1): 17-22.
[9] 任燕萍. 酸枣仁有效成分的提取及其药理作用研究[J]. 海峡药学, 2011, 23(12): 89-91.
[10] 高嘉屿, 杨櫹, 宋天星, 等. 白花蛇舌草多糖提取的工艺优化及抗氧化活性研究[J]. 辽宁中医杂志, 2016, 43(1): 109-111.
[11] 黄虹, 俞曼雷, 霍世康. 红花多糖的免疫活性研究[J]. 中草药, 1984, 15(5): 21-24.
[12] 周明瑶, 阮殿清, 陈德欣. 红花多糖对人PBMC增殖活性及NK、LAK细胞杀伤活性的影响[J]. 中医药信息, 2010, 27(1): 47-48.
[13] 石学魁, 阮殿清, 王亚贤, 等. 红花多糖抗肿瘤活性及对T739肺癌鼠CTL, NK细胞杀伤活性的影响[J]. 中国中药杂志, 2010, 35(2): 215-218.
[14] 张庆红, 马梅芳. 硫酸-蒽酮法测定天冬中多糖含量[J]. 中国现代中药, 2008, 10(8): 18-19, 22.

