还原型谷胱甘肽太赫兹光谱及振动模式分析
,,,,,
(山东科技大学 电子通信与物理学院,山东 青岛 266590)
多肽是由氨基酸组成的简单的蛋白质分子,谷胱甘肽是一种具有重要生理功能的活性三肽,几乎存在于身体每一个细胞中,能帮助保持正常免疫系统的功能。谷胱甘肽由谷氨酸、半胱氨酸和甘氨酸经肽键缩合而成,化学名为γ-L-谷氨酰-L-半胱氨酰-甘氨酸,晶体呈无色透明细长柱状。由于谷胱甘肽本身的解毒和抗氧化能力,使得谷胱甘肽具有重要的保肝护肝作用。临床上应用还原型谷胱甘肽作为保肝的重要药物成分。
X射线晶体衍射是目前确定蛋白质结构最准确的方法,但要求蛋白质是晶体存在,这对于结构复杂的大分子蛋白质来说较为困难;核磁共振法是目前比较成熟的分子结构研究的方法,高分辨的核磁技术给出的结构可与X射线衍射相媲美[1],然而其缺点是实验耗时长,且蛋白质标记过程复杂。相比之下,太赫兹波光子能量处于大分子及分子团的振动和转动能级,因此能够用来探测低频率的键振动、晶态声子振动、氢键的伸缩和弯曲振动等[2]。太赫兹光谱对氢键、范德华力等许多分子间弱的相互作用力非常敏感,能够反映化合物结构的指纹特征,因此可以用来鉴定多肽的结构[3-4]。近年来,太赫兹光谱开始被用来研究蛋白质的分子结构。Kikuchi[5]首次利用变角THz-TDS测定L-半胱氨酸和L-组氨酸的氨基酸单晶体的太赫兹光谱,发现氨基酸在THz频段比在红外频段表现出更多独特吸收特征。之后对多肽的研究也开始展开,Plusquellic等[6-7]利用THz-FTIR技术检测不同晶型的多肽,获得了明显不同的THz波谱,并且发现短链晶型的多肽在THz波段依然有明显的特征吸收。对于谷胱甘肽的研究,马晓菁等[8]利用太赫兹时域光谱技术研究了还原型及氧化型谷胱甘肽在0.2~1.4 THz波段的光谱特性,得出还原型谷胱甘肽在0.8~0.9和1.2 THz处有明显吸收峰;闫海涛等[9]利用太赫兹时域光谱测试技术,对还原型和氧化型谷胱甘肽分子在0.2~2.5 THz波段的光学特性进行了研究,测出了还原型谷胱甘肽在0.85、1.20、1.52、1.64和2.34 THz附近有明显吸收峰,并得出样品的平均折射率为1.77;但仅仅测出了谷胱甘肽分子的吸收峰及折射率,并没有对各吸收峰处的分子具体振动模式给出合理的理论解释。
本研究对三肽谷胱甘肽进行了研究,用THz-TDS对常温下的还原型谷胱甘肽粉末进行了测量,并用Guassian09软件采用密度泛函理论(density functional theory,DFT)对还原型谷胱甘肽的吸收谱线进行分子动力学模拟,通过实验结果与分子模拟的比较,对各个振动吸收谱线的分子振动机制给出理论解释,为以后的蛋白质功能结构分析提供参考。
1 振动光谱理论模拟计算
Hartree-Fock方程(简称HF方程)是一个应用变分法计算多电子体系波函数的方法,是量子化学中最重要的方程之一。基于分子轨道理论的所有量子化学计算方法都是以HF方程为基础的。密度泛函理论是以电子密度为变量,将能量表示为密度的泛函,从而计算电子体系。密度泛函方法的长处在于包含了电子相关,而HF方法只是平均意义上的处理电子相关,这使得在某些体系和同等耗时的情况下,DFT计算比HF方法有更高的精度[10-11]。
Guassian09软件是一个相当成熟的量子化学计算软件,可以通过理论计算获得分子在红外的振动模式和吸收谱,用于对THz波段的吸收光谱进行解析。本研究采用Gaussian09软件对还原型谷胱甘肽分子进行计算模拟,选取密度泛函(DFT)理论B3LYP方法,在6~31 G(d,p)基组下进行计算。首先进行分子结构优化,优化结果如图1所示(氢原子被隐藏),然后再进行分子的振动频率计算。光谱模拟计算结果如图2所示,样品的计算结果中无虚频出现,说明优化结果为分子能量最小的结构。由于模拟中没有完全考虑电子相关作用以及对非简谐效应的忽略和基组的选择等因素,采用相应的矫正因子0.96[12-13]。
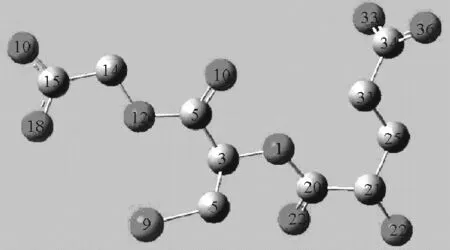
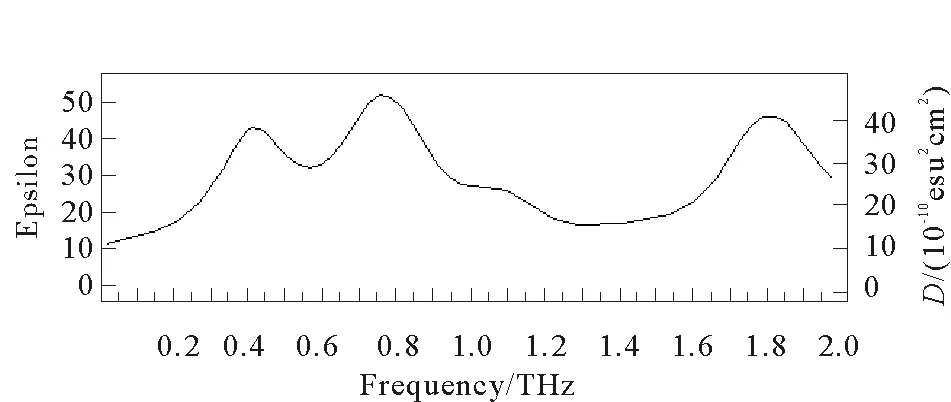
图1 还原型谷胱甘肽分子结构优化图Fig.1 Optimization structure of reduced glutathione molecule
2 太赫兹时域光谱测量实验
2.1 测试样品的制备
还原型谷胱甘肽样品购自生工生物工程(上海)股份有限公司,纯度>99.5%,使用时未进一步提纯。使用FW-4A粉末压片机在10 MPa的压力下将还原型谷胱甘肽粉末样品压制成直径13 mm、厚度1.55 mm无裂缝且两端面平行的圆形薄片。
2.2 样品测量的实验条件
实验测量采用的THz-TDS实验装置由Spectra-Physics公司的Mai Tai飞秒激光器(中心波长设置为780 nm,频率为80 MHz,脉宽为100 fs)和德国BATOP公司的TDS1008太赫兹时域光谱系统(光谱范围0.05~4.0 THz,峰值信噪比75 dB,频谱分辨率≥2.0 GHz)组成。实验在室温条件下进行。
2.3 实验测量原理光路
实验利用太赫兹时域光谱系统(THz-TDS)采用透射式方法对样品进行测量,整个测量系统包含四个部分,分别为飞秒激光器、太赫兹辐射产生装置及对应的探测装置、时间延迟系统以及数据采集与信号处理系统,其光路原理图如图3所示。PBS为偏振分光棱镜,M1-M7均为反射镜,L1、L2为聚焦透镜。
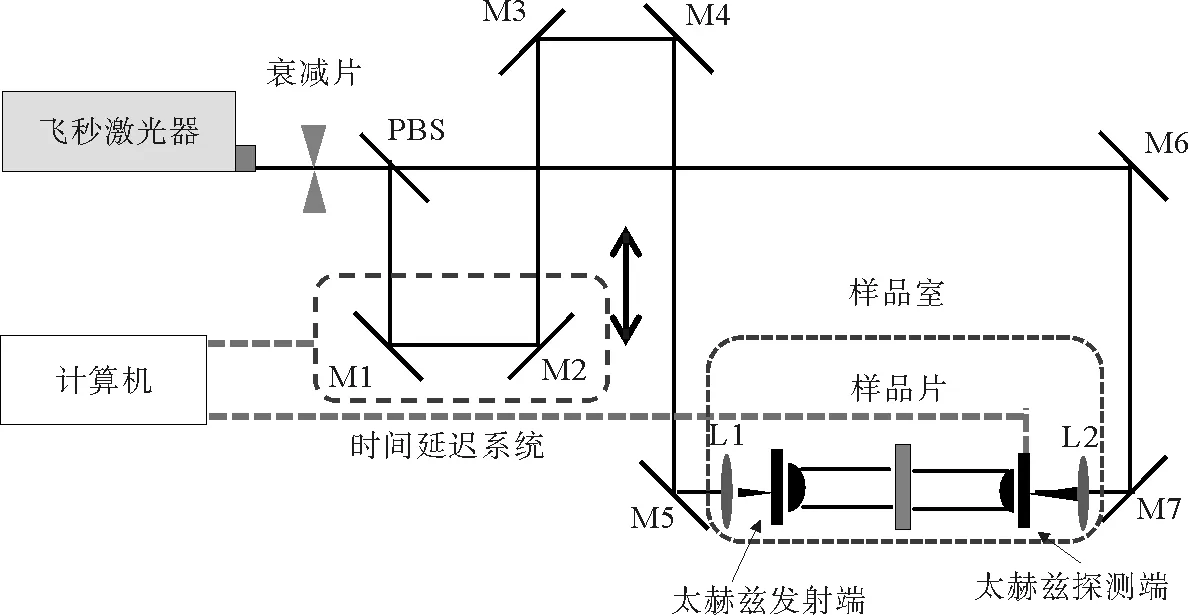
图3 THz-TDS透射式样品测量原理图Fig.3 Experimental scheme of transmission type THz-TDS
设备中所用的光电导发射天线和探测天线最大泵浦功率分别为11.8 mW和11.5 mW,而飞秒激光器的输出功率较大,为避免损坏天线,在飞秒激光进入系统之前利用衰减片将功率降低到设备要求的130 mW以下。飞秒激光进入系统之后经过偏振分光棱镜被分为两束,反射光为泵浦光,透射光为探测光。泵浦光经过由步进电机和两个反射镜组成的光学延迟系统后,再经过反射镜后被一个透镜聚焦在发射天线上产生太赫兹脉冲;探测光经过一系列反射镜和一个透镜后被聚焦在探测天线上。时间延迟系统以及探测端经过数据采集和信号处理系统后均连接至外部计算机,用计算机直接控制和处理[14]。
2.4 测量结果
将压制好的还原型谷胱甘肽样品薄片放在样品室中,经过实验测量,从计算机中提取THz波在空气中传播(作为参考信号,虚线)和通过还原型谷胱甘肽测试样品(实线)获得的时域信号,如图4(a)所示。将时域信号经过快速傅立叶变换得到的频域谱图如图4(b)所示,可以看出,在0~2 THz范围内还原型谷胱甘肽样品信号相对于参考信号有明显的吸收。
3 还原型谷胱甘肽的太赫兹光谱分析
3.1 实验数据处理
根据文献[15-16]提出的提取材料THz光学参数的物理模型,设入射的THz电场为ETHz(ω),Eref(ω)和Esam(ω)分别为参考信号和样品信号。则不经过样品,在空气中传播距离L后的参考信号可以写成
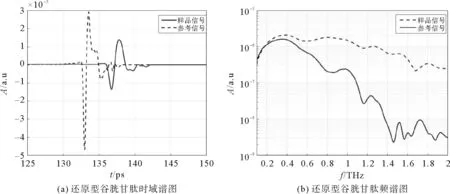
图4 还原型谷胱甘肽的频谱与时域谱Fig.4 Time-domain and frequency-domain spectrum of reduced glutathione
。
(1)
其中:ω为角频率,c为光速,n0为空气的复折射率。
当THz波垂直样品表面入射,忽略多次反射效应,根据Fresnel公式可以得出透射率函数为
tos(ω)=2ns/(n0+ns)。
(2)
式中:ns为样品的复折射率,n0为样品周围空气的复折射率,实验中取空气中折射率n0为1。因而经过厚度为d的样品的信号可以写成
Esam(ω)=ETHz(ω)tose-jns(ωd)/ctsoe-jn0(ω)ω(L-d)/c。
(3)
根据公式(1)和(3)得到复透射函数:
H(ω)=Esam(ω)/Eref(ω)=4nse-jωd(ns-1)/c/(1+ns)2=ρ(ω)e-jφ(ω)。
(4)
其中φ(ω)和ρ(ω)分别为两波的相位差和振幅模的比值,可由THz-TDS实验得出。将n=n(ω)-jκ(ω)代入式(3)和(4),当样品的消光系数远远小于折射率时,有
ρ(ω)=4ns(ω)e-κ(ω)dω/c/(ns(ω)+1)2,
(5)
φ(ω)=(ns(ω)-1)ωd/c。
(6)
则样品的折射率和吸收系数分别为:
ns(ω)=φ(ω)c/ωd+1,
(7)
αs(ω)=2κs(ω)ω/c=21n{4ns(ω)}/[ρ(ω)(ns(ω)+1)2]}/d。
(8)
3.2 结果分析
根据实验结果,利用上述数据处理方法可得到还原型谷胱甘肽在0.1~2 THz范围内的折射率曲线,如图5所示。图6为还原型谷胱甘肽在0.1~2 THz波段的吸收谱,其中虚线为根据公式(8)得出的吸收谱线,实线为Gaussian09软件生成的模拟吸收谱线。由图5可以看出,还原型谷胱甘肽样品的折射率在0.1~2 THz范围内呈整体下降趋势,但在0.74、1.12、1.37、1.48、1.59、1.77、1.96 THz频率位置处出现上升峰值,这与图6中样品的实验测量吸收曲线的吸收峰位置(0.81、1.16、1.46、1.56、1.63、1.81、1.87 THz)基本对应,说明在特征吸收峰位置,谷胱甘肽的折射率会有明显增大。
由图6可以看出,还原型谷胱甘肽在0.81、1.16、1.46、1.56、1.63、1.81和1.87 THz处均有吸收峰;而理论模拟结果显示还原型谷胱甘肽分子仅在0.43、0.78、1.11和1.83 THz处有吸收峰。并且还原型谷胱甘肽的理论吸收峰相对于实验测量吸收峰发生了小幅频移现象,这可能是由于理论模拟是设定在0 K条件下进行的,而实验测量是在室温下进行,因此会产生频移现象[17-18]。实验测量吸收谱在1.46~1.63 THz处的多个吸收峰,模拟结果没有对应的吸收峰,这是由于理论模拟的是单分子状态,而对于分子间氢键相互作用没有考虑。因此,出现的吸收峰极可能是由分子间作用产生的。
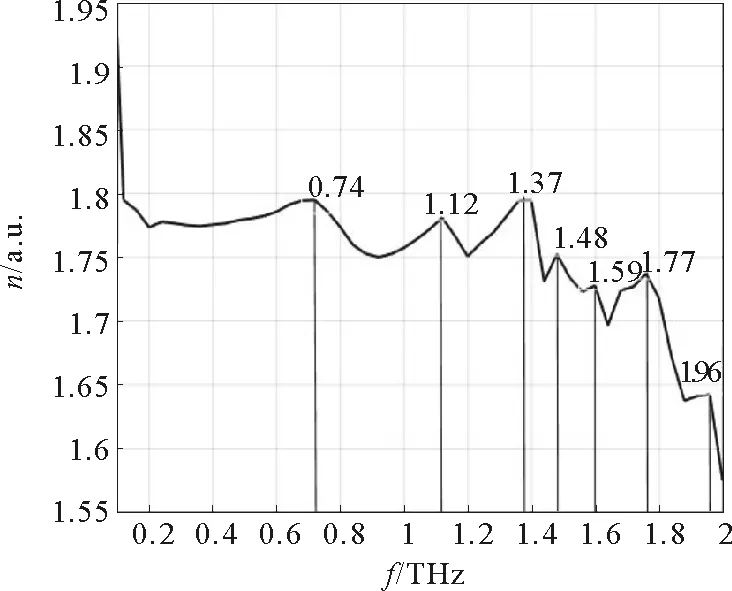
图5 还原型谷胱甘肽的折射率曲线Fig.5 Refractive index curve of reduced glutathione
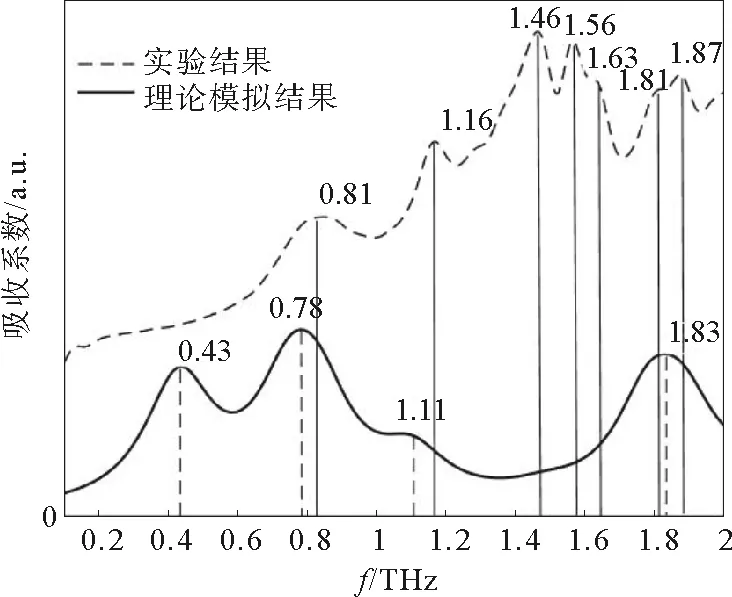
图6 还原型谷胱甘肽模拟及实验测量吸收谱Fig.6 Simulated and experimental absorption spectrum of reduced glutathione
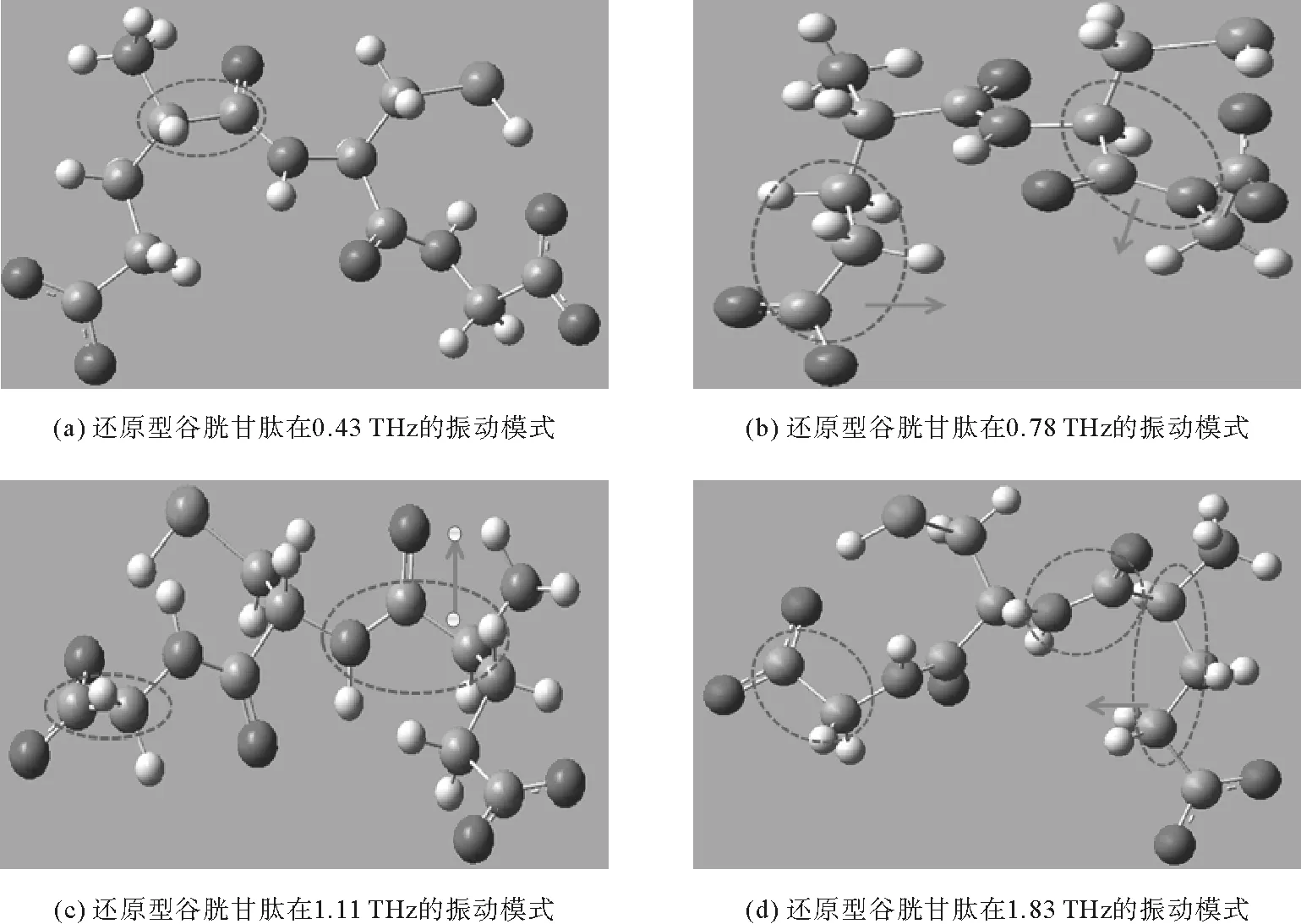
图7 还原型谷胱甘肽在各吸收频率的振动模式Fig.7 Vibration modes of reduced glutathione at each absorption frequency
进一步通过GaussianView的动态观察来分别查看还原型谷胱甘肽分子在各个吸收峰处的振动模式,对应情况如图7所示。还原型谷胱甘肽在0.43 THz处的吸收峰是由C21-C20扭动振动引起的(如图7(a)所示,虚线内为主要振动位置,但未在实验结果中显示)。在0.81 THz处吸收峰是由于C25-C31-C34OOH、C3-C6-N12H弯曲振动引起的(如图7(b)所示),1.16 THz处的吸收峰是由N12H-C14扭动振动和N1H-C20-C21弯曲振动引起的(如图7(c)所示),1.81 THz处的吸收峰是由C14-C15扭动振动、N1H-C20扭动振动以及C21-C25-C31弯曲振动共同引起的(如图7(d)所示),这三个频率实验中均有与之对应的吸收峰值。总体而言,Gaussian软件模拟的分子吸收谱线与实验测量的主要吸收峰基本吻合,能够较好地解释实验测量结果中出现吸收峰的微观机制。
4 结果与讨论
本研究在室温条件下利用THz-TDS对还原型谷胱甘肽在0.1~2 THz频率范围的吸收谱进行了测量,研究了其折射率在0.1~2 THz频率范围内的变化趋势,结果显示其折射率呈反常色散特性,并在特征吸收峰处有小幅上升。利用Guassian09软件对还原型谷胱甘肽在0.1~2 THz频率范围内分子振动模式进行了模拟,并通过GuassianView对其振动模式进行分析。在0.81、1.16、1.81 THz处实验测得的吸收峰与理论模拟吻合较好,通过模拟结果能够解释其微观形成机制,说明利用Gaussian09软件选取DFT方法能够较好的对实验测量THz吸收光谱进行微观解释。
[1]BAX A.Two-dimensional NMR and protein structure[J].Annual Review of Biochemistry,1989,58(1):223-256.
[2]YANG D.Applications of terahertz wave technology in smart textiles[M]. Singapore:Springer,2015.
[3]SONG H J,AJITO K,SHIMIZU N,et al.Terahertz wave applications using photonic technologies[C]//General Assembly and Scientific Symposium,2011 URSI.2011:1-4.
[4]刘盛纲,钟任斌.太赫兹科学技术及其应用的新发展[J].电子科技大学学报,2009,38(5):481-486.
LIU Shenggang,ZHONG Renbin.Recent development of terahertz science and technology and its applications[J].Journal of University of Electronic Science and Technology of China,2009,38(5):481-486.
[5]KIKUCHI N,TANNO T,WATANABE M,et al.A membrane method for terahertz spectroscopy of amino acids[J].Analytical Sciences,2009,25(3):457-459.
[6]SIEGRIST K,BUCHER C R,MANDELBAUM I,et al.High-resolution terahertz spectroscopy of crystalline trialanine:Extreme sensitivity to beta-sheet structure and cocrystallized water[J].Journal of the American Chemical Society,2006,128(17):5764-5775.
[7]AHMED Z,CHOU S G,SIEGRIST K,et al.State-resolved THz spectroscopy and dynamics of crystalline peptide-water systems[J].Faraday Discuss,2011,150(1):175-192.
[8]闫海涛,王卫宁,赵国忠,等.还原型和氧化型谷胱甘肽的THz光谱表征[C]//第十一届全国光电技术与系统学术会议论文集.北京:电子工业出版社,2005:936-941.
[9]马晓菁,代斌,赵红卫,等.还原型及氧化型谷胱甘肽的太赫兹时域光谱研究[J].石河子大学学报(自然科学版),2008,26(3):347-350.
MA Xiaojing,DAI Bin,ZHAO Hongwei,et al.Terahertz time-domain spectroscopy of reduced and oxidized L-glutathione[J].Journal of Shihezi University(Natural Science),2008,26(3):347-350.
[10]刘靖疆.基础量子化学与应用[M].北京:高等教育出版社,2004:228-289.
[11]靳涛.一价阳离子同甲醛的弱相互作用[J].山东科技大学学报(自然科学版),2013,32(1):50-55.
JIN Tao.Weak interaction of one-value ions and formaldehyde[J].Journal of Shandong University of Science and Techno-logy(Natural Science),2013,32(1):50-55.
[12]方虹霞,张琪,张慧丽,等.奥美沙坦与苯甲酸共晶的太赫兹光谱与密度泛函理论分析[J].高等学校化学学报,2015,36(12):2504-2510.
FANG Hongxia,ZHANG Qi,ZHANG Huili,et al.Terahertz spectroscopic and density functional throretical analysis of cocrystal between Olmesartan and benzoic zcid [J].Chemical Journal of Chinese Universities,2015,36(12):2504-2510.
[13]刘江燕,武书斌.化学图文设计与分子模拟计算[M].广州:华南理工大学出版社,2009:253-256.
[14]李德华,白亚,周薇,等.利用飞秒激光脉冲整形进行太赫兹波整形[J].山东科技大学学报(自然科学版),2008,27(4):60-64.
LI Dehua,BAI Ya,ZHOU Wei,et al.THz wave shaping technology via the femtosecond laser pulse shaping[J].Journal of Shandong University of Science and Technology(Natural Science),2008,27(4):60-64.
[15]TIMOTHY D D,RICHARD G B,DANIEL M M.Material parameter estimation with terahertz time-domain spectroscopy[J].Journal of the Optical Society of America A:Optics,Image Science and Vision,2001,18(7):1562-1571.
[16]DUVILLARET L,GARET F,COUTAZ J L.Highly precise determination of optical constants and sample thickness in terahertz time-domain spectroscopy[J].Applied Optics,1999,38(2):409-415.
[17]KING M D,BUCHANAN W D,KORTER T M.Identification and quantification of polymorphism in the pharmaceutical compound diclofenac acid by terahertz spectroscopy and solid-state density functional theory[J].Analytical Chemistry,2011,83(10):3786-3792.
[18]HAKEY P M,ALLIS D G,OUELLETTE W.Cryogenic terahertz spectrum of (+)-methamphetamine hydrochloride and assignment using solid-state density functional theory[J].Journal of Physical Chemistry A,2009,113(17):5119-5127.

