组胺对抑郁症大鼠运动欲望与空间记忆能力的影响
何叶成,姚 娟,陈 尚,李东印
(苏州卫生职业技术学院,江苏 苏州 215009)
近年来抑郁症的发病率呈快速增长趋势,其主要表现为情绪低落并且伴随认知功能减退[1-2]。抑郁症致病因素和临床症状呈多样性,发病机制至今尚未完全阐明。截至目前为止,下丘脑-垂体-肾上腺轴(HPA轴)功能亢进学说为多数学者认可的抑郁症主要发病机制[3-4]。然而,外界应激刺激信号作用于机体导致下丘脑兴奋后,除了通过HPA轴-体液途径发挥作用,其传出神经通路在抑郁症的发生发展过程中发挥了什么作用还有待进一步研究。
组胺(histamine)是继5-羟色胺(5-HT)、去甲肾上腺素(NE)之后在脑内新发现的一类单胺类神经递质,中枢组胺能神经元都聚集在下丘脑,神经纤维投射遍布各个脑区[5-6],调节神经元基础兴奋性从而对各个脑区功能进行调控[7]。海马作为边缘系统重要组成部分,在机体情绪和认知的调节过程中发挥重要作用。神经解剖学研究显示,下丘脑发出大量组胺能神经纤维投射到海马[7-8],提示下丘脑可能通过神经通路影响海马神经元的功能状态,进而对机体情绪和认知能力产生影响。C1区作为海马主要信号传出通路,是空间记忆形成的关键部位[3, 9]。本文以大鼠海马C1区为研究目标,通过离体脑片和在体细胞外记录的方法观察了组胺对海马C1区神经元放电频率的调节作用,并在整体水平观察了海马C1区注射组胺相关试剂对抑郁症模型大鼠运动欲望和空间记忆能力的影响,探索单胺类递质组胺在抑郁症发生发展中所起的作用。
1 材料和方法
1.1 实验动物
本文共使用216只清洁级雄性成年SD大鼠(150~250 g),由苏州大学实验动物中心供应 [SCXK (苏) 2012-0005]。单独饲养,常温环境,12 h明/暗交替,供给充足的标准大鼠饲料和水 [SYXK (苏) 2012-0045]。
1.2 主要试剂
组胺(Tocris,1A/198112);组胺H1受体激动剂2-pyridylethylamine(Tocris,2A/195553);组胺H1受体阻断剂triprolidine(Tocris,2A/189683);组胺H2受体激动剂dimaprit(Tocris,2B/182087);组胺H2受体阻断剂ranitidine(Tocris,1A/194394);组胺H3受体激动剂IMETIT(Tocris,5A/160009);组胺H3受体阻断剂clobenpropit(Tocris,3B/185670)。组胺和组胺受体激动剂、阻断剂的母液用蒸馏水配置,冷冻保存。使用前再用新鲜人工脑脊液将各药品母液稀释至实验所需的浓度。
1.3 实验方法
1.3.1 抑郁症模型大鼠的制备
采用经典的慢性未预知应激法构建大鼠抑郁症模型[10-11],慢性应激刺激方式包括:禁水(鼠笼无水瓶12 h后放空瓶1 h,其余时间正常饮水);禁食(鼠笼无鼠粮12 h后放3 g鼠粮2 h,其余时间正常饮食);夹尾l min;电击(50 V电压电击大鼠15次,每次10 s,中间间隔30 s);冷刺激(在4℃冰水中强迫游泳5 min);热刺激(在45℃烘箱中6 min);将垫料浸湿,持续24 h。一共7种形式,每日随机选取一种,持续刺激21 d,每种刺激出现3次,同种刺激不能连续出现,使动物不能预料刺激的发生,并以旷场实验鉴定造模成功与否。实验过程中按实验动物使用的3R原则给予人道主义关怀。
1.3.2 离体脑片细胞外记录
(1)脑片的制备:SD大鼠经乙醚麻醉,迅速断头取脑,将含有海马部分的脑组织块放入人工脑脊液中,通以95% O2/5% CO2混合气体,温度保持在4℃左右。根据定位图谱[12],将脑组织块切片,厚度为350~400 μm,选取含有海马神经元的脑片并将其转移到记录浴槽内进行孵育。记录浴槽被持续地灌流人工脑脊液孵育40 min后开始记录神经元放电[13]。
(2)离体脑片细胞外记录:采用玻璃微电极记录海马C1区神经元的自发放电活动。记录到神经元自发放电活动之后,维持20 min,确认其放电活动处于稳定状态。然后在灌流的人工脑脊液中加入药物刺激目标神经元,观察细胞的反应。神经元的放电信号输入计算机,用Spike 2(CED,UK)软件分析神经元的放电频率,并做出刺激-时间直方图,采样间隔1 s,以评价组胺相关试剂对海马C1区神经元的作用[14]。
1.3.3 在体细胞外记录
(1)动物手术:由乌拉坦(0.8 g/kg)和α-氯醛糖(65 mg/kg)组成的混合麻醉剂,经腹腔注射麻醉SD大鼠,将动物固定于脑立体定位仪上。依据鼠脑立体定位图谱找到下丘脑结节乳头体核(tuberomammillary nucleus,TMN)和同侧海马C1区上方,打开颅骨并移除硬脑膜,脑表面暴露后并覆以2%琼脂。将同心双极电极(内径0.1 mm,外径0.4 mm,尖端0.2 mm)插入下丘脑TMN以备刺激,将微量注射器针头插至海马C1区上方,用以加药[15]。
(2)刺激、电生理学记录、数据的采集和分析:以负相矩形双脉冲形式电刺激下丘脑TMN,用玻璃微电极记录海马C1区神经元的自发放电(与打药针头呈30°角进针)。海马神经元的放电信号输入计算机,用Spike 2软件进行实时数据分析。通过比较刺激或给药前后神经元的放电频率变化,判断所记录海马神经元的反应类型。对两窗口内的放电频率进行t检验,P< 0.05为差异有显著性[15]。
1.3.4 行为学实验
(1)手术和定点微量注射:腹腔注射戊巴比妥钠麻醉SD大鼠,将其头部固定于立体定位仪上。根据鼠脑立体定位图谱在海马C1区上方开颅,并将用于微量注射的两根不锈钢套管(长6 mm,外径0.8 mm,内径0.5 mm)植入大脑,使其下端分别定位在双侧海马C1区上方2 mm的位置,用不锈钢螺丝和牙科水泥固定于颅骨。手术后每只大鼠腹腔注射青霉素,并给予72 h的恢复期[16-17]。
给药时使用的微量注射器不锈钢针管长8 mm,其下端正好位于海马C1区表面,不至损伤神经核团。双侧同时缓慢注射,每侧每次注射量为1 μL,过程持续60 s以上。
(2)分组:完成手术的抑郁症模型大鼠恢复后,进行随机分组,共分8组,每组15只:对照组、histamine组、2-PyEA(H1受体激动剂)组、triprolidine(H1受体阻断剂)组、dimaprit(H2受体激动剂)组、ranitidine(H2受体阻断剂)组、IMETIT(H3受体激动剂)组和clobenpropit(H3受体阻断剂)组。各组以注射药物命名,对照组不注射药物。以上药物浓度均为10 mmol/L,剂量每次每侧注射1 μL。根据离体脑片细胞外记录实验[16],组胺及其相关试剂灌流浓度在10 μmol/L左右能够引起神经元发生明显的反应,而1 μL的药液注射至大鼠脑内扩散体积约为1 mL,稀释了约1000倍,故将在体实验注射药物浓度提高至10 mmol/L。
(3)旷场实验:旷场实验主要检测动物在新环境中的运动和探索欲望,是评价大鼠抑郁程度的经典方法,分水平运动和垂直运动两个观察指标,以观察得分为评分计算单位。将大鼠至于一个独立的空间(50 cm × 50 cm × 40 cm),整个开场被划分成(5 × 5)个边长为10 cm的方格。轻轻地将大鼠放入空间底部正中间,观察大鼠在5 min内水平和垂直两个方向的得分(水平得分:三爪均进入一个方格计一分;垂直得分:大鼠直立一次计一分)[13]。在旷场实验中,水平得分代表了大鼠的兴奋程度,垂直得分代表了大鼠对新环境的探索欲望。造模结束后,大鼠水平或者垂直得分与正常大鼠相比如果减少程度高于30%,则认为造模成功。每组大鼠造模成功后,第2天相同时间段打药后再进行检测对比。
(4)Morris水迷宫实验:Morris水迷宫是检测大鼠学习记忆能力的经典实验。水迷宫直径120 cm,高60 cm,实验时注入23℃温水至23 cm深。将水池平均分为四个象限,随机取一个象限,放入一个高20 cm的白色平台,位置保持固定,用食用钛白粉将水染成白色使平台隐蔽。实验前先对SD大鼠进行训练,训练时将大鼠背对平台放入水中,并记录大鼠入水后找到平台所需要的时间,记为逃避潜伏期。大鼠找到平台后在其上停留20 s,然后擦干放回笼内。每次训练选择不同的象限入水,每两次训练间隔大于30 s,训练持续4 d使大鼠逃避潜伏期保持稳定。第5天和第7天为测试期,测试时撤去平台,记录大鼠60 s内游过原平台所在象限的时间[18]。
1.3.5 组织学鉴定
测试完成后,动物被深度麻醉,断头取脑。固定一周后,作厚度为80 μm的连续冠状面冰冻切片,根据大鼠脑图谱判读插管创道的位置,如果插痕没有到达预期位置,测试结果将被排除在数据统计之外。
1.4 统计学方法

2 结果
2.1 离体脑片细胞外记录
我们在36张海马脑片上记录了56个具有稳定自发放电频率的海马C1区神经元,其自发放电频率范围为1.78~2.86 Hz,平均放电频率为(2.15±0.23) Hz。用含有组胺(3~30 μmol/L)的人工脑脊液灌流脑片,引起75%(42/56)的海马神经元兴奋反应(图1)。所记录到的海马神经元对3、10和30 μmol/L的组胺刺激表现出剂量依赖性的兴奋反应,神经元接受组胺刺激后的自发放电频率峰值分别为2.85、3.25和3.54 Hz,与其接受刺激前的平均基础自发放电频率(2.15 Hz)相比,分别增加了32.6%、51.2%和64.7%。
2.2 在体细胞外记录
我们在本实验中共记录了57个海马C1区神经元,其中38个细胞(66.7%)对同侧下丘脑结节乳头核刺激有反应,均表现为先兴奋后抑制的双向反应,综合表现出抑制效应(图2,n=38,P< 0.05)。如果在海马C1区微量注射组胺H1受体阻断剂triprolidine(1 μmol/L)后电刺激结节乳头核,则海马神经元表现为简单的抑制反应(n=13,P< 0.05);如果注射组胺H3受体阻断剂clobenpropit(1 μmol/L)后电刺激结节乳头核,则海马神经元表现为简单的兴奋反应(n=15,P< 0.05)。
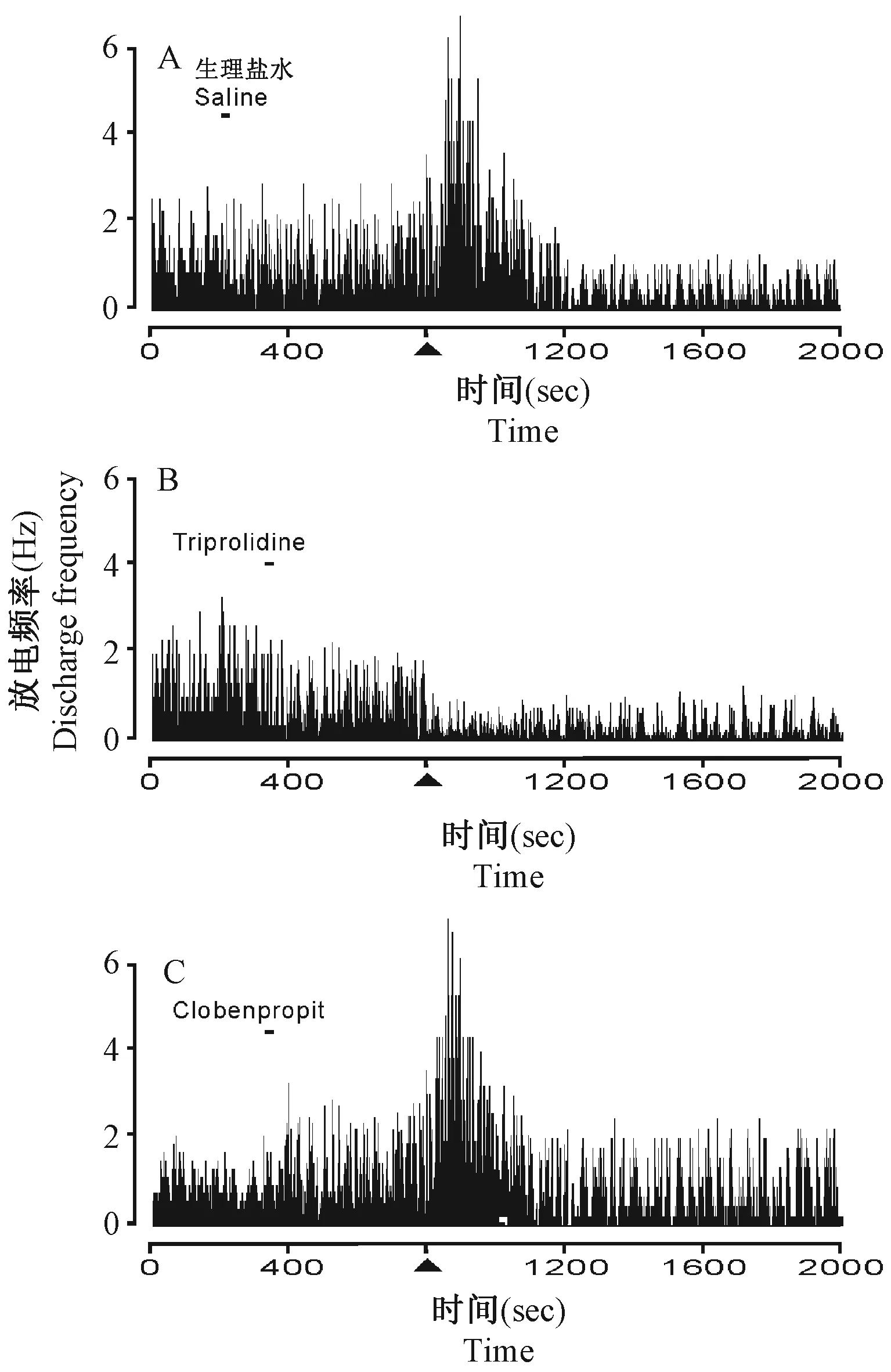
注:A:电刺激下丘脑结节乳头核,海马C1区神经元表现出先兴奋后抑制的双向反应;▲为电刺激时间点。B:在海马C1区注射组胺H1受体阻断剂triprolidine后,再电刺激下丘脑结节乳头核,海马C1区神经元表现出单一的抑制效应。C:在海马C1区注射组胺H3受体阻断剂clobenpropit后,再电刺激下丘脑结节乳头核,海马C1区神经元表现出单一的兴奋效应。图2 在体细胞外记录Note. A: After the hypothalamus TMN was electrically stimulated, neurons in the hippocampal C1 area showed a bidirectional response, an excitatory response followed by an inhibitory response. ▲ represents the time point of electrical stimulation. B: Under electrical stimulation of TMN after injection of histamine H1 receptor antagonist, triprolidine into the hippocampal C1 area, hippocampal neurons only showed an inhibitory response. C: Under electrical stimulation of TMN after injection of histamine H3 receptor antagonist, clobenpropit into the hippocampal C1 area, hippocampal neurons only showed an excitatory response.Fig.2 Extracellular recording in vivo
2.3 行为学实验
行为学实验共分8组,每组15只大鼠。实验结束后断头取脑切片,共有10只大鼠插痕偏离预期位置,这10只大鼠的实验数据被排除在统计数据之外。
2.3.1 旷场实验
旷场实验检测结果代表了大鼠运动欲望,具体数值见表1。水平维度,各组得分通过单因素方差分析显示,F7, 112=0.168,P< 0.05。与对照组相比,注射组胺后得分明显降低,注射H3受体阻断剂clobenpropit后得分显著升高,均P< 0.01。垂直维度,各组得分通过单因素方差分析显示,F7, 112=0.253,P< 0.05。与对照组相比,注射组胺后得分明显降低,而注射H3受体阻断剂clobenpropit后得分显著升高,均P< 0.01。
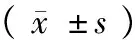
表1 大鼠旷场实验测试成绩
注:与对照组相比,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01.
2.3.2 Morris水迷宫
水迷宫实验检测结果见表2,通过单因素方差分析显示,F7, 102=0.024,P< 0.05。在抑郁症模型大鼠海马C1区注射组胺(n=15)后,逃避潜伏期与对照组相比明显延长,P< 0.01;而注射组胺H3受体阻断剂clobenpropit(n=15)后,逃避潜伏期明显缩短,P< 0.01。
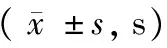
表2 大鼠Morris水迷宫测试期成绩
注:与对照组相比,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01.
3 讨论
海马作为边缘系统重要组成部分,参与调节情绪、学习和记忆等功能,是抑郁症发病机制中被广泛研究的中枢结构之一[9,19-20]。神经系统形态学研究显示,抑郁症患者出现海马体积减小并伴有神经元缺失等退化现象,导致情绪低落并伴随认知记忆能力明显下降[3]。然而,抑郁症患者海马中留存的神经元功能状态如何,基础放电频率有何变化,还未见详细报道。近年来,随着对脑内单胺类递质组胺的深入研究,起源于下丘脑的中枢组胺能神经系统被认为是“全脑功能调节者”,能够调节各脑区神经元基础兴奋性,影响其放电频率[6-7,21]。神经免疫组化研究表明,海马神经元上有大量组胺受体表达[8,22-24],接受组胺能神经纤维的密集支配。因此,机体受到外界应激刺激导致下丘脑兴奋后,可能通过传出神经纤维调节边缘系统海马神经元兴奋程度,进而对机体情绪和认知功能产生影响。
本实验中,离体脑片细胞外记录研究显示,组胺能够以剂量依赖的方式兴奋海马C1区神经元,且能够被组胺H1受体阻断剂triprolidine而不是H2受体阻断剂ranitidine所阻断,提示组胺能够通过H1受体途径兴奋海马C1区神经元。在体细胞外记录研究显示,刺激下丘脑结节乳头核,能够使海马神经元出现先兴奋后抑制的双向反应;C1区注射组胺H1受体阻断剂triprolidine后兴奋效应消失,出现单一的抑制效应;注射组胺H3受体阻断剂clobenpropit后,抑制效应消失,出现单一的兴奋效应。这个结果提示海马C1区组胺突触后H1受体和突触前H3受体同时发挥效应,组胺H1受体兴奋导致海马C1区神经元放电频率提高;而组胺H3受体兴奋能够抑制海马C1区兴奋性递质的释放,使海马神经元放电频率降低;两者的综合效应是海马神经元的放电频率降低。在整体行为学实验中,海马C1区微量注射组胺和H1受体激动剂2-PyEA,都能使抑郁症大鼠运动欲望和空间记忆能力进一步降低,而注射组胺H3受体阻断剂clobenpropit能够使抑郁症大鼠运动欲望及空间记忆能力明显改善。
单胺类神经递质如5-HT、NE等被认为在抑郁症的发生发展过程中起到了重要作用。组胺作为起源于下丘脑的单胺类神经递质,能够对包括边缘系统在内的各个脑区神经元兴奋性进行调节[6-7]。机体受到应激刺激导致下丘脑兴奋,必然会导致传出神经纤维组胺释放的改变,而组胺在抑郁症的发生发展中所起的作用还未见详细报道。本研究发现电刺激下丘脑TMN后,组胺能神经纤维释放组胺增加能够降低海马神经元放电频率,从而使抑郁症模型大鼠运动欲望和空间记忆能力明显降低,而注射clobenpropit阻断H3受体作用途径后,抑郁症模型大鼠运动欲望和空间记忆能力明显改善。由此可见,在抑郁症发生发展过程中,下丘脑兴奋不仅通过HPA轴功能亢进导致脑内皮质醇浓度增高,使海马神经元凋亡缺失;还可以通过中枢组胺能神经系统,使海马神经元放电频率降低,抑制海马神经元功能状态,并导致抑郁症大鼠运动欲望和认知能力的降低。考虑到中枢组胺能神经系统起源于应激反应高级中枢下丘脑,同时组胺能神经纤维广泛支配了包括海马在内的抑郁症发病相关脑区神经元的兴奋性,因此单胺类递质组胺可能在抑郁症的发生发展中发挥了重要作用,应当受到重视。
[1] Otte C, Gold SM, Penninx BW, et al. Major depressive disorder [J]. Nat Rev Dis Primers, 2016, 2: 16065.
[2] Willner P, Mitchell PJ. The validity of animal models of predisposition to depression [J]. Behav Pharmacol, 2002, 13(3): 169-188.
[3] Kim EJ, Pellman B, Kim JJ. Stress effects on the hippocampus: a critical review [J]. Learn Mem, 2015, 22(9): 411-416.
[4] Gotlib IH, Joormann J, Minor KL, et al. HPA axis reactivity: a mechanism underlying the associations among 5-HTTLPR, stress, and depression [J]. Biol Psychiatry, 2008, 63(9): 847-851.
[5] Panula P, Yang HY, Costa E. Histamine-containing neurons in the rat hypothalamus [J]. Proc Natl Acad Sci U S A, 1984, 81(8): 2572-2576.
[6] Haas HL, Sergeeva OA, Selbach O. Histamine in the nervous system [J]. Physiol Rev, 2008, 88(3): 1183-1241.
[7] Zhu JN, Yung WH, Kwok-Chong Chow B, et al. The cerebellar-hypothalamic circuits: potential pathways underlying cerebellar involvement in somatic-visceral integration [J]. Brain Res Rev, 2006, 52(1): 93-106.
[8] Thomas SA. Neuromodulatory signaling in hippocampus-dependent memory retrieval [J]. Hippocampus, 2015, 25(4): 415-431.
[9] Anderson EB, Grossrubatscher I, Frank L. Dynamic hippocampal circuits support learning- and memory-guided behaviors [J]. Cold Spring Harb Symp Quant Biol, 2014, 79: 51-58.
[10] Katz RJ, Roth KA, Carroll BJ. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression [J]. Neurosci Biobehav Rev, 1981, 5(2): 247-251.
[11] 张荣, 董世芬, 倪博然, 等. 白金胶囊对CUMS诱导的抑郁症大鼠模型行为学及脑内单胺类神经递质的影响 [J]. 中国比较医学杂志, 2015, 25(7): 46-52.
[12] Paxinos G, Watson C. The rat brain in stereotaxic coordinates [M]. 6th edition. San Diego: Academic Press, 1998.
[13] He YC, Wu GY, Li D, et al. Histamine promotes rat motor performances by activation of H2receptors in the cerebellar fastigial nucleus [J]. Behav Brain Res, 2012, 228(1): 44-52.
[14] Peng SY, Zhuang QX, He YC, et al. Histamine excites neurons of the inferior vestibular nucleus in rats by activation of H1 and H2 receptors [J]. Neurosci Lett, 2013, 541: 87-92.
[15] Li B, Zhuang QX, Gao HR, et al. Medial cerebellar nucleus projects to feeding-related neurons in the ventromedial hypothalamic nucleus in rats [J]. Brain Struct Funct, 2017, 222(2): 957-971.
[16] Song YN, Li HZ, Zhu JN, et al. Histamine improves rat rota-rod and balance beam performances through H2receptors in the cerebellar interpositus nucleus [J]. Neuroscience, 2006, 140(1): 33-43.
[17] 孟盼, 朱青, 张秀丽, 等. 海马内微量注射K252a对大鼠行为学及抑郁样经典指标的影响 [J]. 中国比较医学杂志, 2017, 27(4): 26-33.
[18] Rice JP, Wallace DG, Hamilton DA. Lesions of the hippocampus or dorsolateral striatum disrupt distinct aspects of spatial navigation strategies based on proximal and distal information in a cued variant of the Morris water task [J]. Behav Brain Res, 2015, 289: 105-117.
[19] Lazarov O, Hollands C. Hippocampal neurogenesis: learning to remember [J]. Prog Neurobiol, 2016, 138-140: 1-18.
[20] Rozov AV, Valiullina FF, Bolshakov AP. Mechanisms of long-term plasticity of hippocampal GABAergic synapses [J]. Biochemistry (Mosc), 2017, 82(3): 257-263.
[21] Cataldi M, Borriello F, Granata F, et al. Histamine receptors and antihistamines: from discovery to clinical applications [J]. Chem Immunol Allergy, 2014, 100: 214-226.
[22] Chang RS, Tran VT, Snyder SH. Heterogeneity of histamine H1-receptors: species variations in [3H]mepyramine binding of brain membranes [J]. J Neurochem, 1979, 32(6): 1653-1663.
[23] Diewald L, Heimrich B, Büsselberg D, et al. Histaminergic system in co-cultures of hippocampus and posterior hypothalamus: a morphological and electrophysiological study in the rat [J]. Eur J Neurosci, 1997, 9(11): 2406-2413.
[24] Lozeva V, Tarhanen J, Attila M, et al. Brain histamine and histamine H3receptors following repeatedL-histidineadministration in rats [J]. Life Sci, 2003, 73(12): 1491-1503.

