环磷酰胺诱导家兔卵巢早衰动物模型的建立和评价
张 娟,周月希,3,刁 波,王 刚,岳钊平,解 迪,王 晶,王立群,3
(1.中国人民解放军武汉总医院妇产科,武汉 430070; 2.中国人民解放军武汉总医院医学实验科,武汉 430070; 3.湖北中医药大学临床医学院,武汉 430065)
卵巢早衰(premature ovarian failure,POF)是指发生在40岁以前女性卵巢功能衰竭,主要表现为无排卵、雌激素缺乏和原发性或继发性闭经、不孕不育、性类固醇的缺乏和促性腺激素升高。目前常见的卵巢早衰模型有化疗药物模型、自身免疫性疾病模型、半乳糖血症模型和基因模型。其中半乳糖血症模型和基因模型较为局限,不能很好的解释卵巢早衰的发病机制,且基因缺失和半乳糖血症在临床上发病率较低,不具有代表性[1]。化疗药物模型是研究卵巢早衰的经典模型。随着肿瘤在青年人中发病率升高[2-3],化疗在临床上应用广泛,化疗引发青年女性卵巢早衰的问题日益突出[4]。研究化疗引起的卵巢早衰对临床肿瘤治疗的副反应研究具有重要意义。环磷酰胺是临床常用的化疗药物,价格低廉,有研究显示[5],环磷酰胺(cyclophosphamide,CTX)具有明显的生殖毒性,可以损伤卵泡内的颗粒细胞,引起卵巢早衰。本研究选取临床上常用的化疗药物环磷酰胺,建立并评价不同注药方式下的环磷酰胺诱导家兔卵巢早衰模型,探索制备家兔卵巢早衰的最佳剂量,为进一步研究卵巢早衰的治疗提供依据。
1 材料和方法
1.1 实验动物
普通级雌性未交配日本大耳兔21只,5月龄,体重2.5~3 kg,由武汉市万千佳兴生物科技有限公司提供 [SCXK (鄂) 2016-0011]。饲养于中国人民解放军武汉总医院医学实验中心 [SYXK (鄂) 2014-0082],温度控制在(22±2) ℃,相对湿度50%~60%,自由饮食,每天光照时间12 h。所有实验操作均在该院医学实验中心进行,严格遵守实验中心的规范要求,并得到动物伦理委员会的许可(编号:2016020)。
1.2 主要试剂与仪器
注射用环磷酰胺(CTX,德国Baxter Oncology GmbH生产),注册证号H20110407,规格200 mg/瓶;TUNEL凋亡检测试剂盒(武汉博士德生物公司,产品编号:MK1020);兔雌二醇酶联免疫检测试剂盒(天津安诺瑞康生物公司,产品编号:TAE-267r)。多聚甲醛、戊巴比妥钠等试剂均购自武汉拜意尔生物有限公司;采血管、采血针、离心管等购自武汉华联科生物有限公司。
PL303型电子天平(梅特勒-托利多仪器有限公司),L600型离心机(湘仪仪器厂),RM2016型轮转式切片机(上海徕卡仪器有限公司),BX51型奥林巴斯荧光显微镜,YD-6L生物组织包埋机(金华市益迪医疗设备有限公司)。
1.3 实验方法
1.3.1 实验分组与造模
临床上使用CTX分为大剂量冲击治疗和持续治疗,本实验仿照临床用药制定用药剂量和用药方式,采用随机数表法将家兔分为四组。正常对照组不作任何处理(A组),模型一组50 mg/kg CTX腹腔注射1 d(B组),模型二组50 mg/kg注射2 d(C组),模型三组首日注射50 mg/kg,以后按照8 mg/kg连续注射14 d(D组)。如表1所示。
1.3.2 一般情况观察
观察家兔活动情况、采食多少、二便及兔毛脱落情况。
1.3.3 体重变化与卵巢指数

表1 分组及造模方案
自注射CTX开始,对每组家兔连续称重14 d并记录分析体重变化。观察周期结束后,3%戊巴比妥钠耳缘静脉麻醉,取家兔双侧卵巢。生理盐水清洗血迹,剥离多余脂肪组织后,用电子天平称取卵巢湿重并记录。
卵巢指数=卵巢湿重(g)/体重(kg)× 100%
1.3.4 卵巢组织形态观察与卵泡计数
4%多聚甲醛溶液固定卵巢组织24 h,经脱水、透明后石蜡包埋,5 μm切片,每隔20 μm取一张,每个组织取3张切片,常规HE染色后,每张切片随机取5个视野,观察卵巢的组织学变化及各级卵泡个数,卵泡计数方法参照Myers[6]卵泡计数法。分别记录各级卵泡个数,异常情况。将形态不规则,颗粒细胞排列紊乱,核深染、固缩的卵泡计为异常卵泡。
1.3.5 细胞凋亡检测
TUNEL法观察卵巢各类细胞凋亡情况。各组卵巢组织石蜡切片经脱蜡,5 μm切片,每隔20 μm取一张,每个组织取3张切片,蛋白酶K消化,加标记缓冲液、TBS洗后加封闭液,加入稀释后的生物素化地高辛抗体、SABC,经DAB显色,苏木素轻度复染后封片观察,每张切片随机取5个视野,用Image-Pro Plus 6.0软件计算各组卵巢颗粒细胞凋亡率。
1.3.6 血清雌二醇检测
自注射开始前一天记为第0天,注射当天记为第1天,以此类推。分别于第0、7、14、21、28、35天在家兔耳缘静脉采血2 mL,静置10 min待血完全凝固,于离心机3000 r/min离心10 min后取上清,-80℃冰箱内保存待测血清。血清收集完整后,酶联免疫吸附法检测家兔血清雌二醇(estradiol,E2)的含量。
1.4 统计学方法

2 结果
2.1 各组家兔一般情况比较
B组注射CTX后第4~5天后出现少量脱毛,进食活动等无明显变化,1只于注射第14天死亡;C组注射CTX第2天开始明显脱毛,进食减少,2只于第11、13天死亡;D组家兔自注射第3天,出现不同程度脱毛、进食减少,活动反应降低,其中5只家兔分别于注射CTX后第6、7、9、13、16天死亡。由于D组死亡率太高,部分结果不纳入统计。
2.2 各组体重和卵巢指数比较
注射第0~8天各组家兔体重差异无显著性(P> 0.05)。注射第9天开始D组体重明显下降,差异有显著性(P< 0.05)。B、C组与A组相比,体重无明显变化(P> 0.05)。卵巢指数:B组与A组相比,卵巢指数明显小于A组,差异有显著性(P< 0.05);C组与A组相比,差异无显著性(P> 0.05)。见图1、表2。
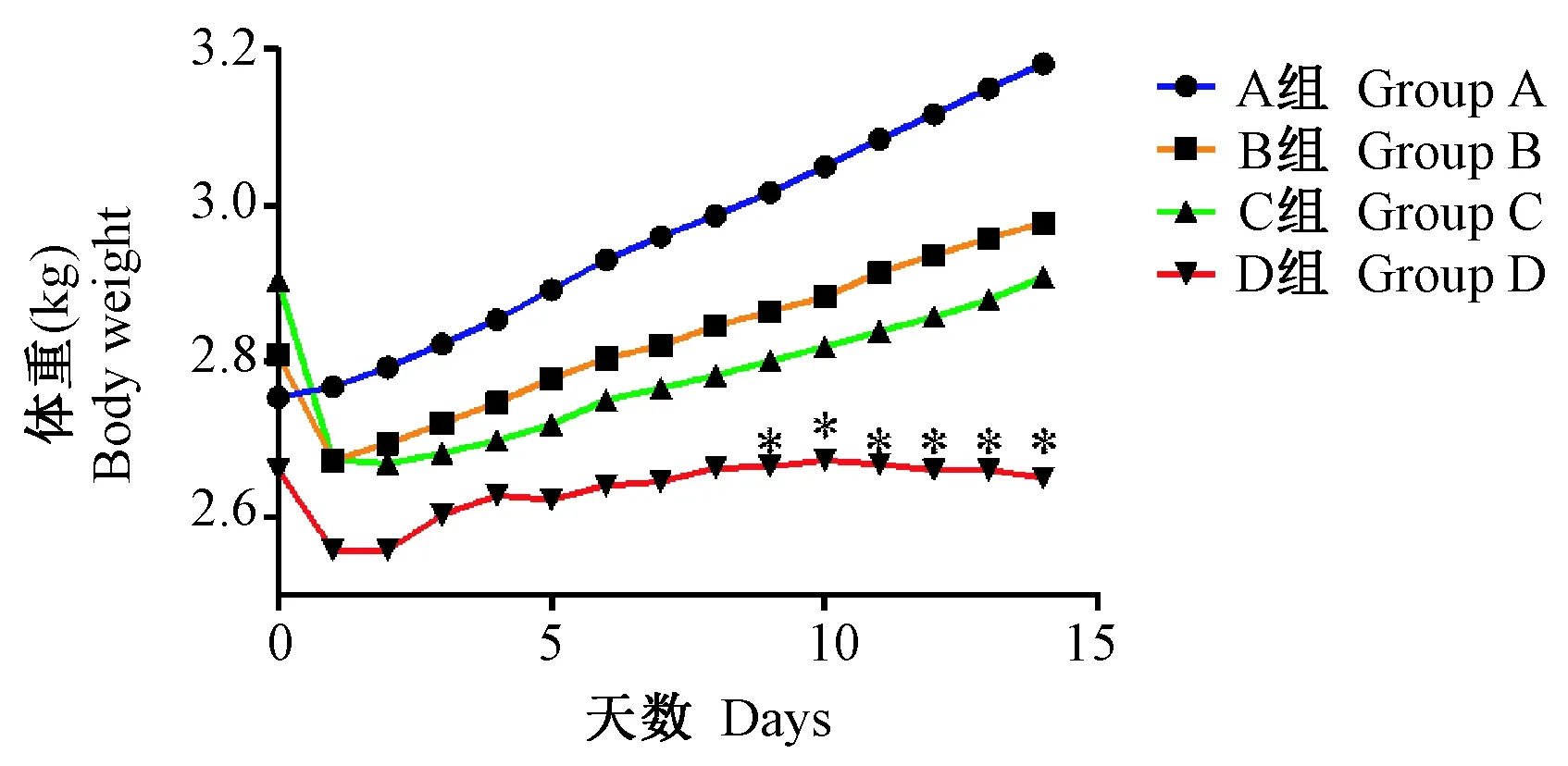
注:与A组相比,* P< 0.05。图1 注射CTX 14 d之内体重变化比较Note. Compared with group A,* P < 0.05.Fig.1 Comparison of body weight changes during 14 days in each group

组别Groups家兔数量Numberofrabbits卵巢指数OvaryindexA组GroupA301164±0.01547B组GroupB501099±0.03142C组GroupC4008165±0.02518∗
注:与A组相比,*P< 0.05。
Note. Compared with the group A,*P< 0.05.
2.3 卵巢组织形态观察
A组卵泡数量多,可见大量原始、初级卵泡,闭锁卵泡较少,各级卵泡颗粒细胞层排列规则。B组原始卵泡数量少,闭锁卵泡多,各级卵泡颗粒细胞层见不同程度紊乱、核固缩。卵巢间质纤维化。C组原始卵泡数量极少,形态模糊,初级及次级卵泡颗粒层排列紊乱,部分卵泡及卵细胞核形态异常,见大量闭锁卵泡,窦状卵泡形状不规则,卵巢间质疏松、纤维化较重。见图2。
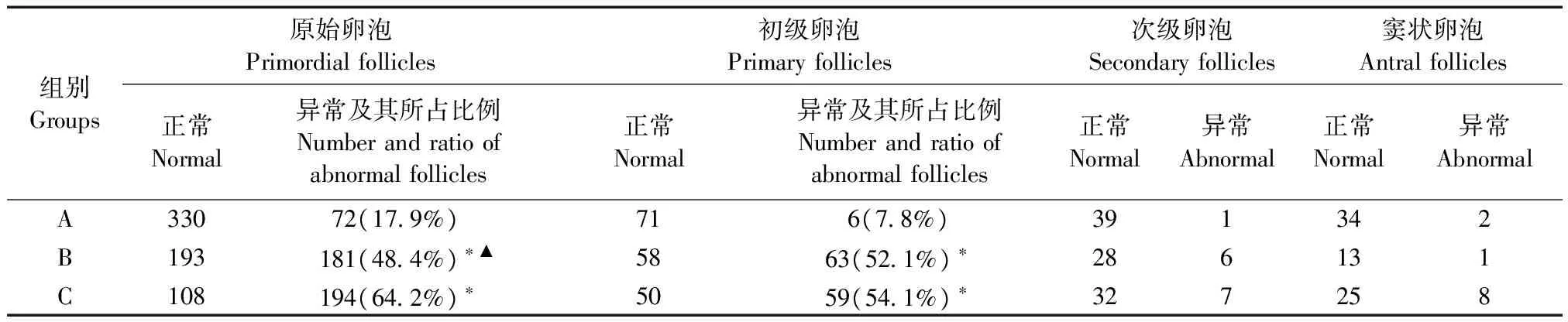
表3 各组家兔卵泡数量比较
注:与A组比较,*P< 0.017;与C组比较,▲P< 0.017。
Note. Compared with the group A,*P< 0.017. Compared with the group C,▲P< 0.017.
2.4 卵泡计数
B组、C组原始卵泡、初级卵泡异常数量与A组比较均明显增多,差异有显著性(P< 0.017);B组与C组比较,C组原始卵泡异常数增多明显,差异有显著性(P< 0.017),而两组初级卵泡异常数量差异无显著性(P> 0.017);三组相比,次级、窦状卵泡异常数比较差异无显著性(P> 0.05)。各组家兔卵泡数量比较见表3。
2.5 细胞凋亡检测
通过观察卵巢中细胞的凋亡情况判断环磷酰胺对卵巢的破坏情况。凋亡细胞内有清晰的褐色或棕黄色,主要表现在卵母细胞、颗粒细胞和间质细胞的细胞核上。B组、C组组织切片染色均见明显的褐色或棕黄色颗粒;A组组织切片与背景色一致,未见或极少见棕黄色颗粒沉着。
模型组中的凋亡细胞数量明显增多,而且大部分都是成熟卵泡周边及内部的颗粒细胞。凋亡率统计:B组与C组中成熟卵泡内及卵泡周围见凋亡颗粒细胞。B组、C组与A组比较,差异有显著性(P< 0.05);C组与B组比较,C组凋亡率高于B组,差异有显著性(P< 0.05)。见图3、表4。
2.6 血清E2检测
各组血清E2变化如图4所示。A组血清E2值呈周期变化趋势。B组第7天E2分泌达高峰,第7天后逐渐下降,E2分泌量第7天与第35天比较,经t检验,t=4.634,P< 0.05;C组E2值持续下降,第0天与第35天比较,t=5.337,P< 0.05。
3 讨论
卵巢早衰是女性不孕的原因之一,患者表现为月经稀发或闭经、卵泡发育不良、雌激素水平低下、不孕等。近年来,因肿瘤和自身免疫疾病的发病率升高,化疗药物在临床上应用广泛,有研究表明,化疗药物是导致卵巢早衰的重要原因[4]。环磷酰胺是临床常用的烷化剂类化疗药物,卵巢对其非常敏感,大量研究结果显示环磷酰胺能够引起卵巢形态学改变,降低卵泡数量,损伤颗粒细胞,降低雌激素水平,进而引起卵巢早衰[7-9]。卵巢早衰患者常伴有月经紊乱或闭经,生育力低下,甚者抑郁、焦虑、失眠,严重影响患者的身心健康,不利于家庭稳定,影响社会和谐。本实验中使用环磷酰胺注射后的家兔,卵泡发育受限甚至畸形,雌激素低下,这与临床上卵巢早衰的表现相似,但未验证其生育力是否下降。
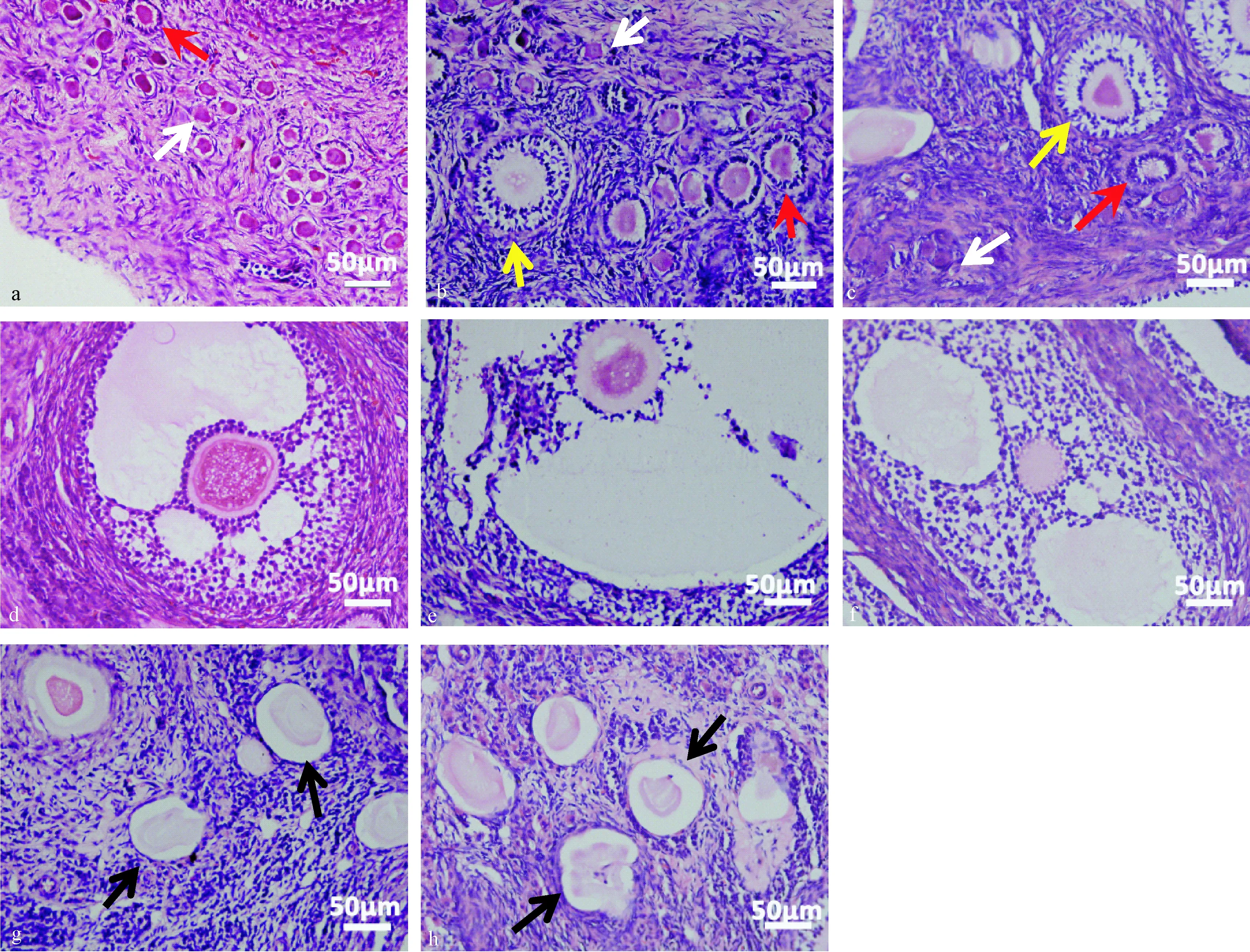
注:白色箭头示原始卵泡,红色箭头示初级卵泡,黄色箭头示次级卵泡,黑色箭头示闭锁卵泡。(a):A组原始卵泡、初级卵泡;(b):B组原始、初级、次级卵泡;(c):C组原始、初级、次级卵泡;(d):A组窦状卵泡;(e):B组窦状卵泡;(f):C组窦状卵泡;(g):B组闭锁卵泡;(h):C组闭锁卵泡。图2 各组卵巢情况(HE染色,× 400)Note. White arrows indicate primordial follicles. Red arrows indicate primary follicles. Yellow arrows indicate secondary follicles. Black arrows indicate atretic follicles. Bar=50 μm. (a): Primordial and primary follicles in group A. (b): Primordial, primary and secondary follicles in group B. (c): Primordial, primary and secondary follicles in group C. (d): Antral follicles in group A. (e): Antral follicles in group B. (f): Antral follicles in group C. (g): Atretic follicles in group B. (h): Atretic follicles in group C.Fig.2 Histology of the rabbit ovaries in groups A, B and C. HE staining
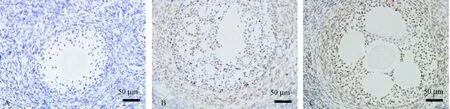
注:A:A组部分颗粒细胞;B:B组部分颗粒细胞;C:C组部分颗粒细胞。图3 各组颗粒细胞凋亡检测结果(TUNEL,× 400)Note. A: Some of the granular cells in group A. B: Some of the granular cells in group B. C: Some of the granular cells in group C. Bar=50 μm.Fig.3 Apoptosis in granular cells in groups A, B and C. TUNEL staining

分组Groups家兔数量Numberofrabbits凋亡率ApoptosisrateA3418±09B51130±231∗C42476±152∗▲
注:与A组比较,*P< 0.05;与B组比较,▲P< 0.05。
Note. Compared with the group A,*P< 0.05. Compared with the group B,▲P< 0.05.
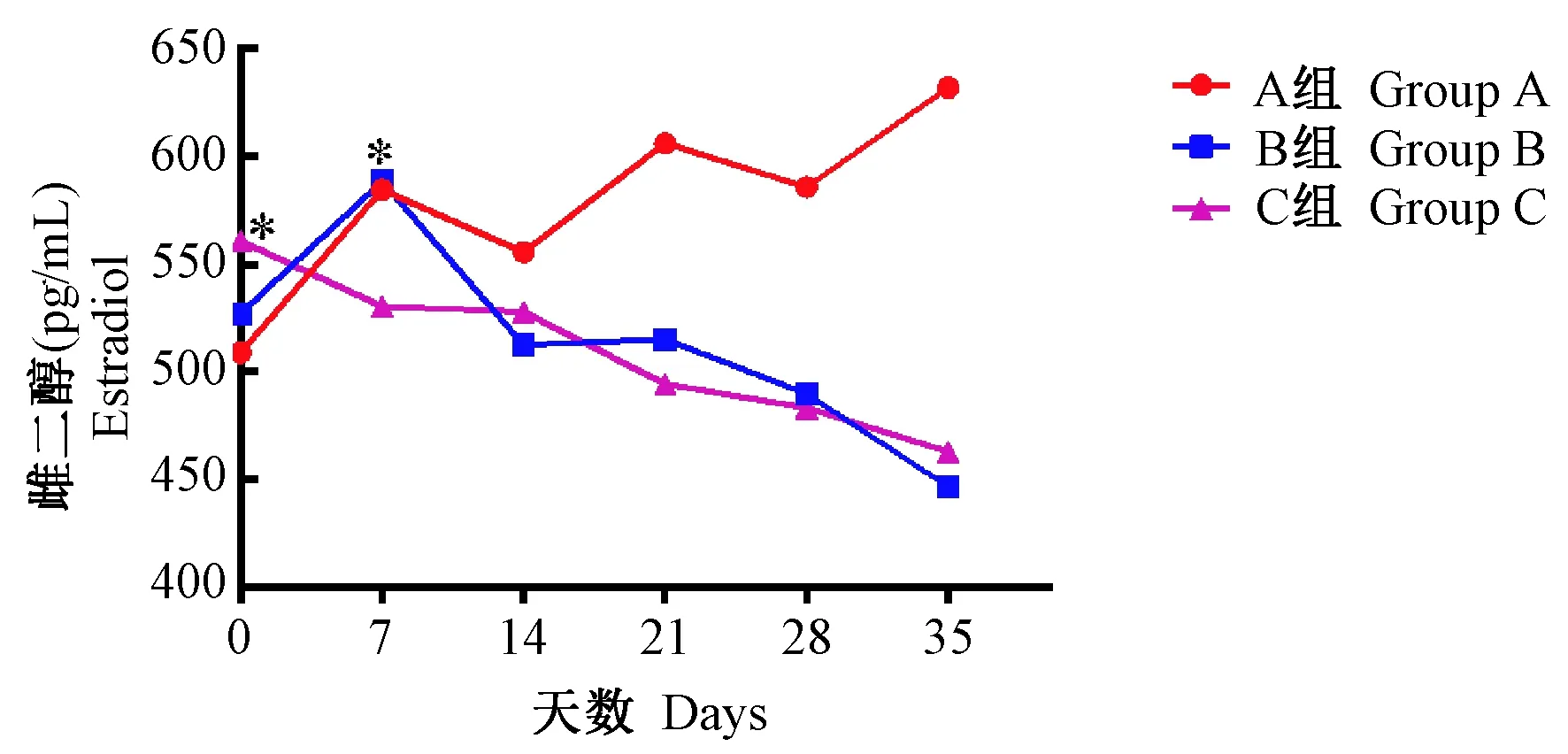
注:与第35天相比,* P< 0.05。图4 各组血清E2值变化图Note. Compared with the 35th day,* P < 0.05.Fig.4 Changes in serum levels of estradiol in groups A, B and C during 35 days
B组注射CTX后进食活动等无明显变化,死亡率16.7%;C组进食活动减少,死亡率33.3%。D组进食活动明显降低,死亡率83.3%。D组家兔体重明显下降,而B、C组体重无明显变化。结合药物致死率和体重变化来看,长时间注射CTX可能造成家兔多器官衰竭,限制家兔生长发育,死亡率高,表明D组注药方式不适合造模。通过对各组卵巢切片的观察,CTX对各级卵泡均有破坏,其中原始卵泡破坏最明显,这与Plowchalk等[9]和Meirow等[10]的研究结果一致。B、C组卵巢均见不同程度的损伤,但C组卵巢损伤更重,表现为大量原始卵泡被破坏且排列不规则,异常卵泡数量多,伴大量闭锁卵泡;卵母细胞核固缩,颗粒细胞层排列紊乱,卵巢间质疏松;见大量凋亡细胞。C组卵巢指数明显小于A组,而B组卵巢指数差异无显著性,说明B组注药方式对卵巢破坏较轻。B组在注射CTX 7天后血清E2达高峰,第7天后整体呈现下降趋势,但在第21天出现小幅度增高,可能由于B组剂量所致卵巢损伤是可逆的,不能彻底破坏卵巢功能;C组E2值持续下降,在注射CTX后第35天降至最低,比较接近临床上卵巢早衰患者低雌激素表现;综合评估,B、C组注药方式均对卵巢造成损伤,但C组在形态学和生化指标上更符合临床上卵巢早衰指征,即50 mg/kg CTX × 2 d是建立家兔卵巢早衰模型的最佳剂量。
大多研究选用鼠类作为实验动物建立卵巢早衰模型,本课题选用家兔作为实验动物,其原始卵泡卵母细胞的大小与人类接近,卵巢组织中卵泡数量丰富,更便于观察CTX对卵巢的作用。与鼠类相比,家兔重复采血比较方便,可以尽量避免杀害动物,符合动物伦理学的要求。有研究显示,GnRH类似物、雌激素等有治疗卵巢早衰的作用[11-12],本实验在注射CTX前不对家兔进行任何药物处理,观察在自然状态下,家兔接受CTX注射后的病理变化,这一处理与临床更加接近。
[1] 成杰, 丁利军, 胡娅莉. 卵巢早衰动物模型制备研究进展 [J]. 中国比较医学杂志, 2013, 23(4): 66-70.
[2] Printz C. Colorectal cancer incidence increasing in young adults [J]. Cancer, 2015, 121(12): 1912-1913.
[3] Balmant NV, de Souza Reis R, Pinto Oliveira JF, et al. Cancer incidence among adolescents and young adults (15 to 29 years) in Brazil [J]. J Pediatr Hematol Oncol, 2016, 38(3): e88-e96.
[4] Kreuser ED, Hetzel WD, Billia DO, et al. Gonadal toxicity following cancer therapy in adults: significance, diagnosis, prevention and treatment [J]. 1990, 17(2-3): 169-175.
[5] Wetzels JF. Cyclophosphamide-induced gonadal toxicity: a treatment dilemma in patients with lupus nephritis? [J]. Neth J Med, 2004, 62(10): 347-352.
[6] Myers M, Britt KL, Wreford NG, et al. Methods for quantifying follicular numbers within the mouse ovary [J]. Reproduction, 2004, 127(5): 569-580.
[7] Narimoto K, Okamura H, Mori T, et al. Enzyme cytochemical and morphometrical analyses of gap junctions in rabbit ovarian granulosa cells during follicle maturation and ovulatory process [J]. Acta Histochem Cytochem, 1985, 18(6): 565-579.
[8] Ataya KM, Valeriote FA, Ramahi-Ataya AJ. Effect of cyclophosphamide on the immature rat ovary [J]. Cancer Res, 1989, 49(7): 1660-1664.
[9] Plowchalk DR, Mattison DR. Reproductive toxicity of cyclophosphamide in the C57BL/6N mouse: 1. Effects on ovarian structure and function [J]. Reprod Toxicol, 1992, 6(5): 411-421.
[10] Meirow D, Lewis H, Nugent D, et al. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool [J]. 1999, 14(7): 1903-1907.
[11] Somers EC, Marder W, Christman GM, et al. Use of a gonadotropin-releasing hormone analog for protection against premature ovarian failure during cyclophosphamide therapy in women with severe lupus [J]. Arthritis Rheum, 2005, 52(9): 2761-2767.
[12] Blumenfeld Z, Avivi I, Eckman A, et al. Gonadotropin-releasing hormone agonist decreases chemotherapy-induced gonadotoxicity and premature ovarian failure in young female patients with Hodgkin lymphoma [J]. Fertil Steril, 2008, 89(1): 166-173.

