Tempol对心肌肥厚大鼠NF-κB信号通路的影响
刘捡娣,谢 龙,肖 坤,朱金海,谢东明*
(1.赣南医学院2015级硕士研究生,江西 赣州 341000; 2.赣南医学院2016级硕士研究生,江西 赣州 341000; 3.赣南医学院第一附属医院心内科,江西 赣州 341000)
心肌肥厚(myocardial hypertrophy,MH)是心肌组织压力超负荷的一种代偿性反应,以心肌细胞蛋白质合成增加、心肌细胞体积增大及间质成分改变为主要特征,是引起多种心血管疾病发病率和病死率升高的独立危险因素之一[1-2]。近年来有研究表明,心肌肥厚的发生发展过程与氧化应激有着密切的联系[3-4],其中氧化应激产生的活性氧簇(reactive oxygen species,ROS)对心肌肥厚的氧化作用的致病机制较受认可。ROS介导的NF-κB信号通路激活,通过转录因子NF-κB进入核内调控基因表达,参与心肌肥厚的病理过程[5]。氮氧自由基(nitroxide radicals,NRs)是含有C、N、O和自旋单电子的有机化合物,早期被用作阐明细胞膜结构和功能的自旋示踪剂[6]。NRs可以通过清除体内的ROS来减轻氧化应激反应所致的损伤,改善心肌肥大症状[7-8]。氮氧自由基化合物2, 2, 6, 6-四甲基-4-哌啶醇(tempol)为传统的氧自由基清除剂,可清除过多ROS[9]。NRs具有广阔的临床应用前景,但目前实验室与临床上对NRs对抗氧化作用的研究甚少,而对肥厚型心肌病NF-κB信号通路的影响研究尚无。本研究采用异丙肾上腺素(isoprenaline,ISO)建立大鼠心肌肥厚模型,旨在研究氮氧自由基tempol对心肌肥厚、相关炎症因子及NF-κB信号通路的作用。
1 材料和方法
1.1 实验动物
SPF级SD雄性大鼠,180~220 g,购自赣南医学院实验动物中心 [SCXK (赣) 2014-0001],饲养于赣南医学院实验动物中心,大鼠的组织取材于赣南医学院实验动物中心动物实验设施内进行 [SYXK (赣) 2014-0001]。
1.2 主要试剂与仪器
主要试剂:2,2,6,6-四甲基-4-哌啶醇(tempol)(货号:176141-5G)、异丙肾上腺素(货号:I5627-5G)购于美国Sigma公司,苏木素伊红染色液(货号:DH0006-100)、TRIzol(货号:NR0002)购于北京雷根生物技术有限公司,cDNA逆转录试剂盒(货号:KR106)、SuperReal荧光定量预混试剂增强版试剂盒(货号:FP205)购于北京天根生化科技有限公司,RIPA裂解液I、BCA蛋白定量测定试剂盒、p65一抗(货号:10745-1-AP)、IκBα一抗(货号:10268-1-AP)购于Proteintech公司,p-p65一抗(货号:D155097)、β-actin一抗(货号:D110001)购于上海生工生物股份有限公司,辣根酶标记山羊抗兔IgG (H + L)(货号:ZB-2301)购于北京中杉金桥生物技术有限公司,ECL Plus超敏发光液(货号:PE0010)购于北京索莱宝科技有限公司。
主要仪器:小型高速离心机(Eppendorf,德国);冷冻冷藏两用冰箱(Siemens,德国);-80℃超低温冰箱(Thermo Fisher,美国);MK3型酶标仪(Thermo Fisher,美国);Bio-Rad ChemiDoc XRS+化学发光成像系统(Bio-Rad,美国);ABI 7500实时荧光定量PCR仪(ABI,美国);转膜仪(百晶生物,北京);电泳仪(百晶生物,北京)。
1.3 实验方法
1.3.1 实验动物分组及造模
将42只SD雄性大鼠随机分为3组,每组14只,分别为正常对照组,心肌肥厚模型组,tempol干预组。各组(除正常组)大鼠腹腔注射异丙肾上腺素5 mg/kg,每日2次,连续2周;正常组大鼠腹腔注射等剂量生理盐水,自由进食、给水。于造模完成24 h后,tempol干预组开始给予腹腔注射tempol 100 mg/(kg·d);心肌肥厚模型组与正常对照组予以腹腔注射等剂量生理盐水,连续8周。本试验由赣南医学院实验动物伦理委员会批准,批准号为:IACUC-2014-018。
1.3.2 各项指标检测
(1)心脏重量指数的测定:大鼠末次给药后禁食12 h,称重(body weight,BW),采用腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,腹主动脉取血完毕后,取心脏,剪去心脏周围的组织和血管,生理盐水清洗残血,滤纸吸干后称量全心重(heart weight,HW),沿冠状沟将左、右心房剪下,沿室间沟将右心室游离去除称量左心室重量(left ventricular weight(LVW),计算全心重量指数(heart weight index,HWI):HWI=HW/BW和左心室重量指数(left ventricular weight index,LVWI):LVWI=LVW/BW。
(2)心肌细胞形态学及纤维化程度检测:取大鼠左心室心肌组织置于4%多聚甲醛中固定24 h以上,经脱水、透明、浸蜡、包埋后用切片机按4 μm厚度切片,按HE染色试剂盒说明书行HE染色,按Masson染色试剂盒说明书行Masson染色,200倍光学显微镜下观察心肌组织形态并拍照。
(3)qRT-PCR检测心肌组织中TNF-α、IL-6 mRNA的表达:按照TRIzol产品说明书流程,提取各组样本2 μg RNA后,测RNA浓度及纯度。设计目的基因上下游引物(表1),根据cDNA逆转录试剂盒说明,首先合成单链cDNA(20 μL体系),按照SuperReal荧光定量预混试剂增强版试剂盒说明,向对应反应孔加入2× SuperReal PreMix Plus (with SYBR Green I) 10 μL、正向引物(10 μmol/L)0.6 μL、反向引物(10 μmol/L)0.6 μL、cDNA模板2 μL、50× ROX Reference Dye 0.4 μL,加RNase-free ddH2O至20 μL。反应条件:第一步预变性:95℃,15 min,1个循环;第二步PCR反应:95℃变性10 s,60℃退火/延伸60 s,共40个循环。TNF-α、IL-6、β-actin引物由上海生工生物股份有限公司设计(参见表1)。每次扩增设置β-actin基因为内参照,用ABI 7500实时荧光定量PCR仪自带软件进行结果分析。
(4)Western blot检测心肌组织IκBα、p-p65、p65蛋白的表达水平:冰上剪碎心肌组织,按说明加入RIPA裂解液I(每100 g组织加入RIPA液1 mL、蛋白酶抑制剂1 μL、磷酸酶抑制剂5 μL)并匀浆,4℃放置10 min,期间剧烈震荡3~4次,12 000 r/min,4℃离心5 min,取上清。BCA法检测蛋白质浓度,并分装50 μg心肌组织蛋白样本。行10% SDS-PAGE分离胶电泳,之后湿法转到PVDF膜上(Millipore,美国)。Western blot BSA封闭液体(1× PBS)于水平摇床室温封闭1 h,分别孵以IκBα一抗(1∶2500稀释)、p-p65一抗(1∶1000稀释)、p65一抗(1∶2500稀释)、β-actin一抗(1∶2500稀释),4℃摇床过夜。次晨1× TBST洗膜10 min,重复3次后加入二抗(1∶20 000稀释),37℃孵育1 h。1× TBST洗膜10 min,重复3次,ECL显影,保存图像,用Image Lab 5.1软件计算蛋白条带面积,结果以目的蛋白/内参吸光度的比值表示。β-actin作为内参使用。各组实验重复3次。
1.4 统计学方法
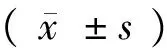

表1 qRT-PCR引物序列
2 结果
2.1 心脏重量指数结果
与正常对照组比较,模型组的HWI、LVWI增加(P< 0.05);与模型组比较,tempol组HWI、LVWI减小(P< 0.05)。结果参见表2。
2.2 心肌组织HE染色结果
镜下观察结果显示,与正常对照组比较,模型组大鼠心肌组织肌纤维增粗、心肌结构紊乱、心肌细胞横截面积增大,胞核深染;与模型组比较,tempol组心肌结构紊乱、心肌细胞肥大程度降低。见图1。
2.3 心肌组织Masson染色结果
镜下观察结果显示,正常对照组多为红色为主的心肌纤维及蓝色的细胞核,心肌间质仅见少许淡蓝色的胶原纤维;与正常对照组相比,心肌肥厚模型组大鼠心肌纤维化加重,心肌间质胶原纤维增加;与模型组相比,tempol组心肌纤维化程度改善,间质胶原纤维减少。见图2。
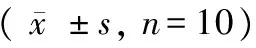
表2 各实验组心脏重量指数结果
注:与正常对照组相比,*P< 0.05;与模型组相比,#P< 0.05。
Note. Compared with the normal control group,*P< 0.05. Compared with the model group,#P< 0.05.
2.4 心肌组织TNF-α、IL-6 mRNA转录水平
与正常对照组比较,模型组TNF-α、IL-6 mRNA的转录水平明显增加(P< 0.05);与模型组比较,tempol组TNF-α、IL-6 mRNA的转录水平降低,差异有显著性(P< 0.05)。结果参见表3。
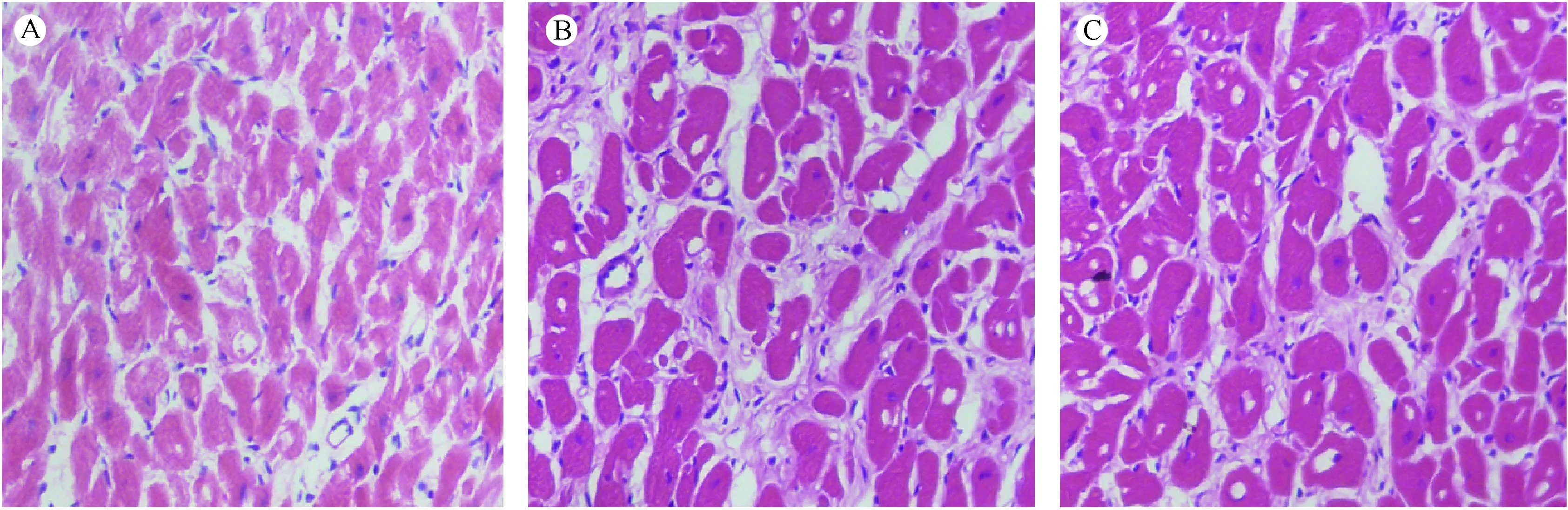
注:A:正常对照组;B:Tempol组;C:模型组。图1 各实验组心肌组织HE染色结果(× 200)Note. A: Normal control group; B: Tempol group; C: Model group.Fig.1 Myocardial tissues of the rats in each group. HE staining

注:A:正常对照组;B:Tempol组;C:模型组。图2 各实验组心肌组织Masson染色结果(× 200)Note. A: Normal control group; B: Tempol group; C: Model group.Fig.2 Myocardial tissues of the rats in each group. Masson staining
2.5 心肌组织IκBα、p-p65、p65蛋白的表达水平
与正常对照组比较,模型组p-p65/p65的表达明显增加,NF-κB抑制蛋白IκBα表达降低(P< 0.05);与模型组比较,tempol组IκBα表达增加,p-p65/p65的表达有不同程度降低(P< 0.05)。见图3。
3 讨论
心肌肥厚(myocardial hypertrophy,MH)是心肌组织压力超负荷的一种代偿性反应,心肌肥厚发生过程伴随心肌重构,其主要病理变化包括心肌细胞肥大、心肌间质增殖以及心肌细胞外基质重建等;而长期的心肌病理性肥厚可引起心脏舒张和收缩功能不全,最终导致心肌缺血、心律失常、心衰和猝死等[11-13]。心肌肥厚的发生机制与多种因素相关,心肌细胞对多种刺激因素所产生的适应性反应,其病理过程复杂。因此如何有效的防治心肌细胞肥厚、心脏病理性重构是心血管科学研究的重要课题,深入探索心肌病理性重构的发生机制及寻找有效的治疗靶点对防治心肌肥厚意义重大。
研究发现,NF-κB信号通路在心肌细胞的病理变化及心室重构中作用很大[14-17]。NF-κB是广泛存在于细胞内的一种具有多向性调节作用的转录因子,最常见的NF-κB二聚体是p65与p50组成的异二聚体。在静息状态下,NF-κB的抑制蛋白IκB蛋白家族之一IκBα与NF-κB的p65、p50两个亚单位以失活状态存在于细胞质中。促炎性或促氧化物直接刺激机体产生活性氧(reactive oxygen species,ROS),改变细胞内的氧化还原状态,IκB激酶(IκB kinase,IKK)被激活,从而导致IκB蛋白磷酸化、泛素化,随后被蛋白酶体降解,NF-κB二聚体得到释放并迅速移位到细胞核诱导相关基因转录,导致组织损伤,参与多种心血管疾病的病理过程[14, 18]。近年来研究发现一些氮氧自由基(nitroxide radicals,NRs)等抗氧化剂可以通过清除过量产生的ROS,抑制脂质过氧化,维持机体抗氧化酶系正常活性,从而减轻氧化应激对实验动物的病理损害,有效地预防和逆转肥厚反应,为临床防治心肌肥厚开辟新的思路和方法[19-20]。NRs具有广阔的临床应用前景。
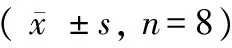
表3 各实验组心肌组织TNF-α、IL-6 mRNA转录水平
注:与正常对照组相比,*P< 0.05;与模型组相比,#P< 0.05。
Note. Compared with the normal control group,*P< 0.05. Compared with the model group,#P< 0.05.
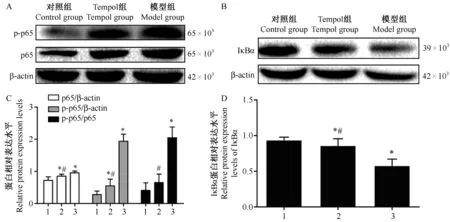
注:A:各组p-p65、p65蛋白Western blot结果;B:各组IκBα蛋白Western blot结果;C:p65、p-p65、p-p65/p65蛋白半定量统计图,n=9;D:IκBα蛋白半定量统计图,n=9。1:对照组;2:Tempol组;3:模型组。与对照组相比,*P< 0.05;与模型组相比,#P< 0.05。图3 心肌组织IκBα、p-p65、p65蛋白的表达水平Note. A: Western blot of p-p65 and p65 in each group. B: Western blot of IκBα in each group. C: Semi-quantitative histogram of p65, p-p65 and p-p65/65, n=9. D: Semi-quantitative histogram of IκBα, n=9. 1: Control group; 2: Tempol group; 3: Model group. Compared with the control group,*P< 0.05. Compared with the model group,# P< 0.05.Fig.3 Western blot analysis of IκBα, p-p65 and p65 expression in the myocardial tissues of each group
本项目通过皮下注射异丙肾上腺素ISO的方法建立大鼠心肌肥厚模型,然后给予氮氧自由基tempol干预,研究氮氧自由基tempol干预后ISO诱导的心肌肥厚大鼠NF-κB信号通路及相关炎症因子的变化,并探讨其对心肌肥厚的保护作用。结果显示,与正常对照组比较,心肌肥厚模型组的HWI、LVWI增加,心肌HE染色见肌纤维增粗、心肌结构紊乱、心肌细胞表面积增大,间质见炎性细胞浸润,说明ISO成功诱导了大鼠心肌肥厚模型;与正常对照组比较,心肌肥厚模型组的TNF-α、IL-6 mRNA转录水平、p-p65/p65水平明显增加,NF-κB抑制蛋白IκBα表达减少(P< 0.05),说明经ISO诱导的心肌肥厚模型激活了NF-κB信号通路。与模型组比较,tempol干预组HWI、LVWI减小(P< 0.05),TNF-α、IL-6 mRNA转录水平、p-p65/p65的表达有不同程度降低,NF-κB抑制蛋白IκBα表达增加,降解减少(P< 0.05),HE染色见心肌结构紊乱、心肌细胞肥大程度降低,说明tempol对ISO诱导的心肌肥厚有治疗作用,且对NF-κB信号通路有抑制作用。因此我们推测,tempol对心肌肥厚的干预作用可能与抑制NF-κB信号通路有关。
在今后的研究中,进一步研究tempol、心肌肥厚、NF-κB信号通路三者的相关关系,为肥厚性心肌病的防治提供理论和实验依据,对寻找病理性心肌肥厚相关治疗靶点具有重要意义。
[1] 吴小龙, 薛明明, 司明明, 等. 心肌肥厚发生机制及药物治疗的研究进展 [J]. 医学综述, 2015, 21(5): 803-806.
[2] Heinzel FR, Hohendanner F, Jin G, et al. Myocardial hypertrophy and its role in heart failure with preserved ejection fraction [J]. J Appl Physiol (1985), 2015, 119(10): 1233-1242.
[3] 宋艳瑞, 刘忠, 顾淑莲, 等. 肥厚型心肌病的致病分子机制研究进展 [J]. 遗传, 2011, 33(6): 549-557.
[4] Haynes P, Campbell KS. Myocardial hypertrophy reduces transmural variation in mitochondrial function [J]. Front Physiol, 2014, 5:178.
[5] 刘丽娜, 李法琦. 心肌肥厚相关信号通路的研究进展 [J]. 重庆医学, 2010, 39(20): 2805-2808.
[6] Hou J, Kang YJ. Regression of pathological cardiac hypertrophy: signaling pathways and therapeutic targets [J]. Pharmacol Ther, 2012, 135(3): 337-354.
[8] Christia P, Bujak M, Gonzalez-Quesada C, et al. Systematic characterization of myocardial inflammation, repair, and remodeling in a mouse model of reperfused myocardial infarction [J]. J Histochem Cytochem, 2013, 61(8): 555-570.
[9] 景临林, 马慧萍, 樊鹏程, 等. 氮氧自由基对模拟高原缺氧小鼠心肌组织缺氧和凋亡蛋白的影响 [J]. 中国药学杂志, 2016, 51(6): 459-462.
[10] 赵祎镭, 李丹露. 心肌肥厚模型建立方法的研究进展 [J]. 中国药房, 2014, 25(5): 473-475.
[11] Parry DJ, Raskin RE, Poynter JA, et al. Short and medium term outcomes of surgery for patients with hypertrophic obstructive cardiomyopathy [J]. Ann Thorac Surg, 2015, 99(4): 1213-1219.
[12] 罗亚雄, 石翔, 王福军. 肥厚型心肌病的研究进展 [J]. 中西医结合心血管病电子杂志, 2016, 4(3): 5-8.
[13] Oka T, Akazawa H, Naito AT, et al. Angiogenesis and cardiac hypertrophy: maintenance of cardiac function and causative roles in heart failure [J]. Circ Res, 2014, 114(3): 565-571.
[14] Lu T, Stark GR. NF-κB: regulation by methylation [J]. Cancer Res, 2015, 75(18): 3692-3695.
[15] Yu X, Hong F, Zhang YQ. Cardiac inflammation involving in PKCε or ERK1/2-activated NF-κB signalling pathway in mice following exposure to titanium dioxide nanoparticles [J]. J Hazard Mater, 2016, 313: 68-77.
[16] Jiang C, Tong YL, Zhang D, et al. Sinomenine prevents the development of cardiomyopathy in diabetic rats by inhibiting inflammatory responses and blocking activation of NF-κB [J]. Gen Physiol Biophys, 2017, 36(1): 65-74.
[17] Xu X, Si L, Xu J, et al. Asiatic acid inhibits cardiac hypertrophy by blocking interleukin-1β-activated nuclear factor-κB signalinginvitroandinvivo[J]. J Thorac Dis, 2015, 7(10): 1787-1797.
[18] Zhong P, Wu L, Qian Y, et al. Blockage of ROS and NF-κB-mediated inflammation by a new chalcone L6H9 protects cardiomyocytes from hyperglycemia-induced injuries [J]. Biochim Biophys Acta, 2015, 1852(7): 1230-1241.
[19] Zhang C, Wang F, Zhang Y, et al. Celecoxib prevents pressure overload-induced cardiac hypertrophy and dysfunction by inhibiting inflammation, apoptosis and oxidative stress [J]. J Cell Mol Med, 2016, 20(1): 116-127.
[20] Tham YK, Bernardo BC, Ooi JY, et al. Pathophysiology of cardiac hypertrophy and heart failure: signaling pathways and novel therapeutic targets [J]. Arch Toxicol, 2015, 89(9): 1401-1438.

