CMAH基因在小鼠不同组织中的转录水平分析
李一帆,杨 娜,王 瑶,尹德琦,赵 旭,桑晓宇*,汉丽梅*
(1.沈阳农业大学畜牧兽医学院,沈阳 110866; 2.辽宁省人兽共患病研究重点实验室,沈阳 110866)
唾液酸(sialic acid)是通过N末端或O末端连接在糖蛋白或糖脂末端单糖家族的总称。唾液酸的核心结构包含9个碳原子,并且通常在第4、5、7、8和9号位的碳原子发生修饰可形成不同的唾液酸衍生物[1]。根据5号位的碳原子连接的基团不同,可以将唾液酸初步分为N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac)、N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc)和脱氨神经氨酸(deaminoneuraminic acid,KDN)[2]。在哺乳动物细胞中唾液酸的主要存在形式包括Neu5Ac和Neu5Gc,并且在胞苷单磷酸-N-乙酰神经氨酸羟化酶(cytidine monophospho-N-acetylneuraminic acid hydroxylase,CMAH)的作用下CMP-Neu5Ac可生成Neu5Gc[3]。研究者已经在猪气管上皮细胞[4]、鸭结肠的隐窝上皮细胞、马气管上皮细胞和鸽子的结肠与气管中检测到Neu5Gc。不仅如此,研究者应用高效液相色谱(HPLC)在鸡的气管和肠道表面也检测到Neu5Gc[5]。由于人体内的CMAH基因丢失了92 bp,导致人失去了合成Neu5Gc的能力[4]。最近研究表明,与人类的情况类似,雪貂也不能合成Neu5Gc[6]。
研究表明多种病原微生物都能利用在哺乳动物细胞表面广泛存在的唾液酸作为受体,包括细菌、寄生虫和病毒等[7],与之结合并入侵宿主细胞,但不同的病原选择不同的唾液酸衍生物作为受体[8]。A型和B型流感病毒主要识别宿主细胞表面以2, 3糖苷键或2, 6糖苷键连接的Neu5Ac,而马流感病毒主要结合受体是Neu5Gc[9]。研究表明在A549细胞表面外源表达的Neu5Gc受体能够抑制A型流感病毒的感染[10]。不仅如此,有研究表明人体红细胞表面缺少Neu5Gc受体的表达,能够限制诺氏疟原虫的跨种传播[11]。相反,多瘤病毒、轮状病毒等同时能够识别Neu5Ac和Neu5Gc并作为入侵宿主的受体[12]。由此可见,宿主细胞表面唾液酸受体的类型与病原的入侵密切相关。
不同物种或同一物种的不同组织中细胞表面多聚糖末端结合的Neu5Gc和Neu5Ac所占比例都不同。在小鼠和大鼠组织中Neu5Gc和CMP-Neu5Ac的表达比例主要依靠CMAH的活性水平[13]。尽管脑组织中的唾液酸含量非常高[14],但在大多数哺乳动物脑组织内很少能够检测到Neu5Gc。在神经组织中起到非常重要作用的神经节苷脂和神经细胞粘附分子(neural cell adhesion molecule,NCAM)中的多聚唾液酸仅包含Neu5Ac。本研究通过应用相对荧光定量PCR的方法检测Neu5Cc合成途径中关键酶(CMAH)的基因在不同小鼠组织中转录水平,为进一步分析不同组织中所含Neu5Gc含量差异提供理论参考。
1 材料和方法
1.1 实验动物
采用辽宁省实验动物资源中心培育的5只SPF级雌性BALB/c小鼠,体重18~20 g [SCXK (辽) 2015-0001],[SYXK (辽) 2015-0001],质量检测单位:中国食品药品检定研究院。
1.2 主要试剂与仪器
BIOZOL Total RNA Extraction Reagent(TRIzol)购于Bio Flux公司;PrimeScriotTMRT Reagent Kit with gDNA Eraser(反转录试剂盒)与SYBR® Premix Ex TaqTMII(荧光定量PCR试剂盒)均购于Takara公司;2× RNA Loading Buffer购于Solarbio公司;DEPC购于Amresco公司。
实时荧光定量PCR仪器:Thermo Fisher公司QuantStudio® 6 Flex;电泳仪:北京六一生物技术有限公司DYY-7C型;凝胶成像仪:UVP公司GelDoc-It2 Imager型;低温离心机:德国Eppendorf公司Centrifuge 5427R型。
1.3 实验方法
1.3.1 实验样本的采集
组织样品采集于5只健康的SPF级BALB/c鼠。实验过程中按实验动物使用的3R原则给予人道主义关怀。各样品均采集于不同脏器的相同部位。为保证提取RNA的质量,用乙醚致晕小鼠后对其断颈处死,立即采集其肝脏、心脏、脾脏、肺脏、肾脏、小肠、骨骼肌、气管及脑组织,并用预冷的生理盐水漂洗血液,后迅速剪成小块(约0.1 g),浸入液氮速冻后,立刻投入装有TRIzol的2 mL去酶离心管,于-80℃冻存备用。
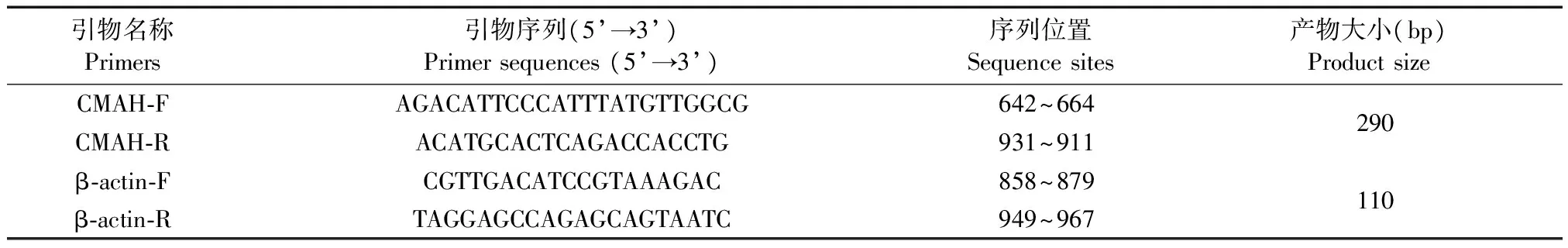
表1 CMAH与β-actin基因荧光定量PCR引物
1.3.2 RNA的提取、检验与反转录
采用TRIzol法提取各组织中的RNA;采用Nano Drop 2000c检测其浓度,通过OD260/OD280与OD260/OD230的比值初步判断RNA是否有降解和污染;并运用RNA甲醛变性琼脂糖凝胶(1%)电泳对其完整性进行检验,电泳条件为:预电泳80 V(15 min),正式电泳50 V(50 min)。采用PrimeScriotTMRT Reagent Kit with gDNA Eraser反转录试剂盒进行反转录:首先42℃,2 min去除基因组DNA;再选择随机引物经37℃,15 min进行反转录;最后经85℃,5 s终止反应。
1.3.3 荧光定量PCR方法
(1)引物设计:根据GenBank中登录的小鼠CMAH基因序列(NM_001111110)和β-actin基因序列(NM_007393),应用ABI Primer Express 3.0实时荧光定量PCR引物设计软件设计荧光定量PCR引物,其中以β-actin作为内参基因。对所设计引物的特异性和扩增效率等因素进行分析,选择引物序列如表1所示。引物由上海捷瑞生物工程有限公司合成。
(2)制作相对荧光定量PCR标准曲线:根据实验需求与条件选用SYBR Green,2-ΔCt相对定量法进行荧光定量PCR检测。将原始cDNA模板作3倍梯度稀释后进行荧光定量PCR扩增,分别制作2对引物标准曲线,探索退火温度使各对引物的扩增效率在其它各项指标的允许范围内接近100%,最终确定反应体系为SYBR Premix Ex Taq II(2×)10 μL,ROX Reference Dye II(50×)0.4 μL,PCR forward primer(10 μmol/L)0.8 μL,PCR reverse primer(10 μmol/L)0.8 μL,template 2 μL,ddH2O 6 μL;最佳反应条件为:预变性95℃,30 s;PCR反应95℃,5 s,60℃,30 s,72℃,30 s,共40个循环,在每个循环结束时采集荧光信号;之后进行溶解曲线分析,95℃,15 s,60℃,60 s,95℃,15 s。
(3)qPCR相对定量检测:阴性对照以水为模板,20 μL反应体系,分别做5个生物学重复及3个组内重复。
1.4 统计学方法
所得qPCR相对定量数据应用SPSS软件进行One-way ANOVA分析,以P< 0.05为差异有显著性,应用GraphPad Prism 5软件制图。
2 结果
2.1 RNA的质量与完整性检测结果
检测所提取各组织总RNA的OD260/OD280比值均介于1.90~2.10之间,OD260/OD230的比值均介于1.90~2.20之间,且稍大于OD260/OD280的比值,其浓度也满足反转录需要。将BALB/c小鼠各组织总RNA进行甲醛变性琼脂糖凝胶,完整性检测如图1所示,各样品中的28s、18s、5s三条特异性条带均清晰可见,且28s亮度约为18s的2倍,说明所提取的总RNA完整性较好,无明显降解,满足后续实验需求。
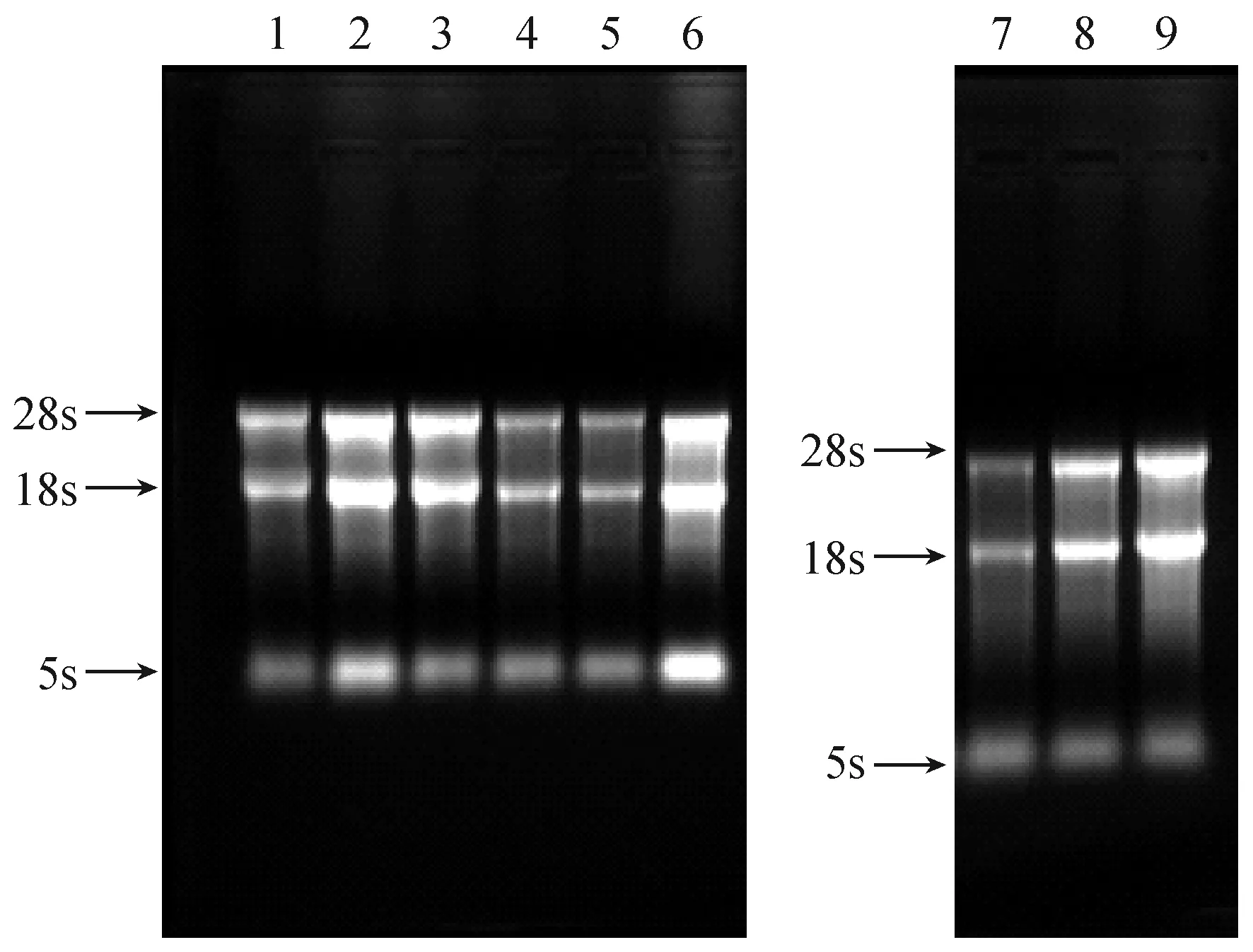
注:1:心肌;2:肝脏;3:气管;4:小肠;5:肾脏;6:脑组织;7:骨骼肌;8:肺脏;9:脾脏。图1 总RNA完整性检验Note. 1: Myocardium; 2: Liver; 3: Trachea; 4: Small intestine; 5: Kidney; 6: Brain; 7: Skeletal muscle;8: Lung; 9: Spleen.Fig.1 Integrity of the total RNA
2.2 相对标准曲线的建立
本实验选择SYBR Green染料法,以3倍梯度稀释肝脏组织的原始cDNA,不少于5个稀释点,以水为模板作阴性对照,均重复三个加样孔,分别制作CMAH与β-actin两对引物的相对标准曲线。扩增曲线如图2A、2B所示,模板3倍梯度稀释扩增曲线重复性好,间距一直。溶解曲线如图2C、2D所示,各引物均为特异性的单峰,无非特异性扩增,说明各对引物特异性良好,并且无引物二聚体等结构。两基因相对标准曲线如图2E、2F所示,β-actin与CMAH引物的扩增效率分别为101.728%、104.210%,接近100%,组内差距小,重复性好。

注:A:β-actin基因的扩增曲线;B:CMAH基因的扩增曲线;C:β-actin基因的溶解曲线;D:CMAH基因的溶解曲线;E:β-actin基因的相对标准曲线;F:CMAH基因的相对标准曲线。图2 相对标准曲线的建立Note. A: Amplification curve of β-actin. B: Amplification curve of CMAH. C: Dissolution curve of β-actin. D: Dissolution curve of CMAH. E: Standard curve of β-actin. F: Standard curve of CMAH.Fig.2 Establishment of the relative standard curves
以上数据证明本试验实验所选2对荧光定量PCR引物及其相应反应条件可满足SYBR Green、2-ΔCt相对定量法进行荧光定量PCR检测的条件,实验结果真实可信。
2.3 qPCR相对定量检测结果
根据上文中所建立的相对荧光定量PCR的实验条件,分别对小鼠的肝脏、脾脏、肾脏、气管、肺脏、心肌、骨骼肌、小肠和脑组织的CMAH与β-actin基因进行荧光定量PCR检测,检测结果如表2所示,并选择2-ΔCt进行差异表达分析。实验结果如图3所示:CMAH基因在BALB/c小鼠肝脏内表达最为丰富,后依此为脾脏、肾脏、气管、肺脏、心肌、骨骼肌和小肠,而脑组织中表达量极低。其中肝脏组织CMAH基因表达量分别达到脾脏的2.46倍;肾脏的3.17倍;气管的5.14倍;肺脏的11.70倍;心肌的21.12倍;骨骼肌的31.37倍;小肠的66.90倍;脑组织的1055.99倍。

表2 BALB/c 小鼠各组织脏器CMAH/β-actin基因荧光定量PCR检测结果
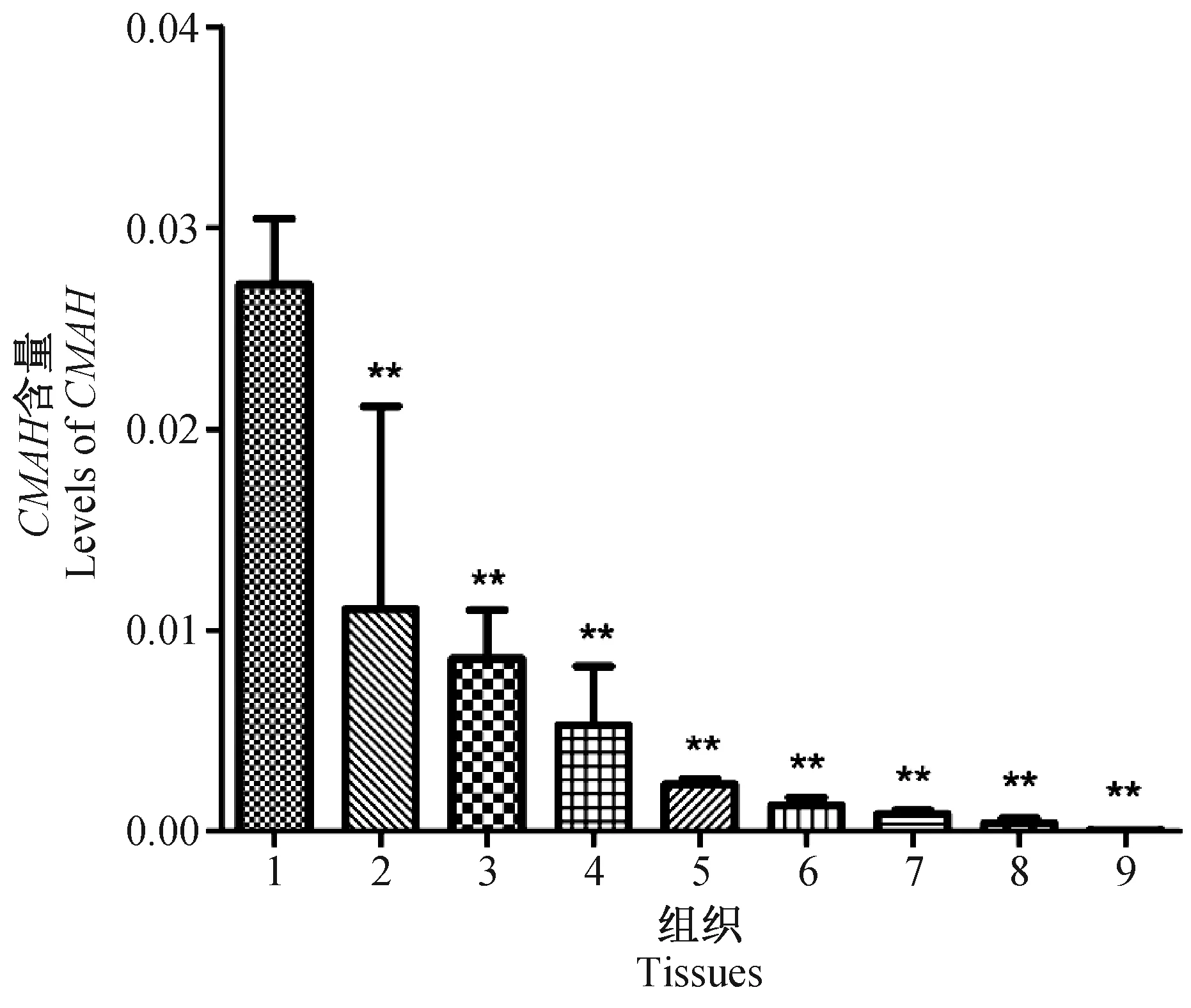
注:1:肝脏;2:脾脏;3:肾脏;4:气管;5:肺脏;6:心肌;7:骨骼肌;8:小肠;9:脑。以内参(β-actin)的转录水平为1并对其他转录水平进行校正。与肝脏比较,** P< 0.01。图3 CMAH基因在不同组织中的转录水平Note. 1: Liver; 2: Spleen; 3: Kidney; 4: Trachea; 5: Lung; 6: Myocardium; 7: Skeletal muscle; 8. Small intestine; 9: Brain. Transcriptional levels of CMAH were normalized to those of the internal control (β-actin). Compared with the liver,** P < 0.01.Fig.3 Transcriptional levels of CMAH in different tissues
3 讨论
细胞表面的唾液酸可参与细胞-细胞、细胞-病原体之间的信息交换[15]、免疫反应、炎症反应及大量粘附过程。当前研究表明,细胞表面两种重要唾液酸衍生物就是Neu5Ac和Neu5Gc。CMAH可催化Neu5Ac发生羟基化合成Neu5Gc,此过程具有高度特异性。在不同种动物相同组织内及在同种动物不同组织内,Neu5Ac与Neu5Gc所占比例均有差异[16]。由于CMAH基因碱基缺失、CMAH蛋白表达障碍或失活等原因,包括人在内的一些动物(雪貂、海豹、部分爬行动物和鸟类等)都不能合成Neu5Gc[17],但在其他哺乳动物中CMAH基因却可以高效表达并且Neu5Gc含量丰富[18],但是又有明显的组织差异性。已有研究表明,小鼠血清中含有Neu5Gc,说明小鼠CMAH基因能够表达具有生物学功能的羟化酶,但对不同组织中CMAH基因转录水平的研究较少[7]。本研究中,通过相对定量PCR方法能够在正常BLAB/c小鼠的9种组织中检测到CMAH基因的转录,但其转录情况差异较大,肝脏中的转录水平最高,其次依次为脾脏、肾脏、气管,而肺脏、心肌、骨骼肌、小肠和脑组织中的转录水平都比较低,此结果与先前发表文章的实验结果相一致[18]。当前,我们尚未完全阐明不同物种或者同一个体间不同组织的Neu5Gc表达差异的调控机制,但宿主细胞表面的唾液酸组成类型确实能够影响不同病原与宿主之间的相互作用,值得我们进一步探索。
荧光定量PCR方法自建立以来已经广泛应用检测基因表达调控的初步探索,根据中心法则,我们知道基因转录情况的分析不能完全反映出蛋白表达情况,但是与Western blot等免疫学方法相比较,荧光定量PCR方法可以快速检测出目的基因转录情况,以此来初步评估蛋白的表达水平。因此,本研究成功建立BALB/c小鼠CMAH基因相对荧光定量PCR检测方法,并确定其在多种组织中均有转录但差异较大,此结果为进一步分析BALB/c小鼠不同组织中所含Neu5Gc差异提供参考依据。
[1] Takahashi T, Takano M, Kurebayashi Y, et al. N-glycolylneuraminic acid on human epithelial cells prevents entry of influenza A viruses that possess N-glycolylneuraminic acid binding ability [J]. J Virol, 2014, 88(15): 8445-8456.
[2] Wasylnka JA, Simmer MI, Moore MM. Differences in sialic acid density in pathogenic and non-pathogenic Aspergillus species [J]. Microbiology, 2001, 147(Pt 4): 869-877.
[3] 程铖, 高春芳. 唾液酸的生物学意义及其在肝病中的研究进展 [J]. 检验医学, 2013, 28(4): 333-336.
[4] Wasik BR, Barnard KN, Parrish CR. Effects of sialic acid modifications on virus binding and infection [J]. Trends Microbiol, 2016, 24(12): 991-1001.
[5] Malykh YN, Shaw L, Schauer R. The role of CMP-N-acetylneuraminic acid hydroxylase in determining the level of N-glycolylneuraminic acid in porcine tissues [J]. Glycoconj J, 1998, 15(9): 885-893.
[6] 范晓琳, 苏如婷, 韩晓骏. 糖尿病慢性肾脏疾病患者血清唾液酸的变化及其与血管内皮功能关系的研究 [J]. 中国糖尿病杂志, 2015, 23(8): 717-719.
[7] Ng PS, Böhm R, Hartley-Tassell LE, et al. Ferrets exclusively synthesize Neu5Ac and express naturally humanized influenza A virus receptors [J]. Nat Commun, 2014, 5: 5750.
[8] 宋宇, 周洁, 高诚, 等. 哺乳动物呼肠孤病毒外壳蛋白和受体研究进展 [J]. 实验动物与比较医学, 2010, 30(1): 68-72.
[9] Diaz SL, Padler-Karavani V, Ghaderi D, et al. Sensitive and specific detection of the non-human sialic acid N-glycolylneuraminic acid in human tissues and biotherapeutic products [J]. PLoS One, 2009, 4(1): e4241.
[10] Varki A. Sialic acids in human health and disease [J]. Trends Mol Med, 2008, 14(8): 351-360.
[11] Dankwa S, Lim C, Bei AK, et al. Ancient human sialic acid variant restricts an emerging zoonotic malaria parasite [J]. Nat Commun, 2016, 7: 11187.
[12] 杨威. N-乙酰神经氨酸衍生物的合成及其在快速检测流感病毒中的应用 [D]. 东北师范大学, 2009.
[13] Kavaler S, Morinaga H, Jih A, et al. Pancreatic β-cell failure in obese mice with human-like CMP-Neu5Ac hydroxylase deficiency [J]. FASEB J, 2011, 25(6): 1887-1893.
[14] 科技日报. 斑马鱼研究首次识别出新遗传病 唾液酸确认有助大脑与骨骼发育 [J]. 江西饲料, 2016, 23(4): 43.
[15] 宋战昀, 丁壮. 病毒细胞膜唾液酸受体研究进展 [C]. 中国畜牧兽医学会家畜传染病学分会第六届理事会第二次会议暨教学专业委员会第六届代表大会论文集. 2006.
[16] 许永华, 张东辉, 是文辉, 等. Wistar大鼠和昆明种小鼠血清唾液酸频率分布与参考值 [J]. 中国比较医学杂志, 2006, 16(9): 541-543.
[17] 占玲俊, 邓巍, 鲍琳琳, 等. 唾液酸受体并非流感病毒各亚型在雪貂组织中播散分布的决定因子 [J]. 中国比较医学杂志, 2012, 22(4): 23-26.
[18] Kwon DN, Chang BS, Kim JH. Gene expression and pathway analysis of effects of the CMAH deactivation on mouse lung, kidney and heart [J]. PLoS One, 2014, 9(9): e107559.

