不同性别氟中毒大鼠模型的比较研究
刘 洋,韩伦英,何 川,彭凤涛,李桂筑,王飞清*
(1.贵阳中医学院第一附属医院检验科,贵阳 550001; 2.贵州医科大学医学检验学院,贵阳 550004)
中国是世界上最大的地方性氟中毒发病地带,而贵州省是我国地氟病发病率最高的省份之一[1-2]。研究表明[3]长期处于高氟环境或摄入过量的氟会导致机体许多生理生化改变,氟累积在机体各组织和器官会导致不同程度的损害,引发氟中毒。现阶段,氟中毒损伤的机制研究主要还存在动物水平,成功构建氟病区动物模型对氟中毒的研究起到重要作用。氟斑牙、尿氟及骨氟是评判氟中毒动物模型构建成功的标准[4]。氟中毒损伤是一种慢性过程,成功构建氟病区动物模型耗时过长,其模型构建是否受雌雄性别的影响,未见有相关的研究论证。因此,本实验通过构建氟中毒SD大鼠动物模型,观察比较雌雄大鼠体重、氟斑牙出现的时间、尿氟和骨氟含量,验证氟中毒对雌雄大鼠的差异性影响,从而丰富氟中毒动物模型制备的鉴定标准,提高模型选择的精准性,这一比较研究对阐明氟中毒的毒性机理具有实用意义。
1 材料和方法
1.1 实验动物
由贵州医科大学动物实验中心提供断乳5周龄,体重150 g左右,清洁级SD大鼠48只 [SCXK (黔) 2012-0001],雌雄各半。实验室环境温度20℃~25℃,湿度(60±20)%,正常明暗交替 [SYXK (黔) 2012-0001]。
1.2 主要仪器
数字式离子计(江苏江分店精密分析仪器有限公司);氟离子选择性电极(上海精密科学仪器有限公司);电子天平(美国双杰兄弟有限公司)。
1.3 实验方法
1.3.1 分组及氟中毒模型构建
大鼠一周适应性饲养,无异常发现后,根据体重由小到大排序,按随机数表法分组、编号,分为对照组24只、染氟组24只,雌雄各半。
构建动物模型方法:实验经贵州医科大学伦理委员会批准实施(1305020),各组自由饮用自来水,模型组自由食用含氟饲料,饲料含氟量100 mg/kg。每三天动态观察大鼠日常情况(毛色、饮水、食用饲料量等),观察大鼠牙齿的变化并称重、记录数据。每周调整鼠笼的位置,力求各组大鼠的实验条件一致。分别于70 d雌鼠全部出现氟斑牙时股动脉取血处死一批大鼠,110 d雄鼠全部出现氟斑牙时股动脉取血处死一批大鼠。
1.3.2 氟斑牙标准
每两天观察各组大鼠牙齿变化情况,判定大鼠牙齿的损伤程度并做好记录。处死大鼠前对各大鼠的牙齿进行拍照。氟斑牙分为正常、轻度、中度、重度四度标准方法进行[5]。正常:牙齿呈淡黄色或棕黄色,牙表面光滑有光泽,呈半透明状;轻度:牙表面黄白相间,白平色白垩条纹清晰;中度:牙表面呈无光泽粉笔样白色斑;重度:牙表面出现小沟、裂纹或部分断裂脱落,牙齿呈锯齿状严重缺损。
1.3.3 体重测定
每三天使用电子天平对各组大鼠进行称重并记录。
1.3.4 尿氟和骨氟含量检测
尿氟在处死大鼠之前用代谢笼收集24 h尿,使用氟离子选择电极法测定氟含量。骨氟在股动脉取血处死大鼠后,取长骨,将附着的组织和脂肪剔除干净,灰化,采用氟离子选择电极法检测骨氟含量。
1.4 统计学方法

2 结果
2.1 各组大鼠状态
至实验结束,各组动物均无非正常死亡。对照组大鼠食欲正常,精神较好,毛色有光泽;染氟组大鼠食欲降低,其中雄鼠活动减少,精神萎靡不振,毛色光泽度下降,雌鼠怕光、怕音、躁动,易有攻击性。
2.2 各组大鼠氟斑牙情况
对照组雌雄大鼠实验全过程均未出现氟斑牙,牙呈棕色或棕黄色、色泽光滑的半透明状。染氟组大鼠自由食用含氟饲料,雌鼠首次出现肉眼氟斑牙时间在自由食用含氟饲料60 d左右,约一周后染氟组雌鼠全部出现氟斑牙,随染氟时间的延长,呈棕、白色相间横纹,直至20 d前后整个牙面呈白粉笔样。雄鼠首次出现肉眼氟斑牙时间在自由食用含氟饲料80 d左右,结果显示雄鼠首次出现氟斑牙比雌鼠晚约20 d,约25 d后染氟组雄鼠全部出现氟斑牙,因此将雌鼠(70 d)和雄鼠(110 d)全部出现氟斑牙时间点作为本次实验的模型截止时间。各组大鼠氟斑牙具体结果见表1和图1。
2.3 各组大鼠体重变化
染氟前雌雄大鼠体重未见明显差异,染氟30 d左右雌雄大鼠进入快速生长期,且雌雄大鼠体重相比差异有显著性(P< 0.01)。相同性别大鼠比较,随染氟时间延长,110 d染氟组雄鼠体重高于对照组,差异无显著性(P> 0.05);110 d染氟组雌鼠体重高于对照组,差异无显著性(P> 0.05),结果显示大鼠体重与染氟时间呈正相关性,见表2。
2.4 各组大鼠尿氟变化
随染氟时间延长,雌雄大鼠尿氟逐渐升高,染氟组明显高于对照组,且差异有显著性(P< 0.01),结果显示尿氟与染氟时间呈正相关。不同性别大鼠尿氟比较,雄鼠尿氟高于雌性,且差异有显著性(P< 0.01),尿氟结果显示肾脏排泄氟受性别的影响,结果见表3。
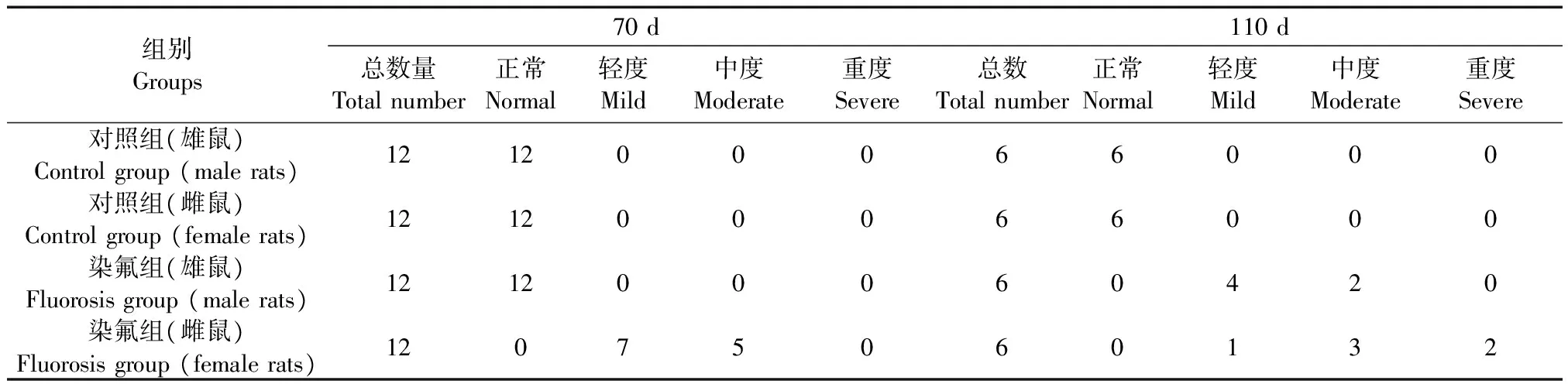
表1 各组大鼠氟斑牙发生情况

注:A:正常;B:轻度;C:中度;D:重度。图1 氟中毒大鼠氟斑牙情况Note. A: Normal; B: Mild; C: Moderate; D: Severe.Fig.1 Dental fluorosis of the fluorosis rats
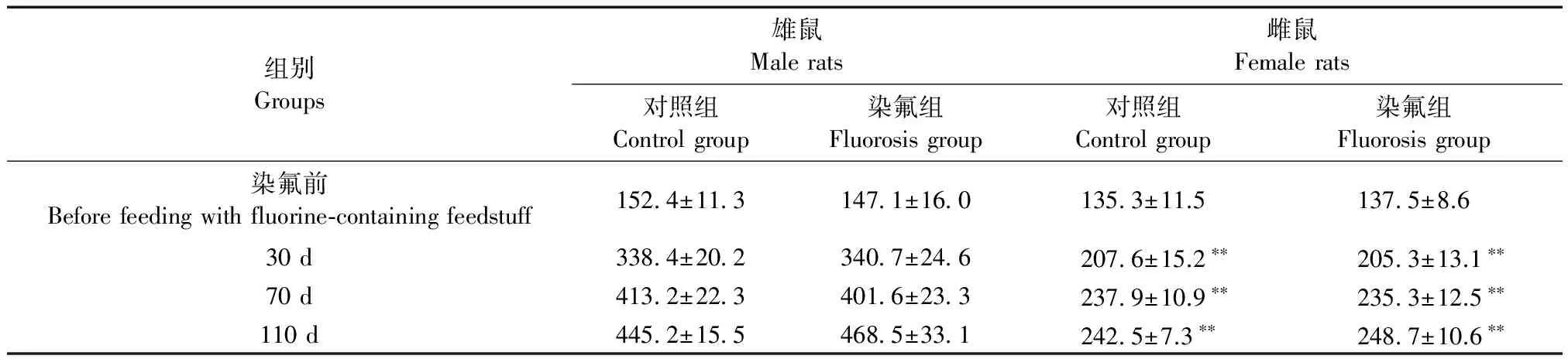
组别Groups雄鼠Malerats雌鼠Femalerats对照组Controlgroup染氟组Fluorosisgroup对照组Controlgroup染氟组Fluorosisgroup染氟前Beforefeedingwithfluorine⁃containingfeedstuff1524±1131471±1601353±11.51375±8.630d3384±2023407±2462076±15.2∗∗2053±13.1∗∗70d4132±2234016±2332379±10.9∗∗2353±12.5∗∗110d4452±1554685±3312425±7.3∗∗2487±10.6∗∗
注:与雄鼠比较,**P< 0.01。
Note. Compared with the male rats,**P< 0.01.
2.5 各组大鼠骨氟变化
随染氟时间延长,雌雄大鼠骨氟逐渐升高,染氟组明显高于对照组,且差异有显著性(P< 0.01),结果显示骨氟与染氟时间呈正相关。不同性别大鼠骨氟比较,雄鼠骨氟高于雌鼠,且差异有显著性(P< 0.01),骨氟结果显示骨骼吸收沉积氟含量受性别的影响,结果见表4。
3 讨论
地氟病发病机理及病因的研究已取得了一定的成果,但其发病的分子机理还未阐明,许多毒性机理有待实验研究进一步证实。因此,通过建立高仿真的氟病区动物模型,解析其损伤的分子机理,将有助于推进地氟病的研究水平,为探索有效防治氟中毒提供途径和方法。目前研究人员已经采用不同的技术手段成功地复制了氟中毒模型,但均相对存在无法确定证实的问题。研究发现,利用大鼠、小鼠来建立氟中毒动物模型,有利于模拟人的受毒环境[6-7]。但研究还表明不同品系的小鼠对氟的敏感性差异较大,证实大鼠为氟的易感鼠系,且容易饲养,为最理想氟中毒动物模型的实验动物[8]。本实验研究选用SD大鼠为模型动物,进一步解析雌雄大鼠对氟毒性的区别。
地氟病是长期摄入过量氟而发生的一种慢性全身性疾病,体征表现最主要是氟斑牙和氟骨症,其早期最常见而突出的症状是氟斑牙。氟斑牙是牙齿发育过程中机体摄取过量的氟而导致萌出后牙齿表面形态异常的一种疾病。氟斑牙模型大鼠的特征性改变表现为萌出后牙齿表面黄色、黄褐色等釉质矿化不全的改变或釉质表面、切牙釉质呈棕白相间的条纹[9-10],进而引起牙齿的损伤,可以特异直观地反映氟对牙组织形态结构的毒性损伤程度[11-12]。氟斑牙的判断是氟中毒模型成功的关键,同时也是唯一可以用肉眼观察到的慢性氟中毒的早期临床体征,是衡量氟中毒情况的良好指标,且染毒剂量越大,形成的时间越短。本实验结果显示,对照组雌雄大鼠实验全程牙外观呈棕色或棕黄色、色泽光滑的半透明状。染氟组大鼠自由食用含氟饲料,雌鼠首次出现肉眼氟斑牙时间在自由食用含氟饲料60 d左右,约一周时间染氟组雌鼠全部出现氟斑牙。这与白生宾等研究报道雌性大鼠60 d左右出现氟斑牙基本相吻合[13]。随着染氟时间延长,氟离子在牙齿中一直处于沉积状态,氟离子蓄积浓度升高,牙呈棕、白色相间横纹,直至20 d左右整个牙面呈白粉笔样。本实验结果显示,雄鼠首次出现肉眼氟斑牙时间在自由食用含氟饲料80 d左右,约25 d后染氟组雄鼠全部出现氟斑牙。本实验结果首次发现雄鼠出现氟斑牙时间比雌鼠晚约20 d,显示氟在雌雄个体间引起氟斑牙发生情况存在明显的性别差异性。这是否提示我们在不考虑性别差异情况下,选择复制雌性大鼠动物模型可节省时间、物力及人力,结果将为今后氟中毒研究选择动物提供重要意义。
复制氟中毒模型判断主要从动物的一般状况、体重变化、牙齿形态及长度、机体氟的水平和组织病理学检测等方面进行。监测体重变化可较好体现动物体格生长发育状况及衡量机体营养情况,是实时反映外界毒物影响的最直接指标。曾贝贝等研究报道,不同剂量氟化物可影响雄鼠和雌鼠体重变化[14]。截止本实验结束,各组大鼠均无非正常死亡。本实验每三天称量大鼠体重并记录,结果显示,对照组大鼠食欲正常,精神较好,毛色有光泽;染氟组大鼠食欲降低,其中雄鼠活动减少,精神萎靡不振,毛色光泽度下降;雌鼠怕光怕音,易躁动有攻击性。染氟前雌雄大鼠体重未见明显差异,染氟30 d左右雌雄大鼠进入快速生长期,且雌雄大鼠体重间有明显的差异性,这与实验证实约75 d以后,大鼠进入快速生长期,雌雄体重开始存在明显差异相吻合[15-16]。随染氟时间延长,110 d染氟组雄鼠体重高于对照组,差异无显著性(P> 0.05);染氟组雌鼠体重高于对照组,差异无显著性(P> 0.05),结果显示大鼠体重与染氟时间呈正相关性。
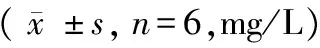
表3 各组大鼠尿氟变化情况
注:与对照组比较,**P< 0.01;与雄鼠比较,△△P< 0.01。
Note. Compared with the control group,**P< 0.01. Compared with the male rats,△△P< 0.01.
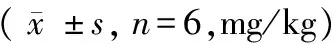
表4 各组大鼠骨氟变化情况
注:与对照组比较,**P< 0.01,与雄鼠比较,△△P< 0.01。
Note. Compared with the control group,**P< 0.01. Compared with the male rats,△△P< 0.01.
研究发现机体吸收的氟约有50%可通过尿液、汗腺、消化道等途径排出,其中由肾泌尿排泄的氟约占总排氟量的85%左右[17]。因此,尿氟可作为机体氟暴露的最好指标,在一定程度上可反映体内氟蓄积的情况,是判断复制氟中毒动物模型成功的重要依据[18]。本实验结果显示,随染氟时间延长,尿氟逐渐升高,染氟组明显高于对照组,且差异有显著性(P< 0.01),提示尿氟与染氟时间呈正相关。不同性别大鼠尿氟比较,雄鼠尿氟高于雌性,且差异有显著性(P< 0.01),提示肾脏排泄氟受性别的影响。
机体吸收氟主要通过消化道途径,吸收氟90%以上分布在骨组织,氟对骨骼有特殊亲和力[19]。骨骼是构成机体的重要器官,同时也是氟作用的靶器官。如果机体长期过量摄入氟化物,氟在骨骼大量蓄积会影响骨的正常代谢,导致骨组织形态、结构发生异常改变,即可发生氟骨症[20-21]。因此测定骨组织的氟含量是判断氟中毒动物模型的重要指标[22]。本实验结果显示,随染氟时间延长,雌雄大鼠骨氟逐渐升高,染氟组明显高于对照组,且差异有显著性(P< 0.01),结果提示骨氟与染氟时间呈正相关。不同性别大鼠骨氟比较,雄鼠骨氟高于雌鼠,且差异有显著性(P< 0.01),提示骨骼吸收沉积氟含量受性别的影响。
综上所述,判断氟中毒动物模型复制成功依据主要从氟斑牙、尿氟及骨氟等方面来观察[23-24]。本实验结果显示,机体摄入过量氟可影响雌雄大鼠生活状况及体重,发现雄鼠出现氟斑牙晚于雌鼠,且雄鼠通过尿排泄氟多于雌鼠,骨骼沉积氟高于雌鼠,提示雌雄性别不同对氟毒性存在差异,该结果对今后我们有选择性复制动物模型起到重要作用。
[1] Wang C, Gao Y, Wang W, et al. A national cross-sectional study on effects of fluoride-safe water supply on the prevalence of fluorosis in China [J]. BMJ Open, 2012, 2(5): e001564.
[2] Qin X, Wang S, Yu M, et al. Child skeletal fluorosis from indoor burning of coal in southwestern China [J]. J Environ Public Health, 2009, 2009: 969764.
[3] 王飞清, 余司文, 夏曙华, 等. 燃煤型氟中毒对雌鼠卵巢生殖功能影响 [J]. 中国公共卫生, 2015, 31(1): 76-79.
[4] 向程窈, 于燕妮, 陈荣, 等. Beclin-1、Bcl-2、Bax在慢性氟中毒大鼠肾脏中表达 [J]. 中国公共卫生, 2016, 32(6): 798-802.
[5] 王连方. 氟斑牙的几种“Dean氏分类法”浅析 [J]. 疾病预防控制通报, 2007, 22(1): 71-73.
[6] Barron MJ, Brookes SJ, Kirkham J, et al. A mutation in the mouse Amelx tri-tyrosyl domain results in impaired secretion of amelogenin and phenocopies human X-linked amelogenesis imperfecta [J]. Hum Mol Genet, 2010, 19(7): 1230-1247.
[7] 季伯, 刘建国, 王凯, 等. 燃煤型氟斑牙动物模型复制的研究现状 [J]. 口腔医学研究, 2014, 30(2): 180-182, 18.
[8] Everett ET, McHenry MA, Reynolds N, et al. Dental fluorosis: variability among different inbred mouse strains [J]. J Dent Res, 2002, 81(11): 794-798.
[9] Kierdorf U, Kierdorf H, Sedlacek F, et al. Structural changes in fluorosed dental enamel of red deer (CervuselaphusL.) from a region with severe environmental pollution by fluorides [J]. J Anat, 1996, 188(Pt 1): 183-195.
[10] 王光平, 刘建国, 李明霞, 等. 燃煤型氟斑牙动物模型复制方法的改进 [J]. 中国地方病防治杂志, 2013, 28(2): 88-92.
[11] 解瑞宁, 翟敏, 谢龙利, 等. 高氟地区学龄儿童氟斑牙与膳食因素关系 [J]. 中国公共卫生, 2010, 26(1): 13-14.
[12] 张莉, 余波, 朱新波, 等. 氟斑牙患病率和流行指数与水氟尿氟的多元线性分析 [J]. 中华地方病学杂志, 2004, 23(2): 170-171.
[13] 白生宾, 范淑玲, 罗学港, 等. 氟离子代谢趋势对氟斑牙形成影响 [J]. 中国公共卫生, 2011, 27(8): 1000-1001.
[14] 曾贝贝, 陈修文, 王楠兰, 等. 慢性氟中毒大鼠骨组织形态计量学改变及血清骨代谢标志物表达 [J]. 环境卫生学杂志, 2016, 6(2): 91-96.
[15] 殷黎静, 赵润, 周洁, 等. 慢性氟中毒对大鼠基础生长的影响及金属离子的拮抗作用 [J]. 实验动物科学, 2013, 30(4): 35-38.
[17] Iano FG, Ferreira MC, Quaggio GB, et al. Effects of chronic fluoride intake on the antioxidant systems of the liver and kidney in rats [J]. J Fluorine Chem, 2014, 168: 212-217.
[18] Czarnowski W, Wrzeniowska K, Krechniak J. Fluoride in drinking water and human urine in northern and central Poland [J]. Sci Total Environ, 1996, 191(1-2): 177-184.
[19] 廖敏如, 刘娟. 影响牙体组织氟吸收和蓄积相关因素探讨 [J]. 中国实用口腔科杂志, 2011, 4(4): 252-254.
[20] 郭生琼, 喻茂娟, 申惠鹏, 等. 复方中药对慢性氟中毒大鼠氟骨症的骨形态计量学影响 [J]. 现代预防医学, 2016, 43(8): 1471-1475.
[21] 桑志成, 周卫, 张兆杰, 等. 郭氏中药治疗中度地方性氟骨症X线改变的随机对照试验. 中国骨伤, 2010, 23(5): 379-382.
[22] 韩爱军, 刘盘龙, 梅予锋. 慢性氟中毒对大鼠硬组织氟含量的影响 [J]. 中国医药导报, 2013, 10(3): 29-30, 34.
[23] Richter H, Kierdorf U, Richards A, et al. Fluoride concentration in dentine as a biomarker of fluoride intake in European roe deer (Capreoluscapreolus)—An electron-microprobe study [J]. Arch Oral Biol, 2011, 56(8): 785-792.
[24] Denbesten P, Li W. Chronic fluoride toxicity: dental fluorosis [J]. Monogr Oral Sci, 2011, 22: 81-96.

