腺嘌呤诱导慢性肾脏病大鼠模型的骨与矿物质代谢异常
孟 彦,张 豪,贺 宁,石东英,李青南,赵建荣*,左 力
(1.内蒙古医科大学附属医院肾内科,呼和浩特 010050; 2.湖北医药学院口腔医学部,湖北 十堰 442000; 3.广东药科大学生命科学与生物制药学院,广州 510006; 4.广东实验动物监测所,广州 510663; 5.北京大学人民医院肾内科,北京 100044)
慢性肾脏病(chronic kidney disease,CKD)是指各种原因引起的超过三个月的肾脏结构和(或)功能异常,具有高患病率、持续存在和缓慢进展的特点。早在CKD第3期,肾脏的排磷功能就开始下降,随后出现进行性加重的骨及矿物质代谢紊乱相关并发症。在CKD第3~5期,大多数患者会出现肾性骨病[1]。肾性骨病使得CKD患者的骨折发生率升高[2],进而导致死亡率升高[3]。血管钙化也是CKD重要的矿物质代谢相关并发症之一,是CKD患者心血管死亡率和全因死亡率的独立预测因素[4]。目前将CKD时矿物质代谢相关血清标志物的异常、肾性骨病、血管钙化统称为慢性肾脏病骨及矿物质代谢异常(chronic kidney disease-mineral and bone disorder,CKD-MBD)[1]。
虽然CKD-MBD存在高患病率、高危害性的特点,但是目前对于CKD-MBD发病机理的了解非常有限,临床防治手段也不足,迫切需要加强该方面的研究。目前常用的动物模型有5/6肾切除模型、肾脏电烧模型等。上述模型存在的问题是多数对肾性骨病和血管钙化分别进行研究;进行肾性骨病研究时,很少有研究应用骨形态计量学的方法按照2009年国际肾脏病学会提出的用骨形态计量学的方法从骨转换、矿化、骨量(turnover, mineralization, volume;TMV)三个角度[5]进行分析。本研究采用腺嘌呤诱导的肾毒性大鼠模型,在同一模型上同时观察了CKD时的矿物质代谢相关生化标志物的变化情况、血管钙化情况,并从TMV角度观察了肾性骨病的特点,拟为后续开展的CKD-MBD发病机理及干预研究提供方法指导和基础数据。
1 材料和方法
1.1 实验动物
SPF级13周龄雄性SD大鼠20只,体重(408±10) g,购自北京维通利华实验动物有限公司 [SCXK (京) 2012-0001]。大鼠在北京大学医学部实验动物科学部 [SYXK (京) 2013-0032]饲养,环境温度(23±2) ℃,相对湿度60%~70%,光照12 h/12 h明暗交替,每笼4只饲养,并按照“3R”原则给予人道主义关怀。
1.2 主要试剂与仪器
腺嘌呤(源聚生物,上海);大鼠全段甲状旁腺激素(parathyroid hormone,PTH)ELISA试剂盒(Immutopics,美国)。RM2255型切片机(Leica,德国);SP1600型锯片机(Leica,德国);Bioquant-Osteo骨形态学图像分析系统(Bioquant,美国);QDR-Discovery骨密度仪(Hologic,美国);iCAP6300型等离子体发射光谱仪(Thermo,美国);Image-Pro Plus 5.1图像分析软件(Media Cybernetics,美国)。
1.3 实验方法
1.3.1 动物饲料成分
动物饲料由北京科澳协力饲料有限公司生产 [SCXK (京) 2014-0010],以AIN-93实验用啮齿动物纯化饲料配方[6]为基础调整,第一种为含有0.75%腺嘌呤的毒性饲料,第二种为不含腺嘌呤的饲料。两种饲料其他成分一致,均含钙1.11%,磷1.03%,酪蛋白9%。
1.3.2 动物实验方案
1周适应性饲养后将大鼠随机分为2组:①正常对照组(normal control group),喂以不含腺嘌呤的饮食,共6周;②慢性肾脏病组(CKD group),第1~4周喂以含有腺嘌呤的饮食,第5~6周喂以不含腺嘌呤的饮食。第2周末,静脉采血行血清生化标志物检测。第6周末,处死所有大鼠。留取血标本备血清生化标志物检测。完整分离主动脉备病理学检查和血管钙磷含量测定。分离双侧股骨及第五腰椎,左侧股骨用于骨形态计量学检测,右侧股骨和第五腰椎行骨密度(bone mineral density,BMD)检查。
1.3.3 生化标志物检测
血清肌酐、尿素氮、钙、磷由Hitachi 7170S生化分析仪检测。血清PTH检测采用美国Immutopics公司大鼠iPTH ELISA试剂盒。
1.3.4 血管病理学检查
截取从降主动脉起始部到腹主动脉腹腔干上缘位置部分,切成宽度为1.5~2 mm的血管环。经过包埋等处理,行von Kossa染色、伊红复染。用尼康E600显微镜相机对每一张病理切片进行拍照,用Image-Pro Plus 5.1软件对血管照片进行定量分析。将每只大鼠的每个血管截面的钙化面积数值相加作为分子,将每只大鼠的每个血管截面的总面积数值相加作为分母,得出每只大鼠的血管钙化面积百分比[7]。
1.3.5 血管钙、磷含量的测定
将从腹腔干起始位置到左右髂总动脉起始处主动脉充分干燥,称重。将标本用1 mL纯硝酸和0.1 mL纯高氯酸溶解,加热后变为结晶。超纯水溶解定容到2 mL后用iCAP6300型等离子体发射光谱仪测定血管钙磷含量。
1.3.6 BMD检测
应用QDR-Discovery型骨密度仪检测离体骨BMD。除测量整个股骨的平均BMD外,另外选择两个感兴趣区(region of interest,ROI)(图1),为近心端股骨干的皮质骨投影区(ROI 1)和远心端干骺端生长板上方的投影区(ROI 2)。ROI 1由皮质骨构成,ROI 2主要由松质骨组成。第五腰椎也行BMD检测。

注:ROI:感兴趣区。图1 股骨BMD检查感兴趣区Note. ROI, region of interest.Fig.1 ROIs of the femur for detection of bone mineral density (BMD)
1.3.7 骨形态计量学检测
分别将股骨干和股骨远心端干骺端后2/3部分投入4%多聚甲醛固定液固定,不脱钙用甲基丙烯酸甲酯包埋。将股骨远心端干骺端用Leica RM2255型切片机沿冠状面切片,4 μm厚切片甲苯胺蓝染色后测静态参数,8 μm厚切片不染色用以测动态参数,由Bioquant测量系统完成。用Leica SP1600锯型切片机将股骨小转子处的股骨干切成45 μm厚的横断面切片,测量股骨静态参数。所有骨组织形态学测定均基于标准化公式[8]。
1.4 统计学方法
2 结果
2.1 体重、生化结果及肾脏肉眼表现
大鼠体重正常对照组和CKD组采用连续测量的方差分析比较,P< 0.01(图2)。第2周末和第6周末,与正常对照组比较,CKD组的血肌酐、尿素氮、血磷和血PTH水平均显著升高,血钙水平明显降低(表1)。饲养中无大鼠死亡。肉眼见CKD组大鼠肾脏体积增大,颜色发白(图3B)。
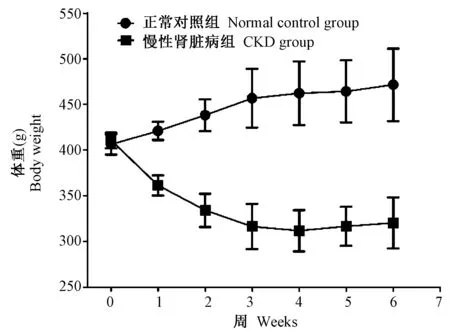
注:正常对照组和CKD组进行连续测量的方差分析,组间P< 0.01。图2 大鼠体重变化曲线Note. Repeated measure analysis of variance was used. Comparison between the normal control group and the CKD group, P < 0.01.Fig.2 Curves of body weight changes of the rats in each group
2.2 血管钙化面积百分比及钙磷含量测定结果
第6周末,CKD组发生血管钙化的主动脉血管变粗、弹性消失、表面部分区域颜色发黄,为钙化区域(图3D和3F),镜下见血管钙化主要发生在中膜(图4)。有50%的大鼠发生主动脉钙化。与正常对照组比较,CKD组的血管钙、磷含量及血管钙化面积百分比均明显升高(图5)。
2.3 BMD检测结果
与正常对照组比较,第6周末,CKD组各BMD检测指标均明显降低(图6)。
2.4 骨形态计量学测量结果
小梁骨骨形态计量学测量结果见表2。第6周末,CKD组的骨体积/组织体积(bone volume/tissue volume,BV/TV)、骨小梁厚度(trabecular thickness,Tb. Th)、骨小梁数目(trabecular number,Tb. N)较正常对照组明显降低,CKD组的骨小梁分离度(trabecular separation,Tb. Sp)较正常对照组明显升高。对于骨形成参数,CKD组的成骨细胞相关参数(osteoblast surface/millimeter of bone perimeter, Ob. S/BS; osteoblast number/millimeter of bone perimeter, N. Ob/BS)和骨形成率参数 [bone formation rate (bone surface referent), BFR/BS; bone formation rate (bone area referent), BFR/BV; bone formation rate (tissue area referent), BFR/TV]较正常对照组明显升高(P< 0.01);对于骨吸收参数,CKD组的破骨细胞相关参数(osteoblast surface/millimeter of bone perimeter, Oc. S/BS; osteoblast number/millimeter of bone perimeter, N. Oc/BS)较正常对照组明显升高。骨矿化方面,CKD组的矿化延迟时间(mineralization lag time,MLT)与正常对照组相比差异无显著性,CKD组的矿化成沉积率(mineralization apposition rate,MAR)和类骨质相关参数(osteoid surface/bone surface, OS/BS; osteoid volume/bone volume, OV/BV)较正常对照组明显升高。
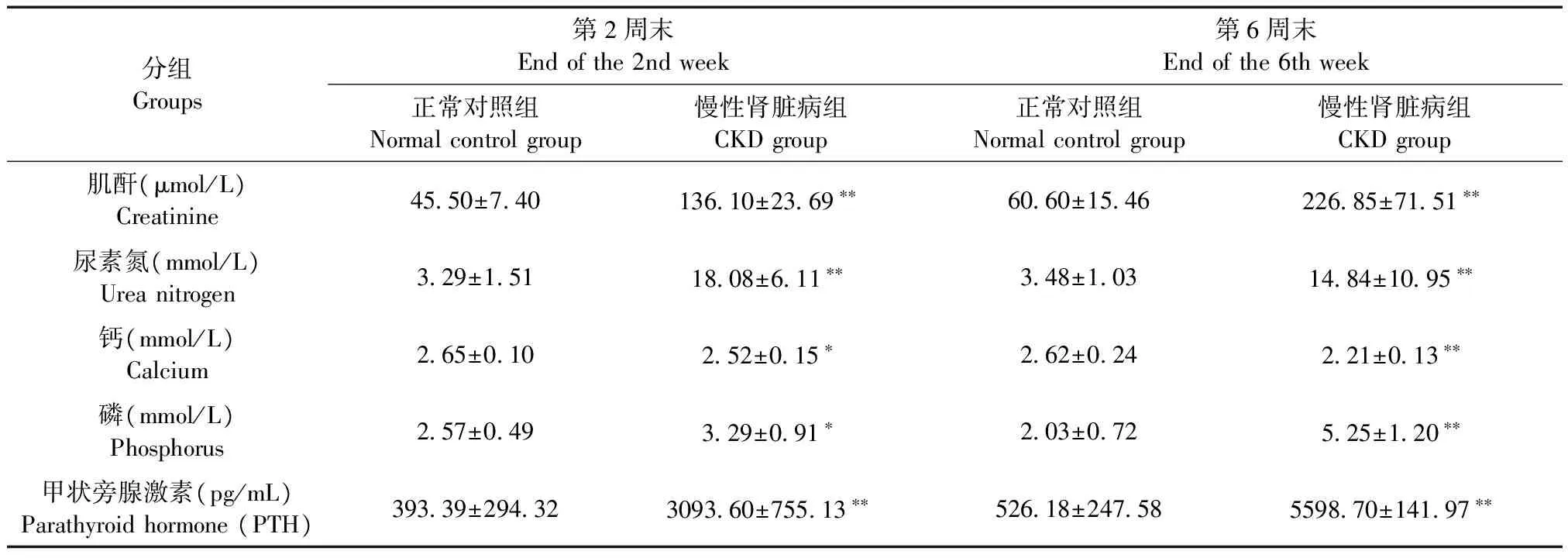
表1 血清生化标志物数据
注:与正常对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the normal control group,*P< 0.05,**P< 0.01.
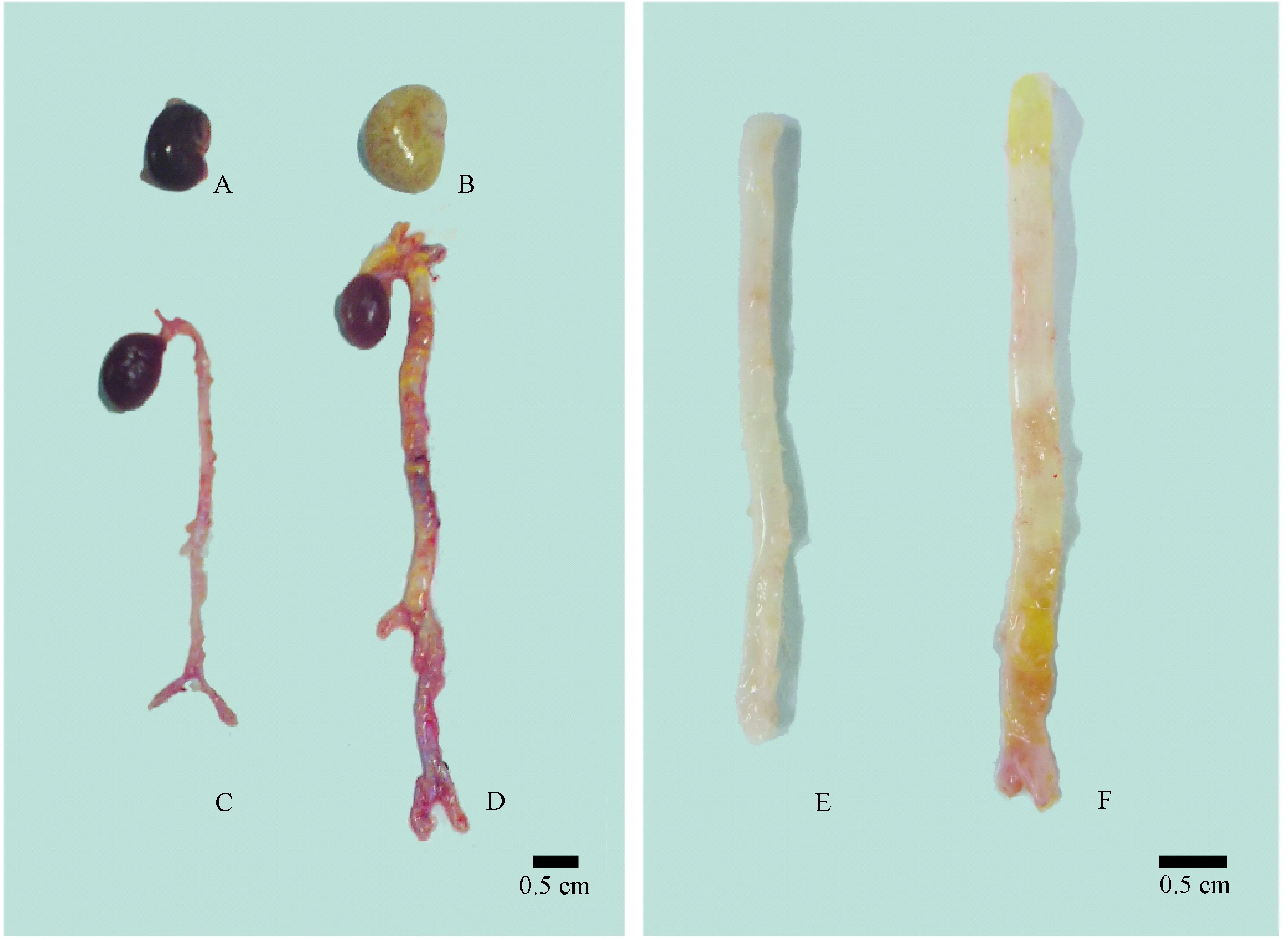
注:A和B:分别为正常对照组和CKD组大鼠肾脏;C和D:分别为正常对照组和CKD组大鼠心脏及主动脉;E和F:分别为正常对照组和CKD组大鼠降主动脉。图3 大鼠肾脏及主动脉Note. A and B: Kidneys of the rats in the normal control group and the CKD group, respectively. C and D: Hearts and aortas of the rats in the normal control group and the CKD group, respectively. E and F: Descending aortas of the rats in the normal control group and the CKD group, respectively.Fig.3 Gross appearance of kidneys and aortas of the rats in each group
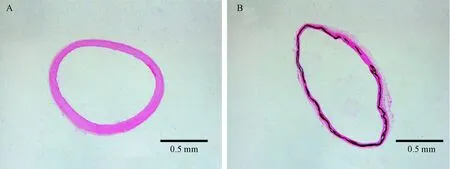
注:A:正常对照组;B:CKD组。黑色为钙化区域。图4 血管病理照片(× 20)Note. A: A control rat. B: A CKD rat. The black area is calcification.Fig.4 Cross sections of the rat aortas
皮质骨骨量相关参数见表3。与对照组比较,CKD组的皮质骨相关参数(cortical bone area, Ct. B. Ar; cortical bone area percentage, Ct. B. Ar%)均明显降低(P< 0.01)。CKD组大鼠皮质骨横截面可以见到大小不等的侵蚀小孔,正常对照组大鼠皮质骨截面上没有侵蚀小孔。定量测量侵蚀小孔相关参数(porosity area, Po. Ar; porosity area percentage, Po. Ar%),CKD组较正常对照组明显升高(P< 0.01)。
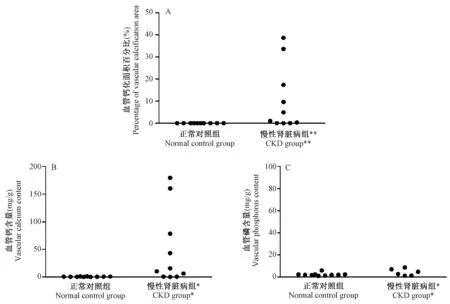
注:与正常对照组相比,* P< 0.05,** P< 0.01。图5 血管钙磷含量及血管钙化面积百分比Note. Compared with the normal control group,* P < 0.05,** P< 0.01.Fig.5 Vascular calcium and phosphorus contents and percentage of vascular calcification area
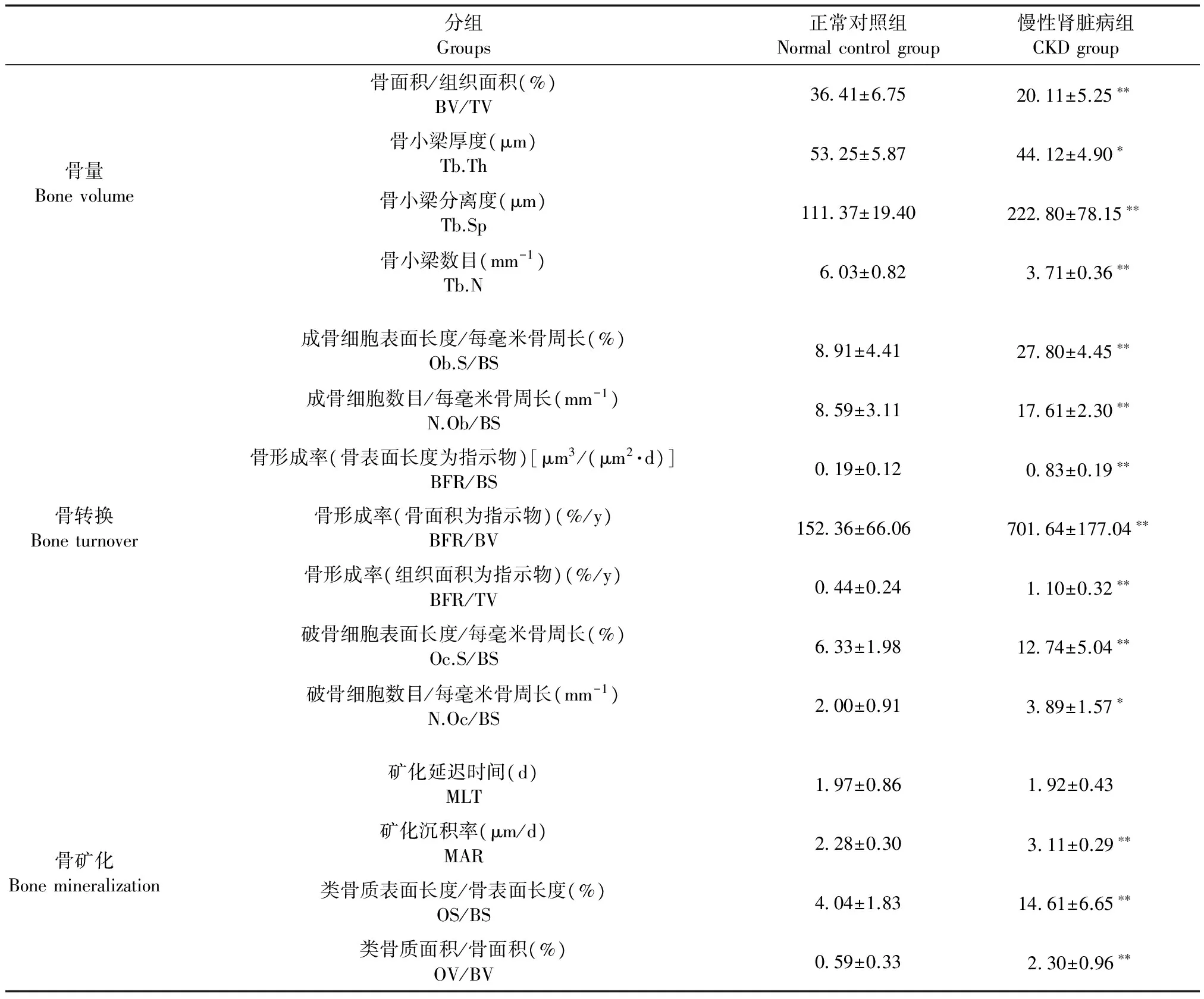
分组Groups正常对照组Normalcontrolgroup慢性肾脏病组CKDgroup骨量Bonevolume骨面积/组织面积(%)BV/TV3641±6.752011±5.25∗∗骨小梁厚度(μm)Tb.Th5325±5.874412±4.90∗骨小梁分离度(μm)Tb.Sp11137±19.4022280±78.15∗∗骨小梁数目(mm-1)Tb.N603±0.82371±0.36∗∗骨转换Boneturnover成骨细胞表面长度/每毫米骨周长(%)Ob.S/BS891±4.412780±4.45∗∗成骨细胞数目/每毫米骨周长(mm-1)N.Ob/BS859±3.111761±2.30∗∗骨形成率(骨表面长度为指示物)[μm3/(μm2·d)]BFR/BS019±0.12083±0.19∗∗骨形成率(骨面积为指示物)(%/y)BFR/BV15236±66.0670164±177.04∗∗骨形成率(组织面积为指示物)(%/y)BFR/TV044±0.24110±0.32∗∗破骨细胞表面长度/每毫米骨周长(%)Oc.S/BS633±1.981274±5.04∗∗破骨细胞数目/每毫米骨周长(mm-1)N.Oc/BS200±0.91389±1.57∗骨矿化Bonemineralization矿化延迟时间(d)MLT197±0.86192±0.43 矿化沉积率(μm/d)MAR228±0.30311±0.29∗∗类骨质表面长度/骨表面长度(%)OS/BS404±1.831461±6.65∗∗类骨质面积/骨面积(%)OV/BV059±0.33230±0.96∗∗
注:与正常对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the normal control group,*P< 0.05,**P< 0.01.
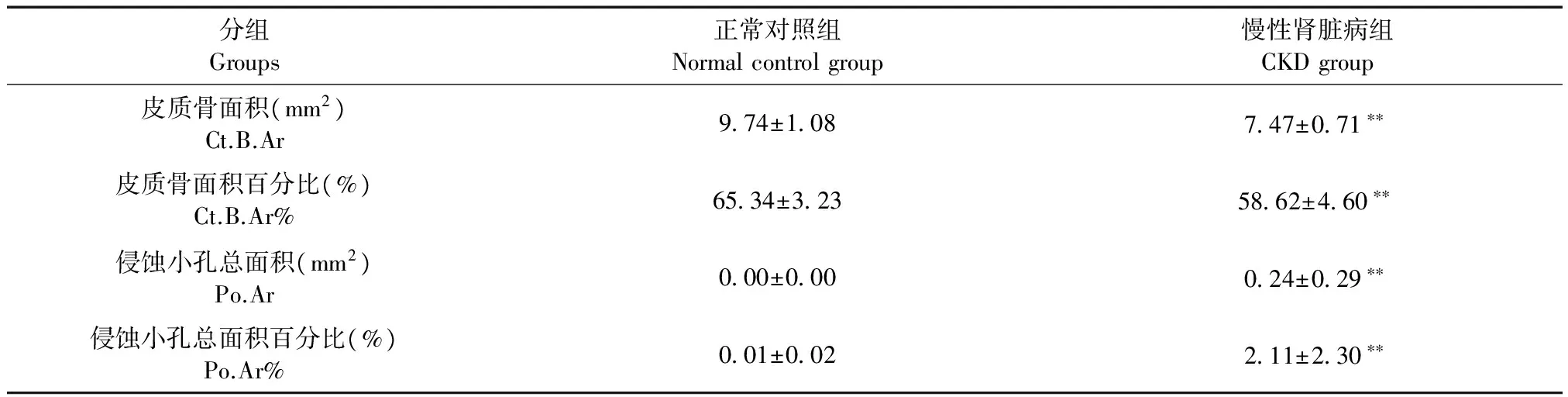
表3 皮质骨骨形态计量学测量结果
注:与正常对照组比较,**P< 0.01。
Note. Compared with the normal control group,**P< 0.01.
3 讨论
目前动物实验大多采用天然原料来源的配合饲料,缺点是各种主要营养素含量不稳定,一定程度造成不同实验间结果的差异。本研究以美国AIN-93实验用啮齿动物纯化饲料配方为基础[6],从饲料公司专门定制,饲料中各种营养成分含量稳定,保证了采用同一模型不同实验间结果的可比性。
本研究给大鼠进食含腺嘌呤的饲料后,腺嘌呤沉积在肾小管,引发急性肾损伤,进而转变为慢性肾脏病。从本研究第2周末和第6周末的生化数据看,随着慢性肾脏病的进展,血肌酐、尿素氮、血磷和血PTH均逐渐上升,血钙逐渐下降,和临床实际情况吻合良好。
CKD时的血管钙化主要有继发于动脉粥样硬化的内膜钙化和与动脉粥样硬化无关的中膜钙化。而在CKD第5期透析患者中,血管钙化的发生率大约为50%~80%[4]。本研究较好地模拟了动脉中膜钙化的情况,约有50%的大鼠发生中膜钙化。
对于肾性骨病,传统的分类方式是根据骨转换和骨矿化进行分类[5]。由于上述分类方法未考虑到骨量的改变,国际肾脏病学会推出了TMV分类法,即利用骨形态计量学的方法直接从骨转换、骨矿化及骨量三个角度对骨病进行评价[5]。本研究从TMV角度对骨病进行评价。从研究结果看,本CKD模型大鼠的骨转换处于高水平状态,即骨形成和骨吸收均处于高水平;CKD组大鼠的骨量明显减少,这也反映了虽然骨形成和骨吸收均处于高水平,但骨吸收程度大于骨形成程度。骨量减少临床上可以通过骨密度检查间接反映出来。本研究骨密度检查结果也和骨形态计量学的骨量检查结果吻合。矿化方面,如果直观地从本研究结果看存在矿化障碍,因为OS/BS和OV/BV均明显升高,但仔细分析,考虑矿化正常,因为矿化延迟时间没有变化,OS/BS和OV/BV升高可能是由于高骨形成率产生的大量类骨质未能及时矿化导致的[1]。上述骨形态计量学变化也符合旧分类法中轻微高甲状旁腺激素相关性骨病或纤维性骨炎的特点。
腺嘌呤诱导的慢性肾脏病大鼠模型能够较好地模拟临床上CKD-MBD的真实情况,矿物质代谢相关的生化标志物方面表现为低血钙、高血磷和高PTH;血管钙化表现为中膜钙化;肾性骨病方面表现为小梁骨高转换、正常矿化和低皮质骨和小梁骨骨量,也符合纤维性骨炎的特点。因此,腺嘌呤诱导的慢性肾脏病大鼠模型可以作为未来开展CKD-MBD研究的良好载体。
[1] Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) [J]. Kidney Int Suppl, 2009(113): S1-S130.
[2] Jadoul M, Albert JM, Akiba T, et al. Incidence and risk factors for hip or other bone fractures among hemodialysis patients in the Dialysis Outcomes and Practice Patterns Study [J]. Kidney Int, 2006, 70(7): 1358-1366.
[3] Mittalhenkle A, Gillen DL, Stehman-Breen CO. Increased risk of mortality associated with hip fracture in the dialysis population [J]. Am J Kidney Dis, 2004, 44(4): 672-679.
[4] Okuno S, Ishimura E, Kitatani K, et al. Presence of abdominal aortic calcification is significantly associated with all-cause and cardiovascular mortality in maintenance hemodialysis patients [J]. Am J Kidney Dis, 2007, 49(3): 417-425.
[5] Moe S, Drüeke T, Cunningham J, et al. Definition, evaluation, and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO) [J]. Kidney Int, 2006, 69(11): 1945-1953.
[6] Reeves PG, Nielsen FH, Fahey GC Jr. AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition Ad Hoc Writing Committee on the reformulation of the AIN-76A rodent diet [J]. J Nutr, 1993, 123(11): 1939-1951.
[7] Neven E, Dauwe S, De Broe ME, et al. Endochondral bone formation is involved in media calcification in rats and in men [J]. Kidney Int, 2007, 72(5): 574-581.
[8] Parfitt AM, Drezner MK, Glorieux FH, et al. Bone histomorphometry: standardization of nomenclature, symbols, and units. Report of the ASBMR Histomorphometry Nomenclature Committee [J]. J Bone Miner Res, 1987, 2(6): 595-610.

