脑内表达的CYP450基因参与内源性物质代谢研究进展
杨辛兰,吕 丹,张连峰
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫计委人类疾病比较医学重点实验室,北京 100021)
细胞色素P450(cytochrome P450,CYP450)为一类亚铁血红素蛋白超家族,由进化上保守的基因编码,广泛分布于植物、动物、真菌和部分细菌内,甚至病毒中,目前已经确定的CYP450蛋白已接近20万种[1-2]。目前在小鼠中已经发现103个CYPs,大鼠中已经发现89个CYPs[3]。人类CYP450基因包括18个家系,43个亚系,共57个基因和59个假基因。在小鼠、大鼠、兔和犬等常用哺乳类实验动物中,CYP450基因与人类更接近,但存在部分基因差异和表达谱差异,如CYP2D亚家族在大鼠中有6个同型(CYP2D1-5和CYP2D18),但在人类中只有CYP2D6一种有代表性的异形体[4],这也正是动物与人类对部分药物毒性反应不一致的原因之一。大部分CYP450蛋白具有单加氧酶活性,参与多种内源性物质和外源性物质(食物成分、药物及污染物等)的代谢与活化。因为CYP450是药物代谢的关键酶,与药物有效性及毒性等关系密切,所以以往的研究主要集中在药物代谢方面。
近几年的研究发现,CYP450的作用不仅仅局限于药物代谢,其还参与多种疾病的发生及发展过程,CYP450基因介导的机体内源物质代谢涉及阿尔茨海默病(Alzheimer’s disease,AD)、帕金森氏病(Parkinson’s disease,PD)、雷夫叙姆病(Refsum disease,RD)、白质营养不良(X-linked adrenoleukodystrophy,X-ALD)等疾病[5-7]。因此,CYP450家族成员对机体内源物质的代谢及其病理生理功能,已逐渐引起学者的广泛关注。所以本文特总结了脑内表达的CYP450基因及其参与酮体、脂肪酸,固醇类激素及其他内源性物质代谢的研究进展。
1 脑内表达的CYP450基因
在哺乳动物细胞中,CYP450成员主要分布在微粒体、内质网和线粒体内膜上,其中CYP2E1在微粒体、内质网和线粒体内膜上都有分布。CYP450可分为微粒体CYP450系统和线粒体CYP450系统。其中,微粒体CYP450需要一类P450还原酶的协助来完成电子传递过程,而线粒体CYP450系统需要一类皮质铁氧蛋白协助来完成电子传递过程,二者都需要氧气和NADPH,总反应式如下:
RH+O2+NADPH+H+→ROH+H2O+NADP+
CYP450基因在多种组织中表达,且同一个基因在不同物种中的组织分布有一定的差异性。根据人类、小鼠、大鼠和犬的相关研究数据,CYP1A、CYP1B、CYP2B、CYP2C、CYP2D、CYP2E1、CYP2J、CYP2U、CYP3A及CYP4A等基因在脑组织中表达[8-10]。部分基因在脑中广泛表达,且不同区域表达水平不同。而另一部分基因具有区域表达特异性,例如CYP2B在皮层的星型胶质细胞高表达,CYP2D在锥体神经元表达,CYP2D6主要在颗粒层表达等。
除了参与抗抑郁类,抗精神病类及止痛类等相关药物的代谢过程,以及参与外源物代谢而产生神经毒性作用外,脑内表达的CYP450基因还参与酮体、脂肪酸、固醇类激素及神经递质等内源物质的代谢过程。
2 脑内CYP450基因与酮体代谢
丙酮是酮体的主要成分,体外研究证实,脑组织内CYP2E1和CYP3A可以将丙酮转化为丙酮醇,进而转化为丙酮醛[11]。反应式如下:
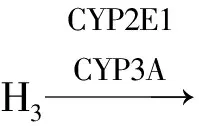
丙酮醇和丙酮醛都可进入到糖异生途径,研究表明将小鼠的CYP2E1基因敲除,会造成丙酮代谢障碍,并引起血液中丙酮的积累[12]。
在生理状态下,脑内主要能量来源是葡萄糖。但在病理状态下,例如阿尔茨海默病(Alzheimer’s disease,AD)发病早期,脑内普遍存在葡萄糖代谢率减退现象,而此时酮体成为AD脑组织的替代能源[6]。所以,酮体代谢与AD脑组织的神经元能量供应关系极为密切。此外,研究表明,酮体具有抗惊厥作用,生酮饮食是目前控制难治性癫痫的一种重要方法[13-14]。酮体代谢并不仅仅是能量代谢的基础,因为酮体在许多组织中也可以作为脂质和甾醇生物合成的基质,包括发育中的大脑、哺乳期的乳腺和肝脏[15]。
3 脑内CYP450基因与脂肪酸代谢
脂肪酸在C-端的ω-羟化(ω-hydroxylation)是CYP450催化的一类氧化反应,形成单羟或二羟脂肪酸,随后进入β-氧化途径产生乙酰辅酶A,乙酰辅酶A进入三羧酸循环产生ATP。所以脂肪酸在ω-羟化是脂肪酸代谢的关键环节,同时可防止一些脂肪酸毒性[16]。在人类、小鼠、大鼠、兔和犬等常用哺乳类实验动物中,CYP450催化的ω-羟化反应涉及月桂酸、花生四烯酸、十八炔酸等几乎所有脂肪酸[17]。
脑组织内的CYP2E1、CYP2J、CYP2U、CYP3A及CYP4A参与脂肪酸的ω-羟化反应和环氧化反应。以花生四烯酸和花生四烯酸衍生物为例,CYP2J2是主要的花生四烯酸表氧化酶[18],可以催化花生四烯酸的5~6位、8~9位、11~12位和14~15位碳原子氧化,形成不同位置的环氧二十碳三烯酸(EETs)。CYP2E1、CYP2U、CYP3A和CYP4A都有脂肪酸C-端ω-羟化活性,可以催化花生四烯酸、环氧二十碳三烯酸、5-羟花生四烯酸、白三烯及脂氧素等花生四烯酸衍生物的20位碳原子的羟化[19-20]。
脂肪酸的羟化除了促进脂肪酸代谢产生能量之外,还参与脂类生物活性物质的合成与代谢,例如,维生素A、E、K,大麻素,花生四烯酸,环氧二十碳三烯酸及白三烯等物质的代谢,调节血管离子转运、睡眠、神经炎症等病理生理过程。其中CYP3A和CYP4A对花生四烯酸为原料的生物活性物质的合成尤为关键。
4 脑内CYP450基因与固醇类激素代谢
CYP450主要通过胆固醇的侧链断裂酶活性将胆固醇转化为孕烯醇酮,再通过11、18及21位碳原子羟化和18位甲基氧化等步骤参与固醇类激素的合成,包括26种雄激素、雌激素、孕酮及肾上腺皮质激素等。在肾上腺和性腺中表达的CYP11A1、CYP11B1、CYP11B2、CYP17A1、CYP21A1及CYP19 A等是参与固醇类激素合成的主要CYP450成员[21-23]。
脑组织中表达的CYP1A、CYP1B、CYP2B、CYP2C和CYP2D也具有固醇类激素的羟化酶活性[24-25]。其中CYP2C和CYP2D在脑中对固醇类激素代谢的作用研究较多[26-27]。CYP1A、CYP1B及CYP2B等在脑组织中对固醇类激素代谢的研究相对较少[23],今后需要更精细的生化研究,以阐明CYP1A、CYP1B及CYP2B对固醇类激素代谢的具体作用环节和生理作用。
5 CYP450基因与其他内源性物质代谢
多巴胺是哺乳动物大脑中主要的儿茶酚胺类神经递质,合成多巴胺的脑区及其纤维投射组成四条通路:①黑质纹状体束;②中脑边缘系统束;③中脑皮质束;④结节漏斗束。多巴胺对运动控制起重要作用,帕金森病(Parkinson’s disease,PD)是由于多巴胺能神经元变性引起严重的多巴胺减少所致。在经典途径中,多巴胺是由苯丙氨酸合成的,它通过苯丙氨酸羟化酶转化成酪氨酸,然后被酪氨酸羟化酶转化为二羟基苯丙氨酸(L-DOPA);后者被芳香氨基酸脱羧酶转化为多巴胺[28]。然而,除这条途径外,CYP2D与内源性化合物的代谢有关,如花生四烯酸乙醇胺和神经递质[29-31],可以将酪胺转化为多巴胺,被报道为帕金森氏病[7]和精神疾病的危险因素[32]。大脑中CYP2D活动最活跃的时刻是PD患者的黑质纹状体路径开始时达到的[33]。另外研究表明,CYP2E1可以调节多巴胺释放和自由基生成[34]。
脑血清素与精神疾病(如抑郁症、焦虑及精神分裂症)的病理生理学以及精神类药物(如抗抑郁药物、抗焦虑药物及抗精神病药物)的作用机制有关[35]。研究表明,血清素可能由5-甲氧色胺在大鼠脑微粒体O-去甲基化产生,CYP2D亚型(2D1/2/4/D18)能催化该反应,使褪黑激素-血清素的循环关闭。因此,大脑CYP2D可能会积极地影响吲哚胺和褪黑素的正常水平,两者都具有抗抑郁性[36]。目前认为,酒精或尼古丁可以诱导脑内CYP2D6[37-38],CYP2D6多态可能影响人的性格特征[39],Miller等研究了慢性乙醇自我管理和尼古丁治疗对非洲绿猴CYP2D表达的独立和综合作用[40],发现在猴子体内,乙醇和尼古丁会增加大脑CYP2D蛋白水平,提示神经退行性疾病和人格可能会受到饮酒和尼古丁的影响,表明CYP2D在大脑内源性神经活动基质的新陈代谢方面的重要性。
综上,神经退行性变是对人类威胁最大的中枢神经系统疾病,PD和AD是其中最主要的两种。PD是黑质多巴胺分泌神经元丢失引起运动障碍的一类疾病,而CYP2D6基因异常是PD的危险因素,CYP2D6可能是PD的保护因子[41-42]。AD是一种常见的中枢神经系统退行性疾病,临床表现为进行性记忆减退和认知障碍,主要神经病理表现为大脑皮质萎缩,神经细胞丧失,细胞外存在大量由淀粉样蛋白组成的老年斑(senile plaques,SP)以及神经细胞内神经纤维丝缠结。目前,更多的学者倾向认为AD是代谢性疾病,其中CYP19、CYP46、CYP2J、CYP17及CYP2D等基因多态性与AD易感性有关[43-47]。
总之,CYP450基因对脑组织内源物质代谢的作用体现在外源药物、毒性物质代谢、能量代谢及生物活性物质代谢等多个层面上[8,15,18,24,26,34,39,48-49]。然而,关于CYP450在脑组织中对内源物质代谢的作用,目前我们的了解还很肤浅,尤其是在酮体代谢和脂肪酸氧化对能量供应的影响方面,更需要建立全面的基因工程修饰动物模型工具,同时结合生物化学和病理学分析手段,深入研究CYP450在脑组织中的作用机制。这些研究皆有助于我们对于AD及PD等退行性神经系统疾病的了解和治疗。
[1] Danielson PB. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans [J]. Curr Drug Metab, 2002, 3(6): 561-597.
[2] Lamb DC, Lei L, Warrilow AG, et al. The first virally encoded cytochrome P450 [J]. J Virol, 2009, 83(16): 8266-8269.
[3] Nelson DR, Zeldin DC, Hoffman SM, et al. Comparison of cytochrome P450 (CYP) genes from the mouse and human genomes, including nomenclature recommendations for genes, pseudogenes and alternative-splice variants [J]. Pharmacogenetics, 2004, 14(1): 1-18.
[4] Chow T, Imaoka S, Hiroi T, et al. Developmental changes in the catalytic activity and expression of CYP2D isoforms in the rat liver [J]. Drug Metab Dispos, 1999, 27(2): 188-192.
[5] Edson KZ, Rettie AE. CYP4 enzymes as potential drug targets: focus on enzyme multiplicity, inducers and inhibitors, and therapeutic modulation of 20-hydroxyeicosatetraenoic acid (20-HETE) synthase and fatty acid ω-hydroxylase activities [J]. Curr Top Med Chem, 2013, 13(12): 1429-1440.
[6] Moya-Alvarado G, Gershoni-Emek N, Perlson E, et al. Neurodegeneration and Alzheimer’s disease (AD). What can proteomics tell us about the Alzheimer’s brain? [J]. Mol Cell Proteomics, 2016, 15(2): 409-425.
[8] Stamou M, Wu X, Kania-Korwel I, et al. Cytochrome P450 mRNA expression in the rodent brain: species-, sex-, and region-dependent differences [J]. Drug Metab Dispos, 2014, 42(2): 239-244.
[9] Ferguson CS, Tyndale RF. Cytochrome P450 enzymes in the brain: emerging evidence of biological significance [J]. Trends Pharmacol Sci, 2011, 32(12): 708-714.
[10] Meyer RP, Gehlhaus M, Knoth R, et al. Expression and function of cytochrome P450 in brain drug metabolism [J]. Curr Drug Metab, 2007, 8(4): 297-306.
[11] Koop DR, Casazza JP. Identification of ethanol-inducible P-450 isozyme 3a as the acetone and acetol monooxygenase of rabbit microsomes [J]. J Biol Chem, 1985, 260(25): 13607-13612.
[12] Bondoc FY, Bao Z, Hu WY, et al. Acetone catabolism by cytochrome P450 2E1: studies with CYP2E1-null mice [J]. Biochem Pharmacol, 1999, 58(3): 461-463.
[13] Lima PA, Sampaio LP, Damasceno NR. Neurobiochemical mechanisms of a ketogenic diet in refractory epilepsy [J]. Clinics (Sao Paulo), 2014, 69(10): 699-705.
[14] Ruskin DN, Masino SA. The nervous system and metabolic dysregulation: Emerging evidence converges on ketogenic diet therapy [J]. Front Neurosci, 2012, 6: 33.
[15] Morris AA. Cerebral ketone body metabolism [J]. J Inherit Metab Dis, 2005, 28(2): 109-121.
[16] Johnson AL, Edson KZ, Totah RA, et al. Cytochrome P450ω-hydroxylases in inflammation and cancer [J]. Adv Pharmacol, 2015, 74: 223-262.
[17] Draye JP, Vamecq J. The gluconeogenicity of fatty acids in mammals [J]. Trends Biochem Sci, 1989, 14(12): 478-479.
[18] Konkel A, Schunck WH. Role of cytochrome P450 enzymes in the bioactivation of polyunsaturated fatty acids [J]. Biochim Biophys Acta, 2011, 1814(1): 210-222.
[19] Gandhi AV, Saxena S, Relles D, et al. Differential expression of cytochrome P450 omega-hydroxylase isoforms and their association with clinicopathological features in pancreatic ductal adenocarcinoma [J]. Ann Surg Oncol, 2013, 20(Suppl 3): S636-S643.
[20] Chuang SS, Helvig C, Taimi M, et al. CYP2U1, a novel human thymus- and brain-specific cytochrome P450, catalyzes ω- and (ω-1)-hydroxylation of fatty acids [J]. J Biol Chem, 2004, 279(8): 6305-6314.
[21] Niwa T, Murayama N, Imagawa Y, et al. Regioselective hydroxylation of steroid hormones by human cytochromes P450 [J]. Drug Metab Rev, 2015, 47(2): 89-110.
[22] Luu-The V. Assessment of steroidogenesis and steroidogenic enzyme functions [J]. J Steroid Biochem Mol Biol, 2013, 137: 176-182.
[23] Moon JY, Kang SM, Lee J, et al. GC-MS-based quantitative signatures of cytochrome P450-mediated steroid oxidation induced by rifampicin [J]. Ther Drug Monit, 2013, 35(4): 473-484.
[24] Hedlund E, Gustafsson JA, Warner M. Cytochrome P450 in the brain; a review [J]. Curr Drug Metab, 2001, 2(3): 245-263.
[25] Ferguson CS, Tyndale RF. Cytochrome P450 enzymes in the brain: emerging evidence of biological significance [J]. Trends Pharmacol Sci, 2011, 32(12): 708-714.
[26] Wang X, Li J, Dong G, et al. The endogenous substrates of brain CYP2D [J]. Eur J Pharmacol, 2014, 724: 211-218.
[27] Lee AJ, Cai MX, Thomas PE, et al. Characterization of the oxidative metabolites of 17β-estradiol and estrone formed by 15 selectively expressed human cytochrome P450 isoforms [J]. Endocrinology, 2003, 144(8): 3382-3398.
[28] Hiroi T, Imaoka S, Funae Y. Dopamine formation from tyramine by CYP2D6 [J]. Biochem Biophys Res Commun, 1998, 249(3): 838-843.
[29] Snider NT, Sikora MJ, Sridar C, et al. The endocannabinoid anandamide is a substrate for the human polymorphic cytochrome P450 2D6 [J]. J Pharmacol Exp Ther, 2008, 327(2): 538-545.
[30] Ozdemir V, Gunes A, Dahl ML, et al. Could endogenous substrates of drug-metabolizing enzymes influence constitutive physiology and drug target responsiveness? [J]. Pharmacogenomics, 2006, 7(8): 1199-1210.
[31] Yu AM, Idle JR, Herraiz T, et al. Screening for endogenous substrates reveals that CYP2D6 is a 5-methoxyindolethylamine O-demethylase [J]. Pharmacogenetics, 2003, 13(6): 307-319.
[32] Kohlrausch FB, Gama CS, Lobato MI, et al. Molecular diversity at the CYP2D6 locus in healthy and schizophrenic southern Brazilians [J]. Pharmacogenomics, 2009, 10(9): 1457-1466.
[33] Bromek E, Haduch A, Daniel WA. The ability of cytochrome P450 2D isoforms to synthesize dopamine in the brain: aninvitrostudy [J]. Eur J Pharmacol, 2010, 626(2-3): 171-178.
[34] Shahabi HN, Andersson DR, Nissbrandt H. Cytochrome P450 2E1 in the substantia nigra: relevance for dopaminergic neurotransmission and free radical production [J]. Synapse, 2008, 62(5): 379-388.
[35] Waider J, Araragi N, Gutknecht L, et al. Tryptophan hydroxylase-2 (TPH2) in disorders of cognitive control and emotion regulation: a perspective [J]. Psychoneuroendocrinology, 2011, 36(3): 393-405.
[36] Haduch A, Bromek E, Sadakierska-Chudy A, et al. The catalytic competence of cytochrome P450 in the synthesis of serotonin from 5-methoxytryptamine in the brain: aninvitrostudy [J]. Pharmacol Res, 2013, 67(1): 53-59.
[37] Yue J, Miksys S, Hoffmann E, et al. Chronic nicotine treatment induces rat CYP2D in the brain but not in the liver: an investigation of induction and time course [J]. J Psychiatry Neurosci, 2008, 33(1): 54-63.
[38] Mann A, Miksys S, Lee A, et al. Induction of the drug metabolizing enzyme CYP2D in monkey brain by chronic nicotine treatment [J]. Neuropharmacology, 2008, 55(7): 1147-1155.
[39] González I, Peas-Lledó EM, Pérez B, et al. Relation between CYP2D6 phenotype and genotype and personality in healthy volunteers [J]. Pharmacogenomics, 2008, 9(7): 833-840.
[40] Miller RT, Miksys S, Hoffmann E, et al. Ethanol self-administration and nicotine treatment increase brain levels of CYP2D in African green monkeys [J]. Br J Pharmacol, 2014, 171(12): 3077-3088.
[41] Elbaz A, Levecque C, Clavel J, et al. CYP2D6 polymorphism, pesticide exposure, and Parkinson’s disease [J]. Ann Neurol, 2004, 55(3): 430-434.
[42] Mann A, Miksys SL, Gaedigk A, et al. The neuroprotective enzyme CYP2D6 increases in the brain with age and is lower in Parkinson’s disease patients [J]. Neurobiol Aging, 2012, 33(9): 2160-2171.
[43] Garcia AN, Muniz MT, Souza e Silva HR, et al. Cyp46 polymorphisms in Alzheimer’s disease: a review [J]. J Mol Neurosci, 2009, 39(3): 342-345.
[44] Butler HT, Warden DR, Hogervorst E, et al. Association of the aromatase gene with Alzheimer’s disease in women [J]. Neurosci Lett, 2010, 468(3): 202-206.
[45] Yan H, Kong Y, He B, et al.CYP2J2 rs890293 polymorphism is associated with susceptibility to Alzheimer’s disease in the Chinese Han population [J]. Neurosci Lett, 2015, 593: 56-60.
[46] Corbo RM, Gambina G, Broggio E, et al. Association study of two steroid biosynthesis genes (COMT and CYP17) with Alzheimer’s disease in the Italian population [J]. J Neurol Sci, 2014, 344(1-2): 149-153.
[47] Lu Y, Qin X, Li S, et al. Quantitative assessment of CYP2D6 polymorphisms and risk of Alzheimer’s disease: a meta-analysis [J]. J Neurol Sci, 2014, 343(1-2): 15-22.
[48] Xing Y, Jia JP, Ji XJ, et al. Estrogen associated gene polymorphisms and their interactions in the progress of Alzheimer’s disease [J]. Prog Neurobiol, 2013, 111: 53-74.
[49] Li L, Yin Z, Liu J, et al.CYP46A1 T/C polymorphism associated with theAPOEε4 allele increases the risk of Alzheimer’s disease [J]. J Neurol, 2013, 260(7): 1701-1708.

