帕金森病伴发睡眠障碍的临床特点、相关因素及视频多导睡眠图的变化
郭鹏 余舒扬 左丽君 刘丽 李丽霞 朴英善 扈杨连腾宏 王瑞丹 余秋瑾 金朝 朱荣彦 张巍
帕金森病(Parkinson disease,PD)是一种常见的神经变性疾病,路易小体形成为其病理特征,运动症状包括静止性震颤、运动迟缓、肌强直及姿势步态异常等,非运动症状包括睡眠障碍(sleep disorders,SD)、神经精神症状、自主神经功能紊乱及感觉异常等,随疾病进展,非运动症状成为影响患者生活质量的重要因素[1]。SD是PD患者常见的非运动症状[2],可出现在病程的任何阶段[3],并随病情的进展而逐渐加重[4],已成为神经病学与睡眠医学关注的焦点。本研究总结分析PD伴SD患者的临床特点、相关因素、视频多导睡眠图(video-polysomnography,v-PSG)变化及其对患者生活质量的影响,旨在为PD-SD的早期诊断和治疗提供临床依据。
1 对象和方法
1.1对象连续选取2014-06—2016-06就诊于北京天坛医院老年病科的PD患者94例。所有患者符合1992年英国PD脑库原发性PD的诊断标准[5]:(1)PD综合征的诊断标准:1)运动迟缓(随意运动、进行性语言和重复动作幅度变小);2)至少符合下列表现之一:肌强直、4~6 Hz静止性震颤及姿势不稳(并非由视觉、前庭功能、小脑或本体感觉障碍引起)。(2)PD的排除诊断标准:反复脑卒中史导致的PD样症状阶梯性加重;反复头部外伤史;动眼危象;明确脑炎病史;症状出现前有镇静药物治疗史;患病亲属超过1人;症状持续缓解;3年后仍表现为严格单侧症状;核上性凝视麻痹;小脑症状;早期严重的自主神经功能障碍;早期严重的痴呆、记忆、语言和行为异常;Babinski征阳性;头CT检查发现有小脑肿瘤或交通性脑积水;大剂量左旋多巴治疗无反应(排除吸收不良);1-甲基-4-苯基-1,2,3,6-四氢吡啶接触史。(3)PD诊断确立的支持诊断标准(确诊PD需满足3条或以上):单侧起病;存在静止性震颤;进行性病程;症状长期不对称,起病一侧症状最明显;对左旋多巴反应良好(70%~100%);左旋多巴诱导的舞蹈症;对左旋多巴有反应持续5年或以上;临床病程10年或以上。
1.2方法
1.2.1一般资料:记录患者的人口学资料,包括性别、年龄、起病年龄、受教育水平及病程。
1.2.2运动功能:采用统一帕金森病评分量表第三部分(Unified Parkinson disease rating scale,part Ⅲ,UPDRS-Ⅲ)于开期评估患者的运动症状。UPDRS-Ⅲ分值越高代表患者的运动症状越严重。
1.2.3非运动症状:采用蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)及简易精神状态检查量表(mini-mental state examination,MMSE)评估患者的认知功能,采用汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评估患者的抑郁状况,采用汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)-14项版本评估患者的焦虑状况,采用爱泼沃斯思睡量表(Epworth sleeping scale,ESS)评估患者日间思睡程度,采用疲劳严重度量表(fatigue severity scale,FSS)评估患者的疲劳严重程度。上述量表评分越高表示相应症状越重。
1.2.4日常生活能力(activity of daily living,ADL):采用UPDRS-Ⅱ量表和ADL量表评价PD患者的ADL,分值越高代表PD患者的ADL越差。
1.2.5生活质量:采用39项PD生活质量问卷(Parkinson disease quality of life questionnaire-39,PDQL-39)评估患者的生活质量,分值越高代表PD患者的日常生活质量越差。
1.2.6睡眠质量:(1)采用匹茨堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)量表对PD患者的总体睡眠质量进行评价。PSQI量表包括7个因子,分别为主观睡眠质量、睡眠潜伏期、睡眠时间、睡眠效率、SD、使用睡眠药及日间功能障碍,各因子评分0~3分,总分0~21分,分值越高代表睡眠质量越差。根据PSQI评分将患者分为PD-SD组(PSQI≥5分)及PD不伴发SD组(PD-NSD组,PSQI<5分)。
(2)v-PSG监测:应用日本光电(Nihon Kohden)多导睡眠图仪(型号1518K)监测PD患者的睡眠结构、睡眠效率、醒觉指数和睡眠中呼吸情况等客观指标[6]。包括脑电图〔根据国际10-20系统安装电极,分为C3、A2、C4-A1、O1-A2、O2-A1)、眼电图、心电图、鼾声、口鼻气流量(压力式及热敏式)、胸腹式呼吸、体位和指端血氧饱和度等〕。睡眠监测前l周停用兴奋、催眠类药物,按平时睡眠时间提前1 h进入睡眠监测室,由专科护士及技师向患者进行监测前宣教,熟悉睡眠监测环境、检查目的和方法,解除患者紧张心理。观察患者总睡眠时间、入睡潜伏期、快速眼动睡眠潜伏期、睡眠效率、觉醒次数、低通气指数、低通气次数、呼吸暂停次数和最低血氧饱和度。
1.3统计学处理采用SPSS 20.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,均数间比较采用t检验。计数资料采用χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1各组人口学资料比较PD-SD患者共57例(60.64%);PD-NSD患者共37例(39.36%)。PD-SD组和 PD-NSD组在性别、年龄、起病年龄、受教育水平及病程方面比较均无统计学差异(P>0.05)。结果见表1。
2.2PD患者SD表现PD-SD组和PD-NSD组主观睡眠质量、睡眠潜伏期、睡眠时间、睡眠效率、SD、使用睡眠药及日间功能障碍方面比较均具有统计学差异(P<0.05)。结果见表2。
2.3运动症状比较PD-SD组和PD-NSD组UPDRSⅢ评分比较无统计学差异〔(19.12±2.604)分比(19.04±1.852)分,P=0.9840〕。
2.4非运动症状评分比较PD-SD组UPDRSⅠ、HAMD、HAMA、ESS及FSS量表评分均显著高于PD-NSD组(表3)。
2.5各组ADL比较PD-SD组UPDRSⅡ评分及ADL量表评分显著高于PD-NSD组(表3)。
2.6各组生活质量比较PD-SD组PDQ-39量表评分显著高于PD-NSD组(表3)。
2.7各组v-PSG参数比较完成v-PSG检测的PD患者32例,其中PD-SD组21例,PD-NSD组11例。与PD-NSD组比较,PD-SD组总睡眠时间减少,睡眠效率降低,最低血氧饱和度降低(均P<0.05)。结果见表4。
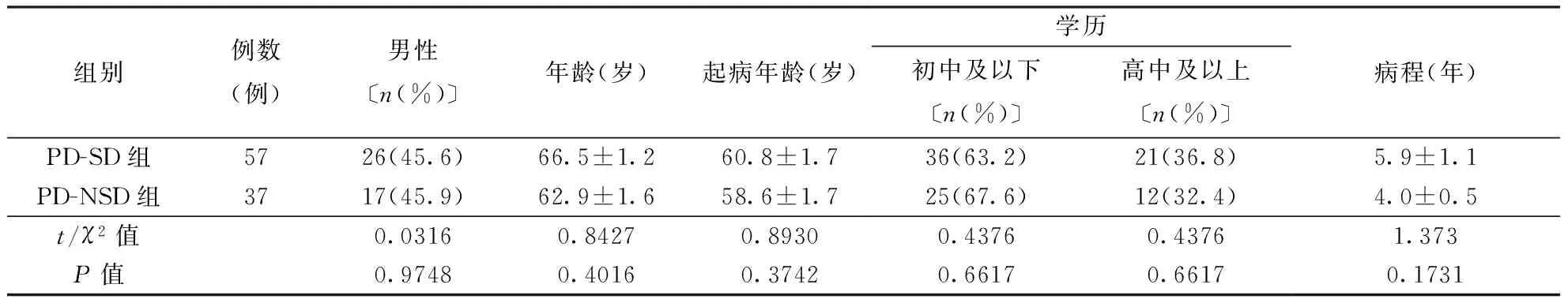
表1 两组人口学资料比较
注:PD-SD:帕金森病伴睡眠障碍,PD-NSD:帕金森病未伴睡眠障碍;表2~4同
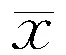
表2 两组PSQI量表评分比较(±s)
注:PSQI:匹茨堡睡眠质量指数;SD:睡眠障碍
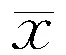
表3 两组PD患者非运动症状及ADL评分比较(±s)
注:UPDRS-Ⅰ:统一帕金森病评分量表第一部分;MMSE:简易精神状态检查量表;MoCA:蒙特利尔认知评估量表;HAMD:汉密尔顿抑郁量表;HAMA:汉密尔顿焦虑量表;ESS:爱泼沃斯思睡量表;FSS:疲劳严重度量表;UPDRS-Ⅱ:统一帕金森病评分量表第二部分;ADL:日常生活能力;PDQ-39:39项帕金森病生活质量问卷
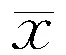
表4 各组患者v-PSG参数比较(±s)
注:v-PSG:视频多导睡眠图;REM:快速眼动睡眠
3 讨论
有研究报道约40%的老年人有不同程度的SD,伴有躯体和情绪障碍的患者SD更多见[7]。PD患者既有运动障碍,又常伴有情绪障碍,更容易出现SD。本研究结果显示,PD-SD组和PD-NSD组间性别构成、年龄、病程、学历等比较无统计学差异,提示性别、病程等与PD-SD的发病无相关性。
目前,关于PD-SD发生率的研究结果存在差异,有研究认为PD-SD发生率为100%,也有研究报道PD-SD发生率为54%~60%,日间睡眠增多发生率约占50%[8-10]。这可能与各研究采用的SD诊断标准、睡眠评价量表及观察人群不同有关。本研究94例患者中,采用PSQI量表进行检测发现57例患者符合DSM-Ⅳ关于SD的诊断标准,PD-SD的发生率为60.64%。
本研究结果显示,PD-SD组PSQI量表各因子评分均较PD-NSD组显著升高,提示PD-SD患者主观睡眠质量、睡眠潜伏期、睡眠时间、睡眠效率、SD及日间功能障碍均更差,需服用睡眠药物更多。其原因可能包括:(1)PD患者多为老年人,睡眠结构发生改变,白天多次小睡,夜间总睡眠时间缩短,非快速眼动期睡眠的3、4期睡眠时间显著缩短,而伴有运动及情绪障碍的PD患者SD更多见[7]。(2)PD患者夜间运动障碍导致觉醒;常于睡前出现不宁腿综合征而影响入睡;睡眠中频繁出现的周期性肢体动及快速眼动睡眠期行为障碍等影响睡眠质量[11]。(3)上行网状激活系统,包括蓝斑、黑质及脑桥被盖核等神经元变性损伤,影响白天觉醒,造成日间睡眠过多[12]。
本研究结果显示,PD-SD组运动症状评分有高于PD-NSD组的趋势,但两组间比较无统计学差异。PD患者夜间亦会出现运动迟缓、肌肉僵硬、震颤等运动症状,严重影响患者的睡眠,其原因为:(1)震颤导致患者入睡困难;(2)运动迟缓及肌强直,特别是中晚期累及躯干时,患者出现翻身困难,可造成觉醒及再入睡困难;(3)随病情加重,患者在清晨常出现肌张力障碍,导致早醒。
Angst[13]报道半数以上PD患者存在抑郁,在运动不能或运动波动者中更常见和严重。焦虑与抑郁具有共同的神经递质基础,因而常与抑郁共同存在。焦虑者常以入睡困难为主,抑郁者常表现为睡眠片段化和清晨早醒[14]。PD伴发焦虑、抑郁,一方面可能是患者对躯体疾病的心因性反应,另一方面与多巴胺、去甲肾上腺素和5-羟色胺等神经递质改变有关[14]。PD患者伴发SD是焦虑、抑郁常见的临床症状,而严重的SD将进一步加重抑郁、焦虑,两者互相影响。本研究结果显示PD-SD组HAMD及HAMA量表评分更高,提示其抑郁、焦虑程度更重。
PD-SD患者白天困倦、疲劳更重。导致白天困倦的可能原因为夜间SD、情绪障碍(如焦虑、抑郁等)、夜间自主神经功能障碍(夜尿频繁、多汗等)、感觉异常(肢体疼痛、麻木等)等均可导致夜间深睡眠时间显著减少,造成白天困倦。Friedman等[15]报道PD患者疲劳的发生率为33%~58%。疲劳和SD常重叠存在,伴有SD的患者常有疲劳感,而有疲劳的患者常伴夜间SD和白天困倦[16]。路易小体累及中脑中缝核时,导致其投射到基底节、扣带回和杏仁核等边缘系统的5-羟色胺能神经纤维受损,从而产生疲劳[17],而上述脑区也与SD有关。疲劳包括躯体疲劳和精神疲劳。本研究发现,PD-SD组运动症状更重,可能与躯体疲劳有关;PD-SD组焦虑和抑郁情绪更突出,可能与精神疲劳有关。PD-SD组由于焦虑、抑郁、白天困倦及疲劳更重,因而由UPDRS-Ⅰ量表评分反映的总体神经精神状况也显著下降,运动症状较PD-NSD组有增高趋势,提示PD-SD组ADL显著受损,生活质量显著下降。
本研究采用v-PSG对PD-SD及PD-NSD组的睡眠参数进行监测和对比发现:(1)PD-SD 组总睡眠时间显著减少,夜间长时间处于清醒状态,白天疲乏、头昏等亦是夜间睡眠不足的表现。v-PSG证实PD-SD患者睡眠潜伏期延长,觉醒次数增多。上述改变可能与PD-SD组患者的运动症状重、焦虑和抑郁情绪显著、疲劳及白天困倦有关。(2)PD-SD 组睡眠效率显著低,与PSQI量表评价的睡眠效率降低一致,提示PSQI量表可用于评价睡眠效率。(3)PD-SD 组患者低通气指数显著增高。当Lewy小体沉积在呼吸中枢(如延髓时)可导致患者出现中枢性呼吸障碍,通气减低[18]。老年人常伴有呼吸系统疾病,造成阻塞性呼吸障碍,导致通气不足,建议患者应及时就诊和治疗。
综上所述,PD患者伴发SD的发生率高,影响因素较多,与运动症状和多个非运动症状相关,导致PD患者ADL显著下降,生活质量显著受损。临床应高度重视PD-SD,给予早期诊断,予以个体化干预和治疗,以提高患者的生活质量。
[1]Sjödahl Hammarlund C ,Hagell P ,Nilsson MH. Motor and non-motor predictors of illness-related distress in Parkinson’s disease[J].Parkinsonism Relat Disord,2012,18:299-302.
[2]Artinez-Martin P.The importance of non-motor disturbances to quality of life in Parkinson’s disease[J].J Neurol Sci,2011,310:12-16.
[3]Hughes AJ,Daniel SE,Kilford L,et al. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease:a clinico-pathological study of 100 cases[J]. J Neurol Neurosurg Psychiatry,1992,55:181-184.
[4]Schrempf W,Brandt MD,Storch A,et al. Sleep disorders in Parkinsons disease[J]. J Parkinsons Dis,2014,4:211-221.
[5]Diederich NJ,McIntyre DJ.Sleep disorders in Parkinson’s disease:many causes,few therapeutic options[J].J Neurol Sci,2012,314:12-19.
[6]Natarajan R.Renew of periodic limb movement and restless leg syndrome[J].J Postgrad Med,2010,56(2):157-162.
[7]Roychowdhury S,Forsyth DR. Sleep disturbance in Parkinson disease[J]. J Clin Gerontol Geriatrics,2012,3(2):53-61.
[8]Chaudhuri KR,Healy DG,Schapira AH,et a1.Non-motor symptoms of Parkinson’s disease:diagnosis and management[J].Lancet Neurol,2006,5:235-245.
[9]Gjerstad MD,Wentzel-Larsen T,Aarsland D,et a1.Insomnia in Parkinson’s disease:frequency and progression over time[J].J Neurol Neurosurg Psychiatry,2007,78:476-479.
[10] Chaudhuri KR. Nocturnal symptom complex in PD and its management[J]. Neurology,2003,61(Supp 3):S17-S23.
[11]Bruin VM,Bittencourt LR,Tufik S.Sleep-wake disturbances in Parkinson disease:current evidence regarding diagnostic and therapeutic and therapeutic decisions[J].Eur Neurol,2012,67(5):257-267.
[12]Ferrer I,Lopez-Gonzalez I,Carmona M. Neurochemistry and the non-motor aspects of PD[J]. Neurobiol Dis,2012,46(3):508-526.
[13]Angst J. Depression and anxiety:implications for nosology,course,and treatment[J]. Clin Psychiatry,1997,58:3-5.
[14]Avila A,Cardona X,Martin-Baranera M,et al. Agomelatine for depression in Parkinson disease:Additional effect on sleep and motor dysfunction[J].J Clin Psychopharmacol,2015,35(6):719-23.
[15]Friedman JH,Brown RG,Comella C,et a1.Fatigue in Parkinson’s disease:a review[J].Mov Disord,2007,22:297-308.
[16]Hossain JL,Ahmad P,Reinish LW,et a1.Subjective fatigue and subjective sleepiness:two independent consequences of sleep disorders?[J].J Sleep Res,2005,14:245-253.
[17]Kluger BM,Pedersen KF,Tysnes OB,et al. Is fatigue associated with cognitive dysfunction in early Parkinson’s disease?[J]. Parkinsonism Relat Disord,2017,37:87-91.
[18]Presti MF,Schmeichel AM,Low PA1,et al. Degeneration of brainstem respiratory neurons in dementia with Lewy bodies[J].Sleep,2014,37(2):373-378.

