丰富环境对脑缺血再灌注损伤大鼠学习记忆和神经功能的影响
徐丹 陶陶 张继荣 何桂双
脑缺血再灌注损伤是缺血性脑卒中的病理生理基础,运动、言语、行为及认知功能障碍均为脑缺血后常见的并发症。认知功能障碍主要表现为注意力不集中,学习记忆能力下降,给家庭和社会带来沉重的负担。脑缺血后行为功能及认知能力的恢复不仅受生理、病理因素的影响,还与环境因素密切相关[1]。近年来,丰富环境作为一种新的康复治疗手段在脑血管疾病中的作用成为研究的热点。
丰富环境是指能促进感觉、认知及行为能力提高的居住条件,相对于标准环境而言,其设置复杂而新颖,包括社会交往及生存环境两方面因素[2]。自丰富环境这一概念被提出以来,就主要用来研究各种脑损伤动物模型,最新的临床研究显示丰富环境对脑卒中患者的神经功能恢复也表现出积极作用[3]。丰富环境可能通过调控受损脑组织内各种因子的表达而部分逆转实验大鼠的学习记忆能力,增加觅食行为,促进脑功能修复[4]。脑源性神经营养因子(brain derived neurotrophic factors, BDNF)作为活性最强的神经营养因子,在脑血管疾病中发挥重要的作用。本研究通过建立大鼠脑缺血再灌注模型,采用丰富环境干预研究大鼠海马CA1区BDNF蛋白的表达情况,以进一步探讨丰富环境对认知及神经功能恢复可能的作用机制,旨在为临床治疗提供更客观可靠的依据和参考。
1 材料和方法
1.1实验动物及分组清洁级成年雄性SD大鼠50只,体质量280~300 g,由贵州医科大学实验动物中心提供,实验动物生产批号:SCXK(黔)2016-0001。动物的使用符合贵州省动物管理委员会管理条例。将大鼠随机分为假手术组(10只)、脑缺血组(20只)及丰富环境组(20只)。
1.2主要试剂与仪器包括兔抗BDNF抗体(购于瑞士Roche公司)、免疫荧光试剂盒(购于武汉博士德公司)、Morris水迷宫(成都泰盟科技有限公司生产)、分析软件(Image J)。
1.3方法
1.3.1造模:参照 Longa法[5]建立大鼠右侧大脑中动脉栓塞(middle cerebra artery occlusion)再灌注模型,具体操作如下:按体质量0.35 mL/100 g给予大鼠10%(质量浓度)水合氯醛腹腔注射,将大鼠仰卧位固定于手术台上,颈部正中切口,钝性分离出右侧颈总动脉、颈外动脉及颈内动脉,在近心端结扎颈总动脉,在颈内动脉起始处放置小动脉夹暂时夹闭血流,在颈总动脉剪一小口插入直径约为0.20 mm的尼龙线栓,将线栓经颈内动脉轻柔插入直到感觉到轻微阻力(插入长度自颈内动脉分叉处约18 cm),提示线栓到达大脑中动脉起始处。缺血90 min后,再次麻醉大鼠,缓慢拔出线栓,缝合颈部切口,即完成大鼠脑缺血90 min 再灌注损伤模型。待动物苏醒后观察其步态和行为,参照Longa法评分标准[5]判断模型是否制备成功,1~3分视为造模成功,剔除造模失败或死亡的大鼠,用备用大鼠补齐数量。假手术组线栓不插入大脑中动脉,其余操作相同。
1.3.2丰富环境设置:将假手术组和脑缺血组大鼠饲养在标准环境:将大鼠置于25 cm×15 cm×18 cm的塑料笼内,笼内只有食物、垫料和水,每笼2只;丰富环境组大鼠于造模后立即饲养在丰富环境:将大鼠置于45 cm×25 cm×28 cm的金属网格笼内,笼内除食物、垫料和水外,还有一个木房子、木制高台、积木、转轮、兵乓球、小积木以及小的玩具,每周更换1次;同时播放轻音乐,以不同颜色灯光照射,每天持续2 h,每笼5只,丰富环境干预30 d。
1.3.3神经功能缺损评分:参照 Longa法[5]于丰富环境干预的第1天及第30天对各组大鼠行神经功能缺损评分。各时间点假手术组取3只,脑缺血组和丰富环境组各取6只大鼠。神经功能缺损由轻到重分为5级(0~4分)。0分:正常,无神经损伤症状;1分:不能完全伸直对侧前肢(即提尾悬空实验阳性);2分:行走时躯体向偏瘫侧转圈;3 分:行走时躯体向偏瘫侧倾倒;4分:不能自发行走,意识丧失。
1.3.4脑组织BDNF蛋白表达检测:分别于丰富环境干预的第1天以及第30天行神经功能评分后用免疫荧光染色法检测各组大鼠脑组织海马区BDNF蛋白的表达。具体过程如下:取各组大鼠脑组织制作冷冻切片,切片经0.01 mol/L PBS漂洗3次,每次5 min,经BSA封闭液室温封闭20 min,滴加兔抗BDNF抗体(1∶100),置湿盒中4℃避光孵育过夜,第2天经上午0.01 mol/L PBS清洗切片3次,每次5 min,滴加红色荧光标记的二抗,湿盒内避光孵育1 h。随后滴加抗荧光淬灭剂,盖玻片封片,立即置于荧光显微镜下观察。于200倍视野下统计缺血侧海马CA1区荧光阳性细胞数量,每张切片随机取5个不重复视野,摄片保存,计算平均值,用Image J软件分析。
1.3.5Morris水迷宫实验:Morris水迷宫主要由内含平台的圆形水池和记录装置两部分组成。水池直径120 cm、高50 cm。池壁上标有东、南、西、北4个入水点,将水池分为4个象限。内置直径14 cm、高20 cm的平台,加水至超过平台高度1~1.5 cm,为避免大鼠直接看见平台,在水中加入墨水,水温保持在22~24℃。迷宫上方安置带有显示系统的摄像机,计算机自动跟踪计时并记录游泳轨迹。于丰富环境干预30 d后进行连续5 d的水迷宫实验。前4 d进行定位航行实验,记录各组大鼠的逃避潜伏期;第5天进行空间探索实验,记录90 s内大鼠跨越原平台所在位置的次数。测试时避光、保证实验室内良好通风,周围参照物固定不变。研究人员保持安静,不要随意走动。测试完毕后用干毛巾擦拭大鼠,并置于暖风旁,注意保暖。以大鼠逃避潜伏期和跨越平台次数作为评价各组大鼠学习记忆能力的指标。
1.4统计学处理采用SPSS19.0统计软件进行分析,计量资料采用均数±标准差表示,资料服从正态分布且方差齐时应用单因素方差分析进行统计,两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1神经功能缺失体征评分假手术组大鼠表现正常,无异常行为;丰富环境干预的第1天脑缺血组和丰富环境组大鼠均可见缺血再灌注损伤后异常行为,如行走时转圈或向对侧倾倒,神经功能缺失体征评分无统计学差异(P>0.05);丰富环境干预的第30天,丰富环境组大鼠神经功能缺失症状较脑缺血组明显减轻(P<0.05),而脑缺血组大鼠神经功能缺失症状无明显变化(P>0.05)。结果见表1。
2.2各组脑组织BDNF蛋白表达假手术组大鼠BDNF阳性细胞表达较少;丰富环境干预的第1天脑缺血组和丰富环境组大鼠海马BDNF阳性细胞表达较假手术组相比明显升高(P<0.05);但脑缺血组与丰富环境组间比较差异无统计学意义(P>0.05)。丰富环境干预的第30天时脑缺血组和丰富环境组大鼠BDNF阳性细胞数减少,但丰富环境组BDNF蛋白的阳性表达明显多于脑缺血组(P<0.05)。结果见表1,图1。
2.3Morris水迷宫实验与假手术组相比较,丰富环境组和脑缺血组大鼠的逃避潜伏期延长,跨越平台次数减少(均P<0.05);与脑缺血组相比,丰富环境组逃避潜伏期缩短,跨越平台次数增多(均P<0.05)。结果见表2。
表1 各组大鼠造模术后不同时间点神经功能缺损评分和BDNF蛋白表达情况比较(±s)
注:BDNF:脑源性神经营养因子,图1同;与假手术组比较,aP<0.05;与脑缺血组比较,bP<0.05
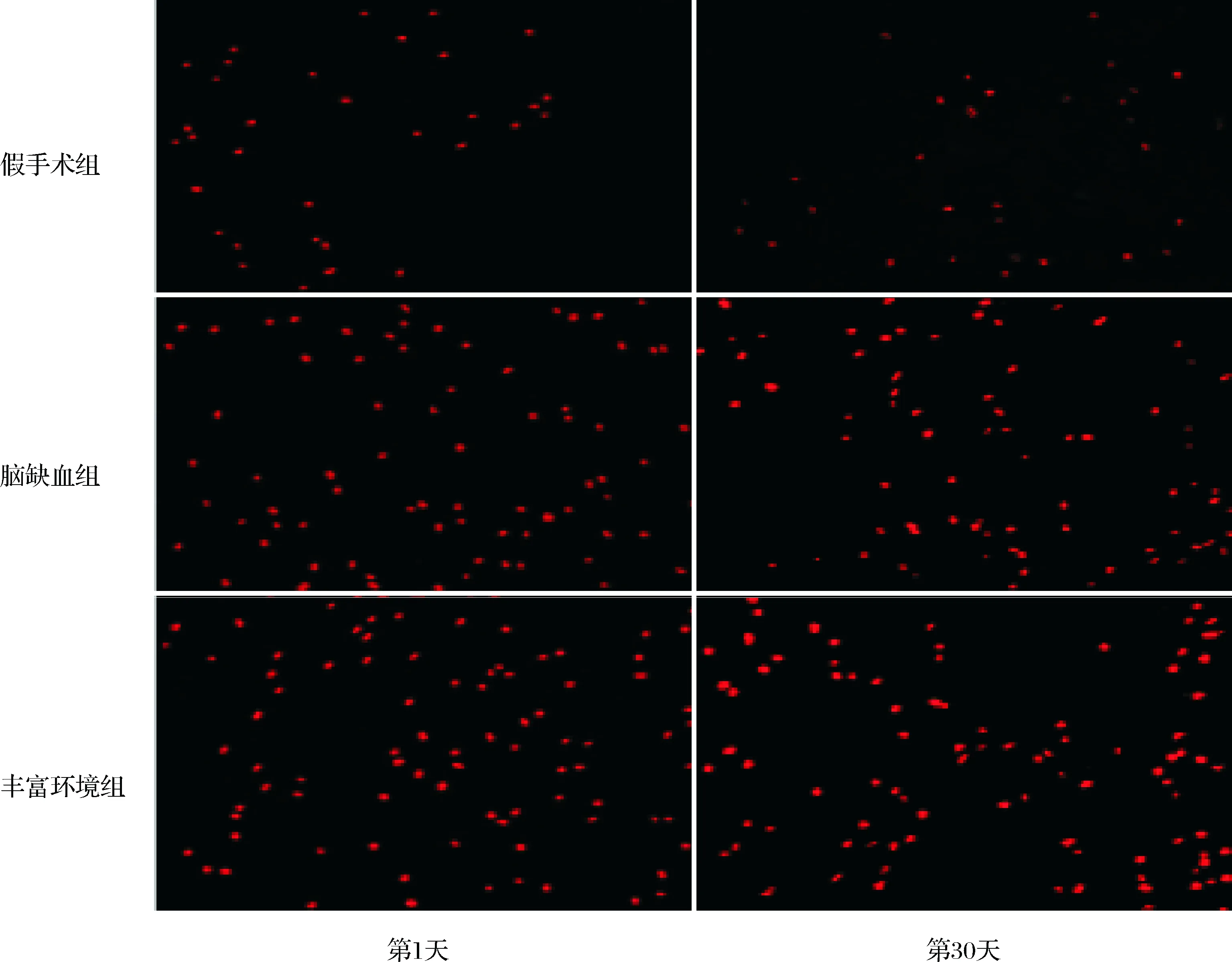
图 1 丰富环境干预不同时间点各组大鼠BDNF荧光表达情况(×200)
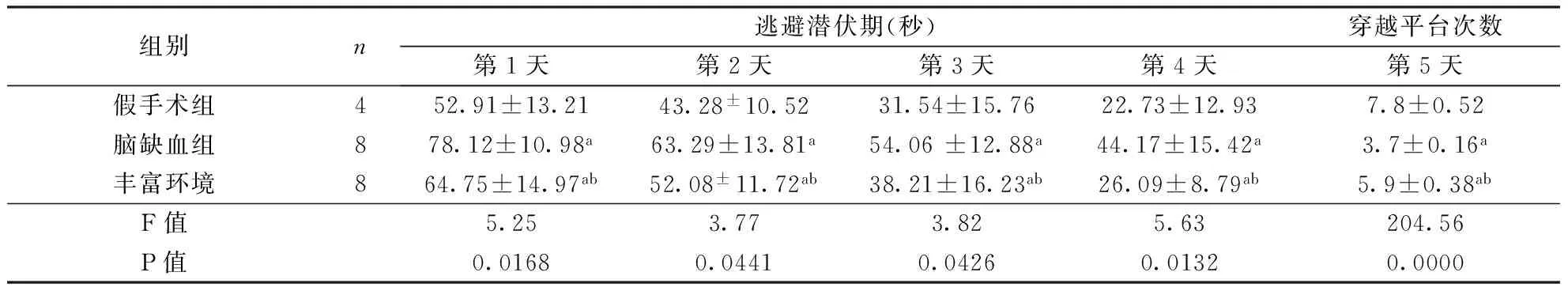
组别n逃避潜伏期(秒)穿越平台次数第1天第2天第3天第4天第5天假手术组452.91±13.2143.28±10.5231.54±15.7622.73±12.937.8±0.52脑缺血组878.12±10.98a63.29±13.81a54.06±12.88a44.17±15.42a3.7±0.16a丰富环境864.75±14.97ab52.08±11.72ab38.21±16.23ab26.09±8.79ab5.9±0.38abF值5.253.773.825.63204.56P值0.01680.04410.04260.01320.0000
注:与假手术组相比,aP<0.05;与缺血组相比,bP<0.05
3 讨论
丰富环境于1947年被Hebb提出,成为国内外学者的研究热点[6],不同于一般的标准环境,丰富环境往往具有更大的空间和更复杂多变的环境,而且还能增加动物之间的行为交流。丰富环境与标准环境的设置在不同的实验室不尽相同,但总的原则是要增加社会性刺激及动物之间相互交往的机会[7]。
本研究于丰富环境干预的第1天及第30天对各组大鼠行神经功能缺损评分发现,假手术组大鼠无神经功能缺损,脑缺血组和丰富环境组大鼠在术后早期即有神经缺损症状,且两组神经缺损评分无统计学差异,提示脑缺血再灌注损伤严重影响大鼠的神经功能;丰富环境干预30 d后,丰富环境组大鼠神经缺损症状有明显改善,神经功能缺损评分较脑缺血组降低,表明丰富环境对脑缺血再灌注损伤大鼠神经行为恢复有积极作用。这与贾子尚等[8]研究报道结果一致。推测丰富环境通过复杂而又新颖的环境信息,激发大鼠探索学习的能力,并且增加动物之间的社会交往而改变自身行为,适应新的环境,从而提高行为能力。
水迷宫实验是公认的检测学习记忆能力有效的最常用手段,该研究结果显示,干预后各时间点,脑缺血组及丰富环境组大鼠的逃避潜伏期较假手术组延长、跨越平台次数降低,表明脑缺血再灌注损伤对大鼠的学习记忆能力产生负面影响。经丰富环境干预后大鼠的逃避潜伏期及跨越平台次数均明显优于脑缺血组,且随着对周围环境的熟悉及学习记忆能力的增强,第4天的逃避潜伏期接近假手术组,提示丰富环境能提高大鼠的学习记忆能力,其机制可能与丰富环境可促进受损神经组织功能修复有关。
BDNF属于神经营养因子家族,是1982年首次从猪脑中发现的一种广泛分布于大脑中枢神经系统的二聚体蛋白,在海马区及皮质区表达最多[9]。在所有神经营养因子成员中,BDNF的活性作用最强,通过神经保护和促进恢复两方面发挥脑保护作用。发生脑缺血再灌注损伤的同时,机体自身会形成自我保护机制,内源性BDNF的表达增加可能是其中之一[10-11]。Lee等[12]研究发现降低BDNF水平可加重动物的脑损伤。而徐爱华等[13]研究证实在损伤早期给予外源性BDNF能够补充缺乏的神经营养因子,增加突触可塑性,改善认知功能障碍。由于BDNF是大分子蛋白,不能很好地通过血-脑屏障,明显降低了外源性BDNF的药效。若直接行侧脑室注射不仅会破坏头颅骨,而且需精准定位,操作难度较高,可能会加重大鼠的脑损伤[14]。因此通过其他干预来提高内源性BDNF的表达意义重大。
本研究通过对丰富环境干预的第1天及第30天检测各组大鼠脑海马区BDNF蛋白的表达,结果显示假手术组的BDNF蛋白表达较少,丰富环境干预的第1天,脑缺血组和丰富环境组BDNF阳性细胞数量明显多于假手术组,提示大脑受到损伤时可通过上调BDNF的表达而启动内源性脑保护机制。丰富环境干预的第30天发现,脑缺血组和丰富环境组BDNF蛋白的阳性表达数量降低,但丰富环境组高于脑缺血组,表明脑缺血再灌注损伤后内源性的BDNF增加有限,而丰富环境可增加海马区内源性BDNF的表达,这可能部分解释丰富环境干预后大鼠神经功能缺失症状改善及学习记忆能力增强的原因。 这与Fan等[15]研究结果一致。
综上所述,丰富环境可上调脑缺血再灌注损伤引起的内源性BDNF的表达而快速启动内源性保护机制,改善神经功能,提高学习记忆能力。丰富康复的脑保护作用可能是多种因素综合作用的结果,有关具体机制还需要更加深入的研究。在传统药物治疗的基础上结合丰富环境治疗可能使脑卒中患者受益。
[1]Janssen H, Ada L, Bernhardt J, et al. An enriched environment increases activity in stroke patients undergoing rehabilitation in a mixed rehabilitation unit:a pilot non-randomized controlled trial[J]. Disabil Rehabil, 2014,36(3):255-262.
[2]宋名杨,朱路文,叶涛,等.丰富环境促进缺血缺氧性脑损伤修复的研究进展[J].中国康复理论与实践, 2016, 22(1):61-64.
[3]金信浩,郑兵,吴雪莲,等.丰富环境对脑卒中患者神经功能康复的效果[J].中国康复理论与实践,2017,23(3):323-325.
[4]Yamaguchi H, Hara Y, Ago Y, et al. Environment enrichment attenuates behavioral abnormalities in valproic acid-exposed autism model mice [J].Behav Brain Res, 2017, 333(1):67-73.
[5]Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rat[J]. Stroke,1989,20(1):84-91.
[6]Hebb DQ. The effects of early experience on problem solving at maturity[J]. Am Psychologist, 1947,2(5):306-307.
[7]Kalogeraki E, Pielecka-Fortuna J, Löwel S. Environmental enrichment accelerates ocular dominance plasticity in mouse visual cortex whereas transfer to standard cages resulted in a rapid loss of increased plasticity [J]. PLoS One, 2017,12(10):e0186999.
[8]贾子善,李阔,槐雅萍,等. 不同环境干预对局灶性脑梗死大鼠行为学恢复的影响[J].中国康复医学杂志,2007,22(7):578-580.
[9]Brade YA, Edgar D, Thoenen H. Purification of a new neurotrophic factor from mammalian brain [J]. EMBO J, 1982,1(5):1295-1296.
[10]徐丹,陶陶,张继荣,等.HIF-lα对脑缺血再灌注损伤细胞凋亡及凋亡相关基因的研究进展[J].中国神经免疫学和神经病学杂志,2017,24(3):219-222.
[11]Shilpa BM, Bhagya V, Harish G, et al. Environment enrichment ameliorates chronic immobilisation stress-induced spatial learning deficits and restores the expression of BDNF, VEGF, GFAP and glucocorticoid receptors[J].Prog Neuropsychopharmacol Biol Psychiatry,2017,76:88-100.
[12]Lee TH, Yang JT, Kato H, et al. Hypertension downregulates the expression of brain-derived neurotrophic factor in the ischemia-vulnerable hippocampal CA1 and cortical areas after carotid artery occlusion [J]. Brain Res, 2006, 1116(1):31-38.
[13]徐爱华, 王维,商秀丽.外源性脑源性神经营养因子对 Alzheimer 大鼠行为学的影响及其作用机制[J].中国医科大学学报,2012,41(12):1091-1098.
[14]谭永星, 李雪梅, 文素芳, 等.不同时间脑室注射BDNF对大鼠脑缺血再灌注损伤氧化应激及神经细胞凋亡的影响[J].第四军医大学学报,2009,30(18):1681-1684.
[15]Fan D, Li J, Zheng B, et al. Enriched environment attenuates surgery-induced impairment of learning, memory, and neurogenesis possibly by preserving BDNF expression [J]. Mol Neurobiol,2016,53(1):344-354.

