抗神经元细胞表面抗原抗体相关自身免疫性脑炎7例临床分析
李务荣 高俊华 姜美娟 伍文清 黄宇明 许东梅
自身免疫性脑炎(autoimmune encephalitis,AE)是泛指一类由自身免疫机制介导的脑炎。AE抗体可分为两类,一类是新发现的抗神经元表面抗原抗体 (NSAbs),以N-甲基-D-天冬氨酸受体(NMDAR)抗体为代表,其他还有γ氨基丁酸B型受体(GABABR)抗体、富亮氨酸胶质瘤失活1蛋白(LGI1)抗体、α-氨基-3-羟基-5-甲基-4-异噁唑丙酸受体(AMPAR)抗体等;另一类是抗神经元细胞内抗原抗体,如抗Hu抗体等经典的副肿瘤综合征抗体。近年来,随着神经元抗体谱系的扩展及实验性抗体检测技术的进步,越来越多的自身抗体介导的AE病例被确诊。在临床实践中,对症状表现为急性或亚急性起病的认知功能障碍、精神行为异常、癫痫发作的患者,临床医生通常会考虑AE的诊断,而若患者症状表现单一,则可能会延误诊断。该研究通过回顾性总结7例抗NSAbs相关AE患者的临床特点,其中2例患者临床表现典型,5例临床表现单一,旨在提高临床对不典型AE的认识。
1 对象和方法
1.1研究对象收集2012-05—2017-04首都医科大学附属北京地坛医院诊治的抗NSAbs相关AE患者7例,其中男性5例,女性2例,年龄分别为35、15、23、23、60、48及77岁。患者诊断符合2016年Graus等[1]提出的AE诊断标准及排除标准。
1.2方法回顾性分析7例患者的临床表现、实验室检查及对治疗的反应。所有患者行脑脊液常规、生化、病原学抗体检测;血液和脑脊液AE抗体检测结果,包括抗NMDAR抗体、抗LGI1抗体、抗GABABR抗体、抗AMPAR抗体、抗接触蛋白相关蛋白2(CASPR2)抗体及副肿瘤相关抗体(抗Hu、Yo、Ri等)检测;头MRI检测及视频脑电图等检查结果。对所有患者进行疗效的观察和随访。
2 结果
2.1临床表现7例患者年龄15~77岁,病程1 d~7年。例3患者亚急性起病,余6例患者均急性起病。4例患者(例1、4、5、7)临床表现以癫痫发作为突出或惟一表现,其中例1发病后长期诊断为病毒性脑炎,之后病情反复复发,发病7年后确诊。1例患者(例3)仅表现为头痛、发热。2例患者(例2、6)表现符合经典边缘性脑炎。具体临床特征详见表1。
2.2实验室检查具体结果见表2。3例患者(例1~3)血液及脑脊液抗NMDAR抗体均阳性,2例患者(例4~5)血抗LGI1抗体均为阳性,而脑脊液均为阴性,2例患者(例6~7)血液及脑脊液抗 GABABR抗体均为阳性,其中例7脑脊液抗Hu抗体阳性。3例患者头MRI检查结果可见异常(图1)。除例3外,余6例患者脑电图检查均可见癫痫波发放。例7出院3个月随访发现肺部占位,余6例患者未发现肿瘤。
2.3治疗及转归6例有癫痫发作的患者对抗癫痫药物治疗效果均较差。7例患者均接受大剂量糖皮质激素冲击治疗,5例患者(例2、4、5、6、7)接受足量IVIG治疗。2例患者(例1、2)接受
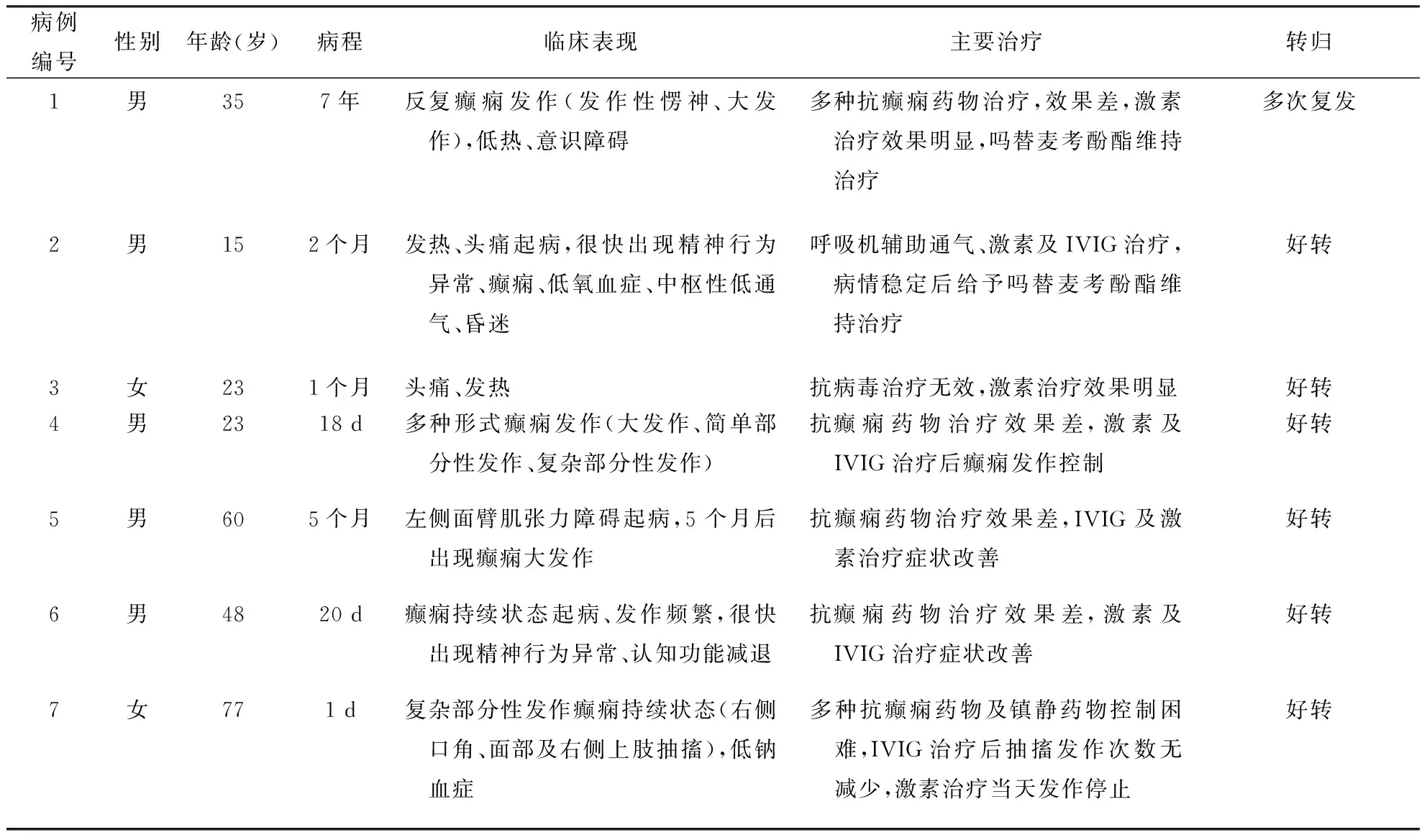
表1 7例AE患者的临床特征、治疗及转归情况
注:AE:自身免疫性脑炎,表2、图1同;IVIG:静脉注射免疫球蛋白
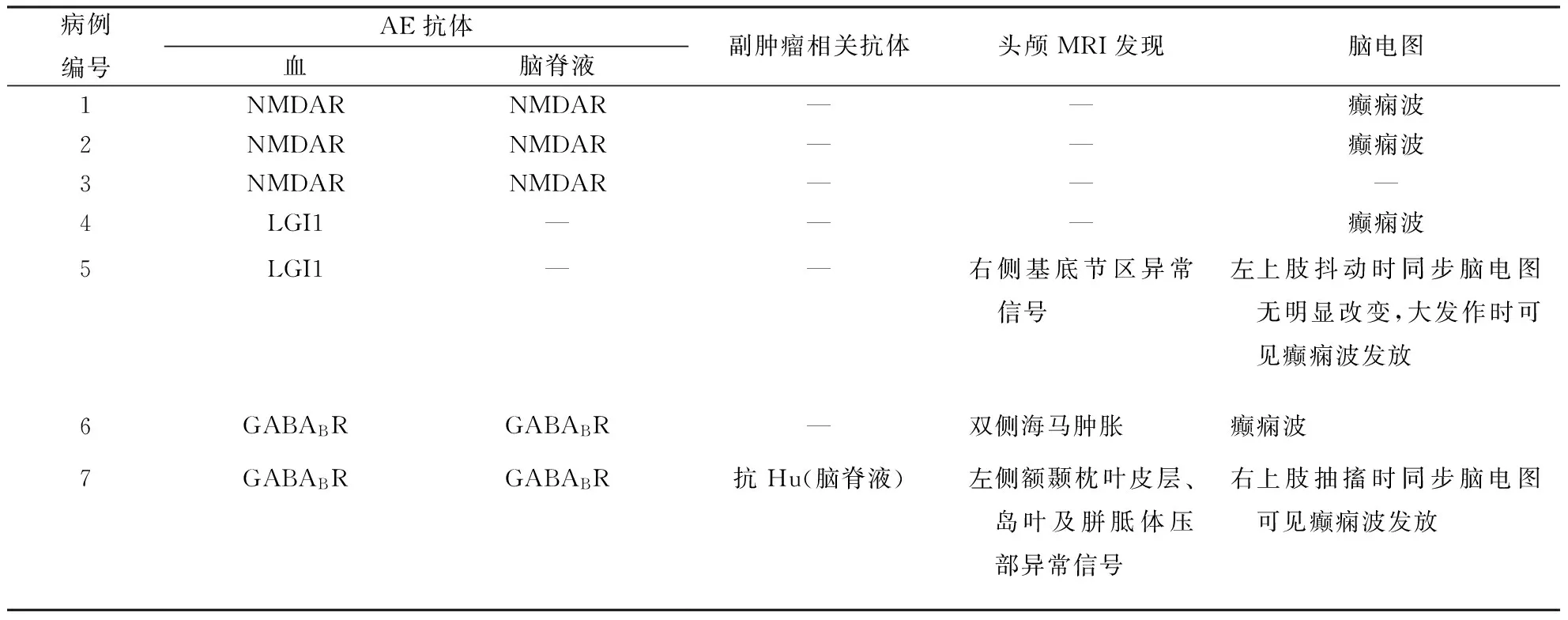
表2 7例AE患者实验室检查结果
注:NMDAR:N-甲基-D-天冬氨酸受体;LGI1:富亮氨酸胶质瘤失活1蛋白;GABABR:γ氨基丁酸B型受体;—:阴性结果或未见异常
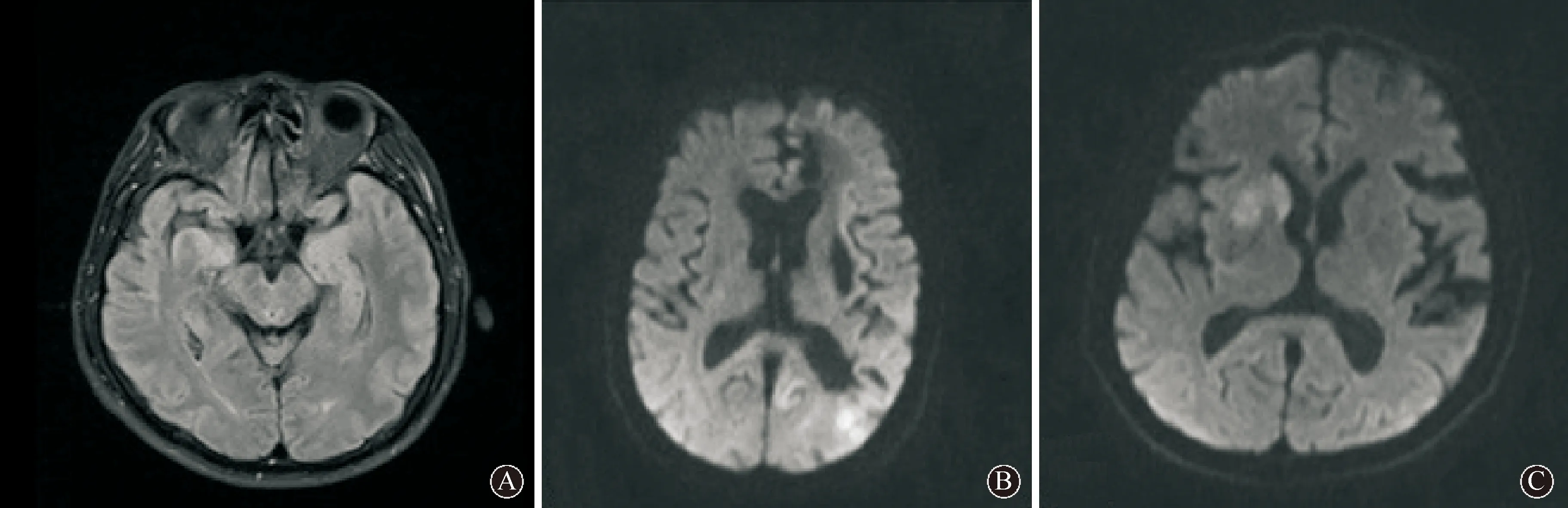
注:A:例6患者头T2 FLAIR像显示双侧海马肿胀,呈高信号;B:例7患者DWI像显示左侧大脑皮层呈高信号;C:例5患者DWI像显示右侧基底节区高信号 图 1 AE患者头MRI检查结果
吗替麦考酚酯维持治疗。所有患者临床均改善,其中例7先给予IVIG治疗,患者抽搐发作次数无减少,大剂量糖皮质激素治疗当天抽搐即停止。例1共随访5年,第1年及第4年各复发1次,加用吗替麦考酚酯后未复发。例2出院后1个月出现严重的肺部感染,给予暂停激素及吗替麦考酚酯治疗,肺部感染治愈后将激素及吗替麦考酚酯减量应用,随访2年未复发。例3随访1年未复发,例4、例5及例6随访半年未复发。例7出院后3个月随访,患者未再抽搐,可经口进食,搀扶下可行走,出院后1年因肺癌去世。具体结果见表1。
3 讨论
自2007年抗NMDAR脑炎被发现以来[2],一系列抗NSAbs被陆续发现,越来越多的自身抗体介导的AE病例被确诊,尤其是临床表现不典型的患者。该组7例患者均急性或亚急性起病,其中5例患者临床表现不典型,1例仅有头痛、发热,4例以癫痫发作为突出或惟一表现,余2例患者表现为经典的边缘系统症状;3例患者头MRI检查结果可见异常,1例为边缘系统异常信号,1例为单侧大脑皮层异常信号,1例为基底节区异常信号;6例患者可见异常脑电图;所有患者抗NSAbs检测阳性。根据2016年Graus等学者提出的AE诊断标准,本组7例患者诊断抗NSAbs相关AE成立。
AE临床表现多为认知功能障碍、精神行为异常等,或为各种类型的癫痫发作。本组7例患者中有6例有癫痫发作,其中4例患者以癫痫发作为突出或惟一的临床表现,1例表现为癫痫持续状态,2例癫痫发作形式多样,1例病程较长,4例患者均对规范抗癫痫治疗效果差,而对免疫治疗效果明显。对于这4例患者,国内外研究称之为自身免疫性癫痫[3-5]。从发病机制上看,自身免疫性癫痫和AE两者具有类似的病理生理学过程,其临床关注重点各异,分别为癫痫和脑炎。鉴于两者具有共同的致病自身抗体,部分学者提出“抗神经元表面抗体综合征”这一概念[6]。例1患者以癫痫发作为突出表现,病程中有意识水平下降等表现,长期怀疑为病毒性脑炎,未进行规律免疫治疗。之后病情反复,发病7年后确诊为抗NMDAR脑炎。传统观念认为病毒性脑炎复发或病情加重可能与病毒的再次侵袭有关,但有研究却发现此类患者的脑脊液中未检测到病毒DNA,而发现病毒感染后可继发抗NMDAR等自身抗体,之后出现复发的症状[7-8]。例1患者后期的复发,分析原因可能为早期的病毒感染诱发中枢神经系统免疫异常激活,从而产生抗NMDAR抗体;或者患者发病早期即为抗NMDAR脑炎而未能明确诊断,为复发性抗NMDAR脑炎。临床上对于“脑炎”后出现的耐药性癫痫,或者对于新发的耐药性癫痫患者,需考虑自身免疫性癫痫,可积极给予免疫治疗以改善患者预后。
例3患者临床上仅有发热、头痛,未发现细菌、真菌感染及肿瘤的证据,合理规范的抗病毒及降颅压治疗无效,实验室检查提示抗NMDAR抗体阳性,糖皮质激素免疫治疗后症状迅速改善。尽管该患者缺少边缘系统症状,但免疫治疗效果明显,提示诊断抗NMDAR脑炎,提示在临床上遇到类似的患者需要积极排查AE。
例7患者抗 GABABR抗体合并抗Hu抗体阳性,该两种抗神经元抗体同时阳性的病例亦有文献报道[9-12],该类患者多同时合并小细胞肺癌(SCLC)。该患者随访期发现肺部占位性病变,具体性质不详,推测为SCLC的可能性大。抗Hu抗体是SCLC的指向性抗体,抗Hu抗体阳性提示抗GABABR脑炎的副肿瘤性质。副肿瘤性的抗GABABR脑炎较非副肿瘤性患者预后差,因为副肿瘤性AE患者的预后多取决于抗肿瘤治疗的效果。该组例7患者未行针对肿瘤的治疗,却对免疫治疗有戏剧性的效果,故抗GABABR抗体在本病例的致病机制中可能起到更大的作用。该患者同时合并顽固性低钠血症,而抗GABABR脑炎合并低钠血症罕见文献报道,但低钠血症却可以是SCLC常见的合并症[13],推测本组例7患者顽固性低钠血症和SCLC有关。该患者发病后很快进展为复杂部分性癫痫发作持续状态,对多种抗癫痫药物及镇静药物均无效,给予IVIG足量治疗后患者癫痫持续状态未能控制,但给予甲强龙冲击治疗当天患者癫痫发作即停止,分析该患者可能对激素治疗更敏感,提示对于AE患者需尽早启动激素治疗。文献报道1/3~1/2的抗GABABR脑炎患者常合并SCLC[14-15],例6患者入院后的肿瘤筛查未发现肿瘤,故需在之后的随访中要定期筛查肿瘤,尤其是SCLC。
例5患者以面臂肌张力障碍样发作(faciobrachial dystonic seizures,FBDS)起病,未被临床认识,仅给予抗癫痫药物治疗,效果差。5个月后患者症状加重,出现癫痫大发作。目前文献报道FBDS和抗LGI1脑炎高度相关[16],早期识别并进行免疫治疗可阻止其发展为边缘性脑炎,临床中应多加以注意[17]。
影像学特征对AE的诊断具有重要作用。只有23%~50%的抗NMDAR脑炎患者可发现头MRI异常[18-20],可表现为额叶、顶叶和颞叶内侧皮层受累,也可累及扣带回、丘脑和脑干等[18,21-22]。大部分抗LGI1脑炎患者头MRI表现为单侧或者双侧颞叶内侧、海马的T2/FLAIR序列高信号,也有部分患者表现为基底节区受累[16-17]。本组患者有1例抗LGI1脑炎患者头MRI可发现右侧基底节区异常信号,符合文献报道。抗GABABR脑炎头MRI以T2/FLAIR序列单侧或者双侧颞叶内侧、海马、杏仁核高信号最为多见,少见额叶以及扣带回高信号[10,15]。本组有1例抗GABABR脑炎患者头颅MRI检查示左侧广泛大脑皮层及胼胝体病变,目前未见类似报道。提示在临床中如果发现大脑皮层高信号需警惕AE的可能。
对于AE的治疗,临床尚无统一的治疗标准,主要治疗方案为免疫治疗。目前的免疫治疗方案包括一线治疗(糖皮质激素、IVIG、血浆置换)及二线治疗(利妥昔单抗、环磷酰胺及其他免疫抑制剂)。除免疫治疗外,需同时排查有无伴发肿瘤并行手术切除也是重要的诊疗部分[1,23]。
综上所述,抗NSAbs相关AE可以癫痫为突出或惟一的临床表现,也可以头痛、发热为惟一的临床症状,抗NSAbs检测阳性可协助明确诊断,这类患者对免疫治疗效果较好,临床上需提高对该类患者的认识和早期诊断,以便尽早免疫治疗,改善预后。
[1]Graus F,Titulaer MJ,Balu R,et al. A clinical approach to diagnosis of autoimmune encephalitis[J]. Lancet Neurol,2016,15(4):391-404.
[2]Dalmau J,Tüzün E,Wu HY,et al. Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma[J].Ann Neurol,2007,61(1):25-36.
[3]Ganor Y,Goldberg Stern H,Lerman Sagie T,et al. Autoimmune epilepsy:distinct subpopulations of epilepsy patients harbor serum autoantibodies to either glutamate/AMPA receptor GluR3,glutamate/NMDA receptor subunit NR2A or double-stranded DNA[J].Epilepsy Res,2005,65(1-2):11-22.
[4]Murata Y,Watanabe O,Taniguchi G,et a1. A case of autoimmune epilepsy associated with anti-leucine-rich glioma inactivated subunit 1 antibodies manifesting electrical shock-like sensations and transparent sadness[J].Epilepsy Behav Case Rep,2015,4:91-93.
[5]余金蓓,王赞,林卫红.自身免疫性脑炎癫痫发作类型及脑电图特点分析[J].癫痫杂志,2015,1(2):132-138.
[6]Zuliani L,Graus F,Giometto B,et al. Central nervous system neuronal surface antibody associated syndromes:review and guidelines for recognition[J]. J Neurosurg Psychiatry,2012,83(6):638-645.
[7]Armangue T,Moris G,Cantarin-Extremata V,et al. Autoimmune post-herpes simple encephalitis of adults and teenagers[J]. Neurology,2015,85(20):1736-1743.
[8]Venkatesan A,Benavides DR. Autoimmune encephalitis and its relation to infection[J]. Curr Neurol Neurosci Rep,2015,15(3):3.
[9]Kim TJ,Lee ST,Shin JW,et al. Clinical manifestations and outcomes of the treatment of patients with GABAB encephalitis[J]. J Neuroimmunol,2014,270(1-2):45-50.
[10]Boronat A,Sabater L,Saiz A,et al. GABA(B) receptor antibodies in limbic encephalitis and anti-GAD-associated neurologic disorders[J]. Neurology,2011,76(9):795-800.
[11]Dogan Onugoren M,Deuretzbacher D,Haensch CA,et al. Limbic encephalitis due to GABAB and AMPA receptor antibodies:a case series[J]. J Neurol Neurosurg Psychiatry,2015,86(9):965-972.
[12]任海涛,杨洵哲,关鸿志,等. 多重抗神经元抗体阳性的自身免疫性脑炎临床分析[J]. 中华神经科杂志,2016,49(1):21-25.
[13]Hansen O,Sørensen P,Hansen KH. The occurrence of hyponatremia in SCLC and the influence on prognosis:a retrospective study of 453 patients treated in a single institution in a 10-year period[J]. Lung Cancer,2010,68(1):111-114.
[14]Höftberger R,Titulaer MJ,Sabater L,et al. Encephalitis and GABAB receptor antibodies:Novel findings in a new case series of 20 patients[J].Neurology,2013,81(17):1500-1506.
[15]Lancaster E,Lai M,Peng X,et al. Antibodies to the GABA(B) receptor in limbic encephalitis with seizures:case series and characterization of the antigen[J]. Lancet Neurol,2010,9(1):67-76.
[16]Irani SR,Michell AW,Lang B,et al. Faciobrachial dystonic seizures precede Lgi1 antibody limbic encephalitis[J]. Ann Neurol,2011,69(5):892-900.
[17]Irani SR,Stagg CJ,Schott JM,et al. Faciobrachial dystonic seizures:the influence of immunotherapy on seizure control and prevention of cognitive impairment in a broadening phenotype[J]. Brain,2013,136(Pt 10):3151-3162.
[18]Irani SR,Bera K,Waters P,et al. N-methyl-D-aspartate antibody encephalitis:temporal progression of clinical and paraclinical observations in a predominantly non-paraneoplastic disorder of both sexes[J]. Brain,2010,133(Pt 6):1655-1667.
[19]Dalmau J,Lancaster E,Martinez-Hernandez E,et al. Clinical experience and laboratory investigations in patients with anti-NMDAR encephalitis[J]. Lancet Neurol,2011,10(1):63-74.
[20]Titulaer MJ,McCracken L,Gabilondo I,et al. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis:an observational cohort study[J]. Lancet Neurol,2013,12(2):157-165.
[21]Tojo K,Nitta K,Ishii W,et al. A young man with anti-NMDAR encephalitis following Guillain-Barré syndrome[J]. Case Rep Neurol,2011,3(1):7-13.
[22]Dalmau J,Gleichman AJ,Hughes EG,et al. Anti-NMDA-receptor encephalitis:case series and analysis of the effects of antibodies[J]. Lancet Neurol,2008,7(12):1091-1098.
[23]陈向军,邓波. 自身免疫性脑炎的诊断标准及其临床指导意义[J]. 中国临床神经科学,2016,24(3):336-340.

