基于iTRAQ技术荧蒽降解菌的比较蛋白质组学分析
许 洁,王红旗,孔德康 (北京师范大学水科学研究院,北京 100875)
多环芳烃(PAHs)是持久性有机污染物(POPs)的典型代表,它是由2个或2个以上的苯环以线性,弯接或簇聚的方式稠和在一起的化合物[1].PAHs有“三致”效应(致畸、致癌、致突变),给生态环境、人类和其他生物体的健康带来极大危害;还有较高的稳定性和疏水性、脂溶性,生物利用性较低.因此 PAHs成为污染土壤修复的难点之一.
差异蛋白质组学是通过寻找各种因素引起的蛋白质表达差异,以解释细胞生理和病理机制,即主要通过比较分析不同状态下或近似物种间蛋白质的表达图谱,实现对体系内代谢调控的动态监测,从而揭示机体对内外界环境变化产生反应的本质规律.同位素相对和绝对定量技术(iTRAQ)是 2004年美国应用生物系统公司(AB SCIEX)推出的一项体外同位素蛋白质定量标记技术[2-3],可以高通量分析生物样本中的蛋白及其表达情况,通过比较不同样本之间的差异蛋白,全面系统地揭示生理过程的变化.在医学应用方面,施旭俊等[4]在研究海分枝杆菌野生株和mkl突变株的全菌蛋白差异时,采用iTRAQ技术发现差异表达蛋白566个,其中上调232个,下调334个,主要参与细菌脂质代谢、细胞壁和细胞进程、中间代谢、呼吸作用等生物学过程.其中 DesA3下调最显著,其功能为脂肪酸去饱和酶,与油酸合成相关.朱传智[5]以结核分枝杆菌临床分离链霉素敏感株01105和结核分枝杆菌H37Rv为对照,采用 iTRAQ 技术分析结核分枝杆菌临床分离链霉素耐药株01108菌体的耐药相关潜在蛋白,01108菌株分别与01105菌株和H37Rv菌株比较差异表达蛋白为194和146个,共同差异表达蛋白为121个,其生物进程主要参与中间代谢, 呼吸作用和脂质代谢;分子功能主要为催化活性功能和结合功能.在发酵工程方面,林小琼[6]在研究高效表达木聚糖酶重组毕赤酵母细胞时,采用iTRAQ技术对3组甲醇诱导产酶菌株分析,得到352个差异蛋白.在低表达菌株 G1中,上调蛋白主要参与能量和物质代谢,以及氨基酸代谢,这些途径为外源蛋白的表达提供能量和物质供给.在高表达菌株 G4中,内质网蛋白折叠和加工相关蛋白上调,氨基酸代谢和甲醇代谢相关蛋白下调.过量表达剪切后的HAC1菌株G4-H中,激活UPR机制,参与核糖体蛋白表达的蛋白表达降低.
本文采用 iTRAQ蛋白分离技术并结合LC-MS/MS鉴定红球菌BAP-1在荧蒽连续诱导下的蛋白差异表达,并对差异蛋白进行生物信息学的蛋白功能调控分析,进而从分子生物学角度阐明PAHs降解菌的关键蛋白和代谢的微观机理,以期为微生物修复土壤中PAHs这一棘手问题提供理论基础和实践指导.
1 材料与方法
1.1 菌种培养
红球菌BAP-1是本课题组前期从天津滨海湿地石油污染地区筛选得到的包气带高效多环芳烃降解菌株.BAP-1首先经过LB扩大培养36h后,转接入3mg/L荧蒽的选择性培养基中,25℃、110r/min进行摇瓶诱导实验.
1.2 试剂和仪器
1.2.1 培养基 LB培养基:5g酵母提取物,10g牛肉蛋白胨,10g NaCl(盐度为1%),加去离子水定容到1L,121℃高压蒸汽灭菌20min.
无机盐培养基(MSM): 4gNa2HPO4, 1.5gKH2PO4,1gNH4Cl, 1gNaNO3, 200mgMgSO4·7H2O, 20mgCaCl2,30mgFeSO4·7H2O, 1mL微量元素,10g NaCl(盐度1%),加去离子水定容到1L,121℃高压蒸汽灭菌20min.其中微量元素的配方为(1L): 2.5mgCoCl2·6H2O,3.7mg(NH4)6Mo7O24·4H2O,40mgCuSO4·5H2O,57mgH3BO3, 43mgMnSO4·5H2O, 43mgZnSO4·7H2O.
选择性无机盐培养基:在已灭菌的 MSM 中加入一定量的荧蒽丙酮溶液,使其达到 3mg/L,待丙酮挥发2h后使用.
1.2.2 实验仪器 LC-20AB液相色谱(岛津),LC-20AD纳升液相色谱仪(岛津),ESI串联质谱仪:TripleTOF5600 (SCIEX, Framingham, MA,USA),离子源为 Nanospray III source(SCIEX,Framingham, MA, USA),放射器为石英材料拉制的喷针(New Objectives, Woburn, MA,USA).
1.3 实验方法
1.3.1 实验设置 经3mg/L荧蒽分别诱导1,3,6,8d 4组实验,每组设置2个平行样,将1d设置为实验对照组,3个比对组为3d/1d、6d/1d和8d/1d.
1.3.2 降解菌蛋白提取 采用贝博试剂盒提取降解菌的细胞全蛋白[7],之后通过 Bradford定量和SDS-PAGE进行蛋白质提取质控.
1.3.3 蛋白酶解和 iTRAQ 标记 每个样品取100ug蛋白溶液;按蛋白:酶=40:1的比例加入Trypsin酶2.5ug,37℃酶解4h;按上述比例再补加Trypsin 1次,37℃继续酶解 8h;酶解的肽段用Strata X柱除盐,真空抽干.根据样品数量,取出一定量 iTRAQ 标签试剂;待试剂恢复至室温后,每管试剂加入 50uL异丙醇,涡旋震荡后低速离心;用0.5mol/L TEAB溶解肽段样品,4个样品,2次重复.第 1 批:113-1d-1,114-3d-1,115-6d-1,116-8d-1;第 2 批:117-1d-2,118-3d-2,119-6d-2,121-8d-2;混匀,室温静止2h.
1.3.4 肽段分离 采用 LC-20AB 液相系统,分离柱为5μm×4.6mm×250mm Gemini C18柱对样品进行液相分离.用 2mL流动相 A (5%ACN pH9.8)复溶抽干的肽段样品并进样,以 1mL/min的流速梯度洗脱:5%流动相 B(95% CAN,pH9.8)10min, 5%~35%流动相 B 40min,35%~95%流动相B 1min,流动相B持续3min,5%流动相B平衡10min.在 214nm 波长下监测洗脱峰并每分钟收集一个组分,结合色谱洗脱峰图合并样品得到20个组分,然后冷冻抽干.
1.3.5 高效液相 将抽干的肽段样品用流动相A (2%ACN,0.1%FA)复溶,20000g离心10min后,取上清进样.通过 LC-20AD纳升液相色谱仪进行分离.样品首先进入trap柱富集并除盐,随后与自装C18柱(内径75µm, 柱料粒径3.6µm, 柱长15cm)串联,以300nL/min流速通过如下有效梯度进行分离:0~8min,5%流动相 B(98%ACN,0.1%FA);8~43min,流动相 B 从 8%线性升至 35%;43~48min,流动相 B 从 35%升至 60%;48~50min,流动相B从60%升至80%;50~55min,80%流动相B;55~65min,5%流动相 B.纳升液相分离末端直接连接质谱仪.
1.3.6 质谱检测 经过液相分离的肽段进入到ESI串联质谱仪,参数设置如下:离子源喷雾电压2300V,氮气压力为30psi,喷雾气为15,喷雾接口处温度 150℃.采用高灵敏度模式进行扫描,一级质谱扫描累积时间为 250ms,扫描质量范围为350~1500Da.基于一级扫描信息,按照一级谱图中的离子强度从高到低,对选择强度超过150cp的前30个进行碎裂并扫描二级信息,筛选标准如下:m/z为 350~1250Da;电荷数目为 2~5 个电荷;母离子动态排除设置为:在一半的出峰时间内(约12s),相同母离子的碎裂不超过 2次.二级质谱的扫描累积时间为100ms.针对iTRAQ 类型的数据采集,碎裂能量选择根据iTRAQ试剂调整,第2个四级杆Q2在100Da时的离子传输效率为100%.
1.3.7 蛋白质分析 原始质谱数据通过 Proteo Wizard工具msConvert转成MGF格式,之后转好的MGF文件经过鉴定软件Mascot 2.3.02和实验前期由转录组构建的该菌蛋白比对数据库比对搜索得到最终的蛋白鉴定结果.最终选定的可信蛋白必须包含至少两个可信的特异性(Unique)肽段.具体搜索参数如下,Type of search: MS/MS Ion search; Enzyme: Trypsin; Fragment Mass Tolerance: 0.1Da; Mass Values: Monoisotopic;Variable modifications: Oxidation (M),iTRAQ8plex (Y); Peptide Mass Tolerance: 0.05Da;Fixed modifications: Carbamidomethyl(C),iTRAQ8plex (N-term), iTRAQ8plex (K).
iTRAQ数据的定量采用测试公司自主研发的 IQuant软件[8],该软件整合了 Mascot Percolator[9]算法,该算法采用机器学习算法自动对数据库搜索结果进行重新打分,从而提高结果的鉴定率.首先在谱图/肽段水平进行1% FDR的过滤(PSM-level FDR≤0.01),从而获得显著性鉴定的谱图和肽段列表.接着基于“简约原则”,利用肽段进行蛋白组装,并产生一系列的蛋白组.为了控制蛋白的假阳性率,流程还会在蛋白水平上以FDR 1%再次进行过滤(Protein-level FDR≤0.01),所使用策略为Picked protein FDR[10].IQuant的工作流程主要包括以下几个步骤:蛋白质过滤,报告基团标签纯度校正, 定量值归一化,缺失值补全,蛋白定量值计算,统计检验分析,最终结果展示.主要IQuant定量参数为Quant-peptide: Use All Unique peptide; Quant-number: At least two unique spectra; Normalization: VSN; Protein-Ratio:Weighted average; Statistical Analysis: Permutation Test.利用两组iTRAQ定量的比值>2或<0.5认为有差异,取两组平均值为最终差异倍数.
2 结果
2.1 差异蛋白聚类分析
以荧蒽诱导1d的红球菌BAP-1的蛋白为对照,设置3个比对组分别为3d/1d、6d/1d和8d/1d.以 Q-value≤0.05 和 Fold change>2(即上调>2,下调<0.5)为差异蛋白的筛选条件,共鉴定到796个蛋白,其中表达上调的差异蛋白为613个,表达下调的为183个.由表1可知,与对照组相比,随诱导时间的延长,鉴定到的差异蛋白总数呈现下降趋势,说明菌体适应荧蒽的外界胁迫环境有一个循序渐进的过程.而上调蛋白呈现先下降后上升的趋势,下调蛋白呈现先上升后下降的趋势.其中3d/1d鉴定到的差异蛋白总数和上调差异蛋白数目最多,说明在第 3天菌体受荧蒽的诱导刺激最为敏感.3个比对组中上调蛋白数目都始终远高于下调蛋白,说明荧蒽作为一种外源压力胁迫条件,相比于抑制或削弱某些蛋白发挥功能来说,菌体更需要刺激或促进上调的蛋白来增强适应外界条件的能力,以维持细胞原有的生命活动.
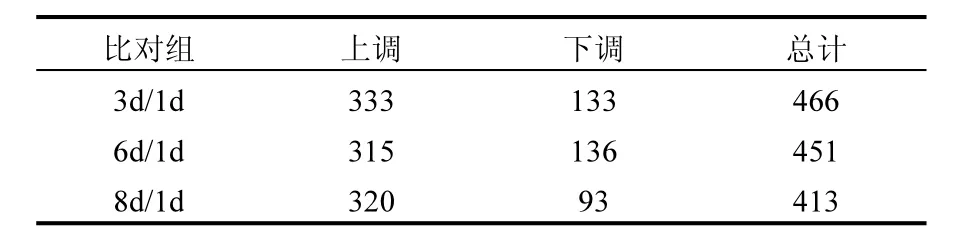
表1 3个比对组鉴定到的差异蛋白数Table 1 The number of differentially expressed proteins in three clusters
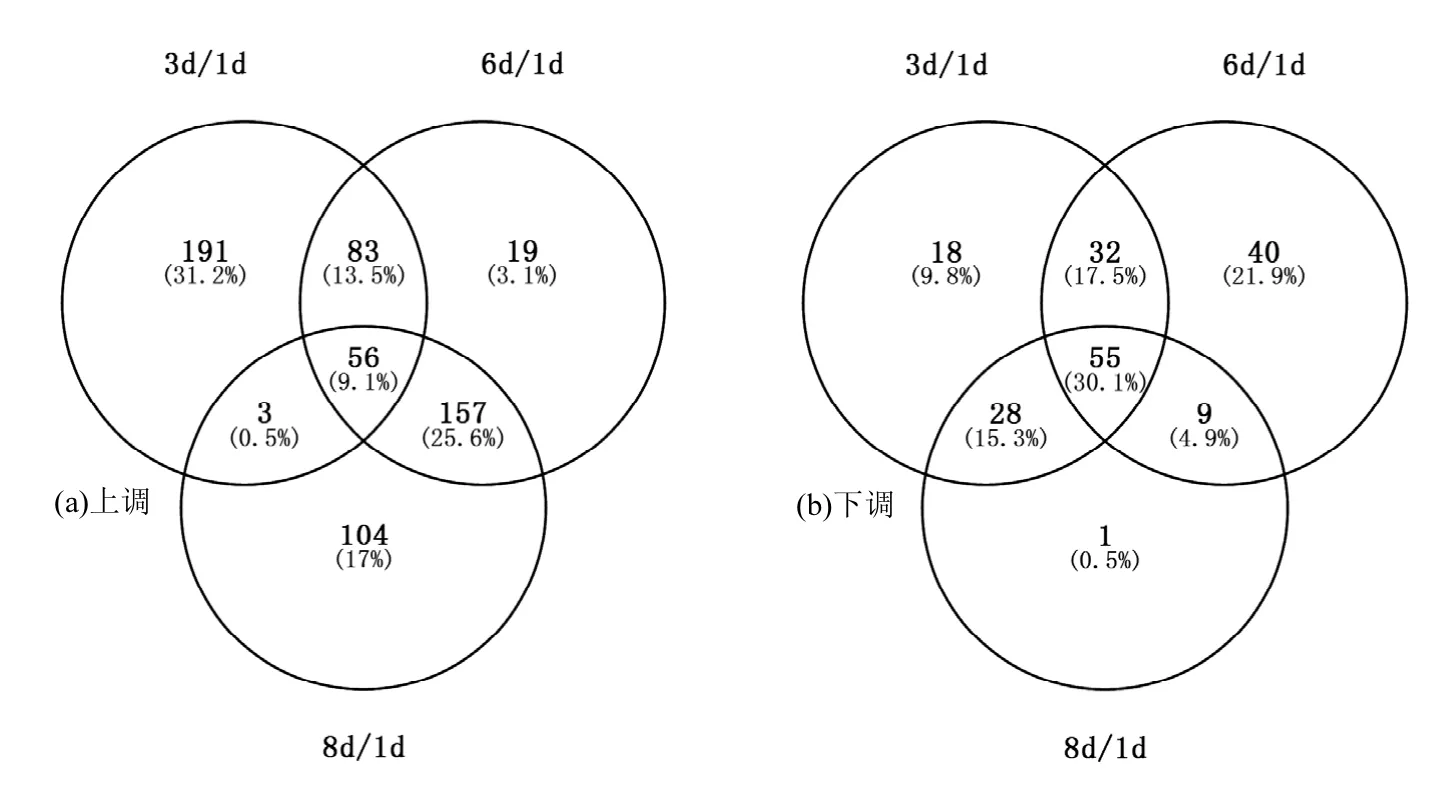
图1 三个比对组鉴定到的差异蛋白维恩图Fig.1 Venn diagram depicting differential expressed proteins in three clusters
从图1看出,3个比对组中共同差异表达蛋白数目为111个,其中上调为56个,下调为55个.在热图中,红色部分代表上调蛋白,颜色越亮,上调倍数越大,即为显著上调差异蛋白,而绿色部分代表下调蛋白,颜色越亮,下调倍数越大,即为显著下调差异蛋白.由此,从图2看出,在1d/3d中显著上调的蛋白有二磷酸核苷激酶,三磷酸腺苷合酶,DinB家族蛋白,磷酸丙酮酸水合酶和琥珀酰 CoA合成酶.在 6d/1d中有孢壁蛋白,甘油激酶以及一种假定蛋白表现为显著上调.而在8d/1d,除了与 6d/1d相同的两个蛋白(孢壁蛋白和假定蛋白),还有细胞色素氧化酶和另一种假定蛋白表现为明显的上调.同理,从图 3中得出,相应的显著下调蛋白主要分布在1d/3d和6d/1d.在 1d/3d显著下调的是细胞色素泛醌氧化酶,NADP转氢酶,甲酸盐乙酰转移酶和 5-甲基四氢蝶酰三谷氨酸-同型半胱氨酸甲基转移酶;在6d/1d显著下调的有乙酰转移酶,甘油磷酸盐脱氢酶,醌蛋白葡萄糖脱氢酶以及异亮氨酰 tRNA合成酶.而且大部分下调程度大的蛋白位于3d/1d,而下调不明显的基本位于 8d/1d,这也验证了前面论述的菌体在 3d对荧蒽的刺激反应最为敏感,而随着适应能力的增强,下调蛋白的调控变化幅度逐渐减小.
2.2 差异蛋白COG功能分类
COG(蛋白相邻类的聚簇)是对蛋白质进行直系同源分类的数据库.将鉴定得到的蛋白质和COG数据库进行比对分析,预测这些蛋白质可能的功能并统计其功能分类[11].
3个比对组3d/1d、6d/1d和8d/1d中上调和下调蛋白共参与20个COG功能分类中,这表明菌体在荧蒽诱导下的蛋白功能参与不同的生物过程,差异蛋白并不是起单一作用的,而是共同构成一个互作的关系网络.如图4所示,COG分析显示3个比对组中,无论是上调还是下调,占比例都很大的是能量产生与转化、氨基酸转运与代谢、以及翻译,核糖体结构与生物合成,这表明菌体可以替换或抑制已有的能量供应蛋白,转而刺激或增强其他蛋白的功能,从而利用荧蒽作为其唯一碳源和能源进行代谢以维持自身的生命活动.其次 COG功能分类中占比例较大的是翻译后修饰、蛋白周转、伴侣.虽然其他功能分类中差异蛋白所占比例较小,但在控制细胞生长以及荧蒽的运输和代谢过程中同样起着不可忽视的作用.

图2 3个比对组中56个共同上调差异蛋白的热图Fig.2 Heat maps depicting the 56 shared up-regulated proteins in all three clusters

图3 3个比对组中55个共同下调差异蛋白的热图Fig.3 Heat maps depicting the 55 shared down-regulated proteins in all three clusters
2.3 差异蛋白的GO富集分析
Gene Ontology(GO)是一个国际标准化的基因本体功能分类体系工具,用来全面描述生物体中基因和蛋白的属性.GO总共有3个大类,分别描述参与的生物过程(BP),基因或蛋白的分子功能(MF)以及构成的细胞组件(CC)[12].差异蛋白的GO富集分析是通过显著差异蛋白和作为背景的全体鉴定蛋白相比,利用超几何检验找出显著富集的GO条目.
通过GO功能分类对3个比对组中的差异蛋白进行富集分析,将 3组中共同显著富集且差异蛋白数目较多的 GO条目列于表 2.在生物过程大类中,更多的蛋白参与氧化还原反应,前体代谢物和能量的产生,有机化合物氧化的能量来源以及呼吸作用,另外还包括一些代谢,比如鸟嘌呤核苷,三羧酸,GTP,小分子分解和单一生物分解的代谢过程.这说明荧蒽确实已经刺激到菌体的能量产生,改变了相关的呼吸方式,从而影响到细胞代谢的过程.这与 COG功能分类中能量产生与转换以及氨基酸转运与代谢所占比例最大结果相符.在分子功能大类中,主要富集的功能是活性能力,包括氧化还原活性,结构分子活性,巯基酸和碳硫键的连接活性.另外还有核糖体的结构,这与COG功能分类中翻译,核糖体结构与生物合成功能一致.这些表明菌体在代谢荧蒽时主要依靠蛋白的催化活性与核糖体作用的.在细胞组件这一大类中,差异蛋白更多地参与到高分子配合物,细胞器以及脂肪酸β-氧化多酶复合物的构成组件中,由此可知菌体在受到荧蒽胁迫时,绝大部分蛋白用于构建细胞,并维持细胞正常的生理机能.
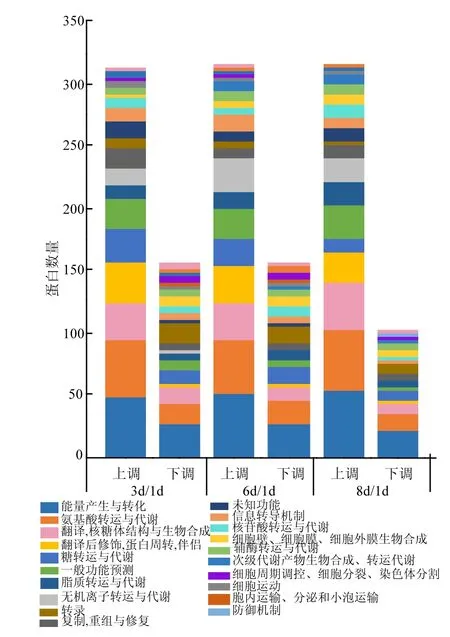
图4 3个比对组中差异蛋白的COG功能分类Fig.4 COG analysis of differentially expressed proteins in every cluster
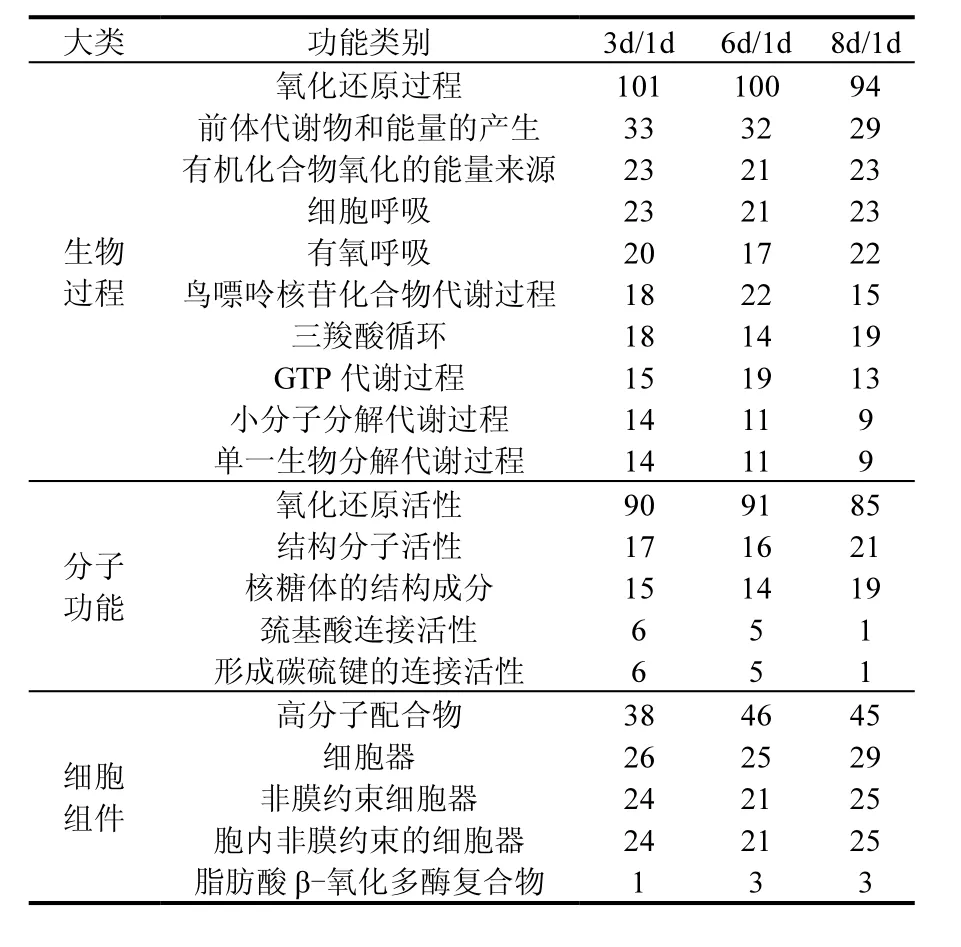
表2 3个比对组中差异蛋白数的GO富集分析Table 2 The enrichment of GO terms analysis of the number of differentially expressed proteins in three clusters
2.4 差异蛋白的pathway富集分析
KEGG (京都基因与基因组百科全书)是一个整合了基因组、化学和系统功能信息的[13],用于查询代谢通路、酶促通路、酶或编码酶的基因以及生物化学物质的在线数据库.其 Pathway途径数据库包含了相应生物通路中分子相互作用网络以及具体某个生物所特有的变化形式[14],确定蛋白质参与的最主要信号转导通路和生化代谢通路.在生物体内,不同蛋白相互协调,相互调控表现其生物学行为,基于 Pathway的分析更有助于了解基因或蛋白的生物学功能.差异蛋白的pathway富集分析与GO富集分析方法类似.
由图 5可见,在 3个比对组中共同参与的pathway富集通路有7个,分别是不同环境中的微生物代谢,碳代谢,糖酵解/糖异生,柠檬酸循环,丙酸盐代谢,核糖体和磷酸肌醇代谢.显然,这些途径中参与不同环境中的微生物代谢通路的蛋白数量最多,表明荧蒽刺激菌体激活了新的途径来适应新环境.而磷酸肌醇代谢在 3个比对组中的富集因子都较高,而且这一代谢通路还与下游的柠檬酸循环和糖酵解/糖异生代谢过程有关联,表明这一代谢与菌体降解荧蒽的关系更加密切.
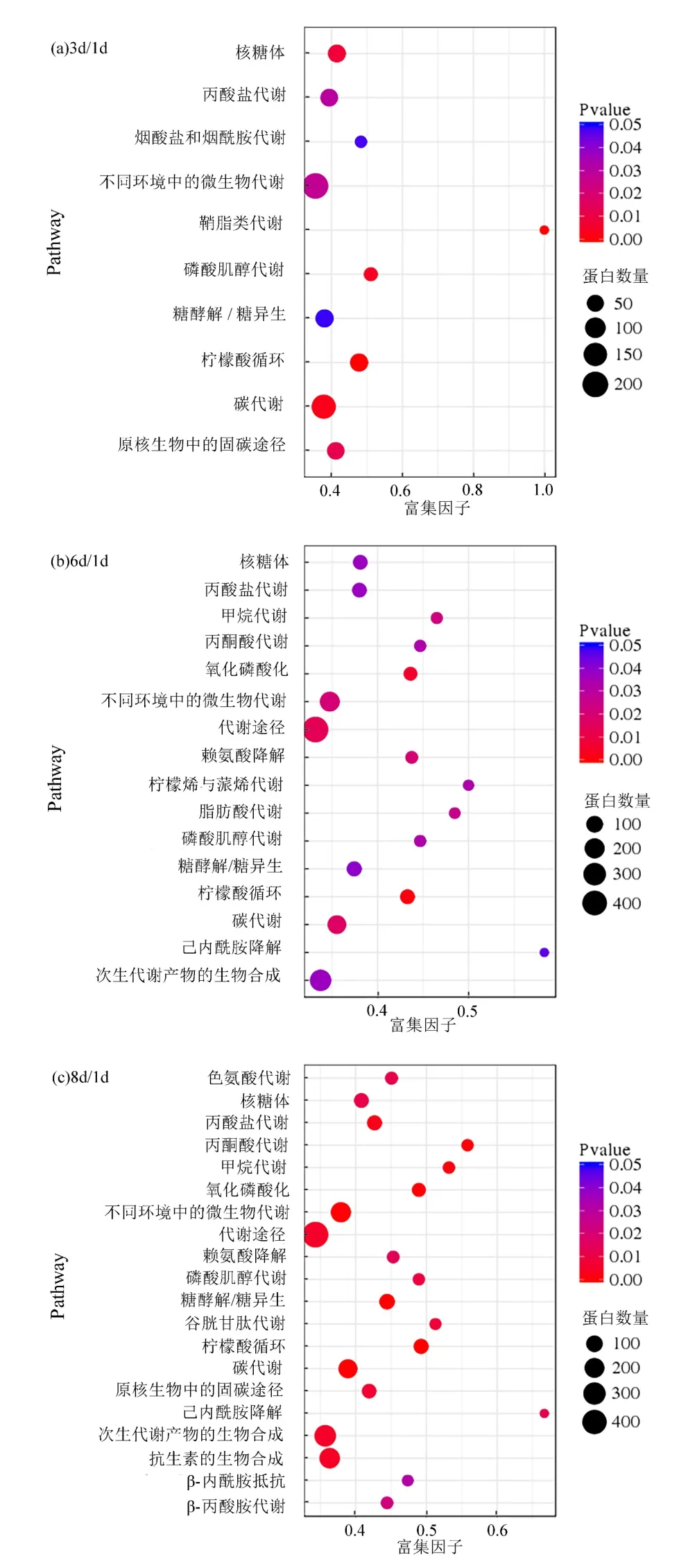
图5 3个比对组中差异蛋白的pathway富集Fig.5 Significant enrichment pathways analysis in three clusters
3 讨论
3.1 与代谢有关的共同差异蛋白
111个共同差异蛋白中有60个(包括24个上调和36个下调)参与到 7个代谢过程(能量产生与转化;氨基酸的转运与代谢;核苷酸的转运与代谢;糖的转运与代谢;辅酶的转运与代谢;脂质的转运与代谢;无机离子的转运与代谢).
细胞色素C是呼吸链的一员,在不同的氧化还原过程中发挥重要作用,是一种著名的电子转移蛋白[15].细胞色素氧化酶是新陈代谢旺盛的标志物[16].本实验中发现3个细胞色素氧化酶,其中包括细胞色素C氧化酶两个亚基明显上调,前者在3d/1d、6d/1d和8d/1d分别上调高达4.3,7.84和8.85倍,另一个是细胞色素泛醇氧化酶下调明显,在 3个比对组中平均下调 0.28倍.类似的,Jeng[17]等发现,神经元为了适应长期暴露在PAHs诱导下的低水平氧化应激环境,最初增加的就是细胞色素氧化酶的活性.
有 5个激酶有差异表达,上调的是甘油激酶和 2个二磷酸核苷激酶;下调的是脱氢葡萄糖激酶和磷酸烯醇丙酮酸羧激酶.有 2个三磷酸腺苷合成酶在3d/d上调明显,分别上调10倍和4.49倍.ATP合酶是由线粒体 DNA(mtDNA)编码,而mtDNA是细胞内氧化应激的主要目标,PAHs暴露情况下容易刺激该酶[18].结合蛋白有5个都上调表达,其中ATP结合蛋白有3个,其余是ABC转运底物结合蛋白和胞外溶质结合蛋白.ATP结合蛋白是细菌从环境中获取碳源以维持细菌生长基本活动最重要的途径[15].寡肽转运蛋白 Opp属于ABC型超家族,可以利用ATP水解产生的能量实现底物的转运[19]. OppC是组成底物进入细胞的通道跨膜蛋白,在三个比对组中平均上调4.31倍,说明荧蒽的跨膜运输通道能力大大提升.脱氢酶参与大部分生物的氧化还原反应,其中以催化供体醇基团、醛基团、酮基团和烷基团最为常见.本实验中有10个脱氢酶有表达差异:3个上调是二氢吡咯羧酸盐脱氢酶在 3d/1d上调 8.22倍,酰基辅酶a脱氢酶在6d/1d上调5.36倍,醛脱氢酶在8d/1d上调5.45倍.7个下调中变化显著的有甘油磷酸盐脱氢酶平均下调 0.25倍和醌蛋白葡萄糖脱氢酶平均下调0.26倍.下调数目高于上调数目,这表明荧蒽作为一种低生物可利用的不饱和物质,脱去氢离子是非常困难的,菌体不得不降低大部分对荧蒽降解无用的蛋白,而有针对性地提高关键脱氢酶的表达.
另外值得注意的差异蛋白还有超氧化物歧化酶,它是一种抗氧化剂蛋白[20].在分枝杆菌JS14降解荧蒽时,作为一种排毒蛋白,该酶上调表达,以缓和氧化应激压力的外界条件[21].琥珀酰辅酶合成酶在3d/1d上调高达8.83倍,它是一种线粒体酶,在 TCA循环中能催化从琥珀酰-CoA到琥珀酸和游离辅酶 a的可逆过程[22].5-甲基四氢蝶酰三谷氨酸-同型半胱氨酸甲基转移酶主要参与了蛋氨酸的生物合成,在三个比对组中下调非常明显,分别为 0.19、0.31和 0.21倍,这说明荧蒽强烈抑制了蛋氨酸的生成.而在菲诱导冬小麦根系时,此酶是显著上调的[23].
3.2 与信息储存和传递有关的共同差异蛋白
111个共同差异蛋白中有14个(包括4个上调,10个下调)参与到 3个信息储存与传递过程(翻译,核糖体结构与生物合成;转录;复制,重组与修复).在不同的生存环境中,菌体必须改变自身转录,翻译和修饰方面的相关蛋白以产生不同的基因表达.
核糖体蛋白有 3个且都显著上调,分别是30S ribosomal protein S10(平均上调5.62倍), 50S ribosomal protein L18partial(平均上调 4.13倍)和30S ribosomal protein S2(平均上调3.04倍).在很多蛋白质组学研究中,核糖体蛋白的表达变化总是占很大部分.菌株SJTE-1改变了8种核糖体的蛋白表达水平,这有助于菌体适应受限制的雌激素条件,减少毒性作用,并保证细胞的正常新陈代谢[15].有 3个 tRNA酶都下调,其中2个合成酶,分别是异亮氨酰tRNA合成酶和甘氨酰基tRNA合成酶,还有1个连接酶是蛋氨酸tRANA连接酶,这与上述 5-甲基四氢蝶酰三谷氨酸-同型半胱氨酸甲基转移酶抑制蛋氨酸的生物合成结果相符.
3.3 与细胞过程和信号有关的共同差异蛋白
111个共同差异蛋白中有14个(包括7个上调和7个下调)参与到6个细胞过程和信号过程(细胞周期调控,细胞分裂,染色体分割;细胞壁/细胞膜/细胞外膜生物合成;细胞运动;翻译后修饰,蛋白周转,伴侣;信号转导机制;胞内运输,分泌和小泡运输).
趋化性蛋白显著上调平均5.25倍,鞭毛蛋白发生上调平均3.28倍,这也许是菌体为了接触并摄取更多的荧蒽营养物质而提高自身运动活性的结果.有3个转移酶且都下调,分别是辛酮糖酸转移酶,糖基转移酶/转肽酶和前蛋白移位酶.
3.4 其他共同差异蛋白
111个共同差异蛋白中有23个(包括20个上调和 3个下调)参与到其他过程(一般功能预测,未知功能等).
有 3个孢被蛋白都上调表达,这表明菌体在不良碳源环境可促进芽孢的形成.有 2个免疫抑制剂前体物发生上调,表明菌体抵御外界毒性,排除代谢物及有毒物质以保护菌体自身代谢活动.
4 结论
4.1 以荧蒽诱导 1d的菌体蛋白为对照,设置三个比对组分别为 3d/1d, 6d/1d和 8d/1d.以Q-value≤0.05 和 Fold change>2(即上调>2,下调<0.5)为差异蛋白的筛选条件,共鉴定到796个差异蛋白,其中表达上调的 613个,下调的 183个.共同差异表达蛋白数目为111个,其中上调为56个,下调为55个.
4.2 通过 COG功能分析发现绝大部分差异蛋白参与到能量产生与转化,氨基酸转运与代谢,以及翻译,核糖体结构与生物合成过程.
4.3 通过GO富集分析发现大部分蛋白参与到生物过程中的氧化还原反应,能量产生和代谢过程,在分子功能中主要参与氧化还原活性,在细胞组件中更多蛋白参与到高分子配合物和细胞器部分.
4.4 通过 pathway富集分析发现参与不同环境中的微生物代谢通路的蛋白数量最多,磷酸肌醇代谢在三个比对组中的富集因子都较高.
4.5 111个共同差异蛋白中参与代谢有关的蛋白数目最多,关键的上调蛋白有细胞色素 C、三磷酸腺苷合成酶、二磷酸核苷激酶等激酶,还有一些结合蛋白和脱氢酶等;下调显著的是5-甲基四氢蝶酰三谷氨酸-同型半胱氨酸甲基转移酶.参与信息储存与传递有关的共同差异蛋白主要是核糖体蛋白.与细胞过程和信号有关的共同差异蛋白主要是趋化性蛋白和鞭毛蛋白.还有一些其他蛋白共同组成蛋白互作网络从而降解荧蒽.
[1]Haritash A K, Kaushik C P. Biodegradation aspects of Polycyclic Aromatic Hydrocarbons (PAHs): A review [J]. Journal of Hazardous Materials, 2009,169(1—3):1-15.
[2]Ross P, Huang Y, Marchese J, et al. Multiplexed Protein Quantitation in Saccharomyces cerevisiae Using Amine-reactive Isobaric Tagging Reagents [J]. Molecular & Cellular Proteomics,2004,3(12):1154-1169.
[3]Evans C, Noirel J, Ow S Y, et al. An insight into iTRAQ: where do we stand now? [J]. Analytical and Bioanalytical Chemistry,2012,404(4):1011-1027.
[4]施旭骏,赵 超,牛 辰,等.应用iTRAQ定量蛋白质组学研究海分枝杆菌 mkl的基因功能 [J]. 微生物学报, 2016,56(9):1496-1503.
[5]朱传智,赵雁林,黄香玉,等.定量蛋白质组学分析链霉素耐药和敏感结核分枝杆菌临床分离株 [J]. 微生物学报, 2013,53(2):154-163.
[6]林小琼.基于iTRAQ技术的高效表达木聚糖酶重组毕赤酵母细胞的蛋白组学研究 [D]. 广州:华南理工大学, 2013.
[7]廖丽萍.短短芽孢杆菌对芘降解特性及差异蛋白分析 [D]. 广州:暨南大学, 2015.
[8]Wen B, Zhou R, Feng Q, et al. IQuant: An automated pipeline for quantitative proteomics based upon isobaric tags [J].PROTEOMICS, 2014,14(20):2280-2285.
[9]Brosch M, Yu L, Hubbard T, et al. Accurate and Sensitive Peptide Identification with Mascot Percolator [J]. Journal of Proteome Research, 2009,8(6):3176-3181.
[10]Savitski M M, Wilhelm M, Hahne H, et al. A Scalable Approach for Protein False Discovery Rate Estimation in Large Proteomic Data Sets [J]. Molecular & cellular proteomics, 2015,14(9):2394-2404.
[11]Roman L Tatusov N D F J, Boris Kiryutin E V K D, Mekhedov S L, et al. The COG database: an updated version includes eukaryotes [J]. Bmc Bioinformatics, 2003,4:41-56.
[12]Ashburner M, Ball C, Blake J, et al. Gene Ontology:tool for the unification of biology [J]. Nature Genetics, 2000,25(1):25-29.
[13]Kanehisa M. From genomics to chemical genomics: new developments in KEGG [J]. Nucleic Acids Research, 2006,34(90001):D354-D357.
[14]黄莹莹,白 羽,王 艳,等.基于iTraq技术的加拿大一枝黄花提取物作用下铜绿微囊藻细胞差异表达蛋白 [J]. 中国环境科学,2015,35(6):1822-1830.
[15]Xu J, Zhang L, Hou J, et al. iTRAQ-based quantitative proteomic analysis of the global response to 17β-estradiol in estrogendegradation strain Pseudomonas putida SJTE-1 [J]. Scientific Reports, 2017,7:41682.
[16]Crépeaux G, Grova N, Bouillaud-Kremarik P, et al. Short-term effects of a perinatal exposure to a 16polycyclic aromatic hydrocarbon mixture in rats: Assessment of early motor and sensorial development and cerebral cytochrome oxidase activity in pups [J]. NeuroToxicology, 2014,43:90-101.
[17]Jeng H A. Chemical composition of ambient particulate matter and redox activity [J]. Environmental Monitoring and Assessment,2010,169(1-4):597-606.
[18]Woo S, Lee A, Denis V, et al. Transcript response of soft coral(Scleronephthya gracillimum) on exposure to polycyclic aromatic hydrocarbons [J]. Environmental Science and Pollution Research,2014,21(2):901-910.
[19]张伟欣,李春阳,陈秀兰.细菌肽转运蛋白的研究进展 [J]. 微生物学通报, 2014,41(9):1856-1863.
[20]Han J, Gao P, Zhao S, et al. iTRAQ-based proteomic analysis of LI-F type peptides produced by Paenibacillus polymyxa JSa-9mode of action against Bacillus cereus [J]. Journal of Proteomics,2017,150:130-140.
[21]Lee S, Seo J, Keum Y, et al. Fluoranthene metabolism and associated proteins in Mycobacterium sp. JS14 [J]. Proteomics,2007,7(12):2059-2069.
[22]Quan X, Sato-Miyata Y, Tsuda M, et al. Deficiency of succinyl-CoA synthetase α subunit delays development, impairs locomotor activity and reduces survival under starvation in Drosophila [J]. Biochemical and Biophysical Research Communications, 2017,483(1):566-571.
[23]Shen Y, Du J, Yue L, et al. Proteomic analysis of plasma membrane proteins in wheat roots exposed to phenanthrene [J].Environmental Science and Pollution Research, 2016,23(11):10863-10871.

