齐墩果酸通过PPARγ调控人脐静脉内皮细胞抗氧化损伤作用
朱宝华 谷春景 刘凤莲 刘璐 任艳红
动脉粥样硬化(atherosclerosis,AS)是一种常见的心血管致死性疾病,成为所有心血管疾病中的主要危险因子。目前,AS被认为是一种与血管壁脂质沉积相关的,且由免疫介导的慢性炎症性疾病,它的发病机制极其复杂。低密度脂蛋白(low density lipoprotein,LDL)是AS发生发展过程中的一个主要危险分子,其在AS中的主要表现形式是氧化LDL(oxidative-LDL,ox-LDL)。ox-LDL不仅可导致内皮细胞损伤,还可促进内皮细胞凋亡的发生,增强内皮通透性,也能够促使单核细胞向内皮细胞发生迁移,加强其附着力,从而促使AS的发生发展[1-2]。因此,阻止血管内皮细胞的病变对治疗AS具有重要的临床价值。
齐墩果酸(oleanolic acid,OA)是属于五环三萜类化合物,以游离或者成苷的形式存在,其在食物、药用植物等多种植物中广泛存在。研究表明,OA具有抗氧化[3]、抗炎[4]以及抗AS[5]等多种生物学功能。本课题组已有的发现表明,OA对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)氧化损伤具有保护作用[6-7]。但是,OA的这种抗内皮细胞氧化损伤作用机制尚未明确,需要进一步探讨和研究。
过氧化物酶体增殖激活受体γ(peroxisome proliferator-activated receptor,PPARγ)是一种配体依赖的核转录因子,属于核受体超家族成员。PPARγ在血管壁内皮细胞、血管平滑肌细胞、巨噬细胞和泡沫细胞都有较高水平的表达[8]。在心血管系统中,PPARγ可通过抗炎作用,抑制血管平滑肌增殖迁移,保护血管内皮细胞,增加胆固醇的逆向转运等作用发挥抗AS效应[9]。基于PPARγ抗AS功能以及本小组的前期研究结果,认为PPARγ在OA的抗内皮细胞氧化损伤中扮演重要角色,并初步探讨PPARγ参与OA抗内皮细胞氧化损伤作用的分子机制。
材料与方法
一、试剂:齐墩果酸(OA,≥99%)购买于美国Sigma公司;DMEM培养基以及胎牛血清购买于美国Gibco公司;BCA蛋白定量试剂盒购买于上海碧云天公司;MTT购买于美国Sigma公司。SOD、GSH-Px、MDA检测试剂盒购自武汉优尔生公司;ROS试剂盒由上海碧云天公司提供;PPARγ抑制剂GW9662由美国Cayman公司提供;抗PPARγ单克隆抗体购自美国CST公司;羊抗鼠抗体购自美国Cell Signaling公司。
二、实验方法
1.实验分组:对照组,ox-LDL模型组,ox-LDL+OA(10 μmol/L,20 μmol/L,40 μmol/L)组,ox-LDL+OA(10 μmol/L,20 μmol/L,40 μmol/L)+GW9662,GW9662单独处理组。
2.细胞培养:将HUVECs(购买于中国科学院上海细胞库)按(密度)接种于培养瓶或者培养板中,加入适量含有10%胎牛血清DMEM培养基培养细胞,置于一定条件(37 ℃,5% CO2)的培养箱中进行培养。待细胞生长至70%~ 80%融合度,用胰酶消化细胞,并按1:3 ~ 5进行传代培养。
3. MTT实验:将处于对数生长期的HUVECs(5×103个/孔)均匀接种到96孔板中,放置于细胞培养箱中孵育。药物处理细胞结束后,向每孔中加入5 mg/ml的MTT(20 μl)试剂,置于培养箱中孵育4 h,去掉上清液,加入150 μl DMSO,37 ℃培养箱中孵育30 min,充分溶解结晶物,在波长为570 nm的条件下,用酶标仪检测每孔的吸光度(A)值。
4.脂质过氧化物检测:HUVECs的SOD、GSH以及MDA水平都是应用酶联免疫吸附试验法,其主要区别是微孔板包被的单克隆抗体不同。具体操作步骤参考试剂盒说明书。所有标准品、样本加入微孔板后,经孵育、洗涤、二抗孵育、洗涤、加入底物显色并终止,在波长为450 nm的条件下,用酶标仪测定样品A值,并建立标准曲线,计算出样品浓度。
细胞内ROS水平运用活性氧检测试剂盒,主要利用DCFH-DA荧光探针的强度来反应细胞内ROS的浓度。详细的操作步骤参考试剂盒说明书,最后,用流式细胞仪检测。
5. Western blot检测PPARγ蛋白的表达水平:药物处理细胞后,提取细胞蛋白进行,使用蛋白定量试剂盒测定各组蛋白浓度,经聚丙烯酰胺凝胶电泳(SDS-PAGE)分离细胞蛋白,应用湿转法将蛋白转印至PVDF膜上,用5%脱脂牛奶对PVDF膜进行封闭,于4 ℃条件下过夜孵育一抗(PPARγ、β-actin),抗体稀释比例均为1:1 000。用TBST于摇床上洗涤PVDF膜3次,每次10 min。室温孵育二抗60 min。用TBST于摇床上洗涤PVDF膜3次,每次10 min。加入显色剂,用成像仪显影。
三、统计学分析方法
使用SPSS 20统计软件对数据进行统计分析,细胞存活率、SOD、GSH、MDA、ROS相对荧光强度以及PPARγ蛋白水平实验数据用±s表示,多组间比较使用单因素方差分析,组与组之间的比较采用两样本t检验,以P< 0.05为差异具有统计学意义。
结 果
一、OA提高ox-LDL诱导的HUVECs细胞存活率结果
MTT检测结果显示,ox-LDL组的细胞存活率为(49.17±0.62)%,OA(10、20、40 μmol/L)预处理可显著减弱ox-LDL对HUVECs细胞存活率的降低,其存活率分别为(68.51±1.16)%、(82.64±0.73)%、(92.37±0.13)%,差异具有统计学意义(t= 24.35,26.18,35.17,P= 0.034,0.027,0.008);且呈剂量依赖性关系,以上结果提示OA可拮抗ox-LDL诱导HUVECs细胞的细胞损伤(图1)。
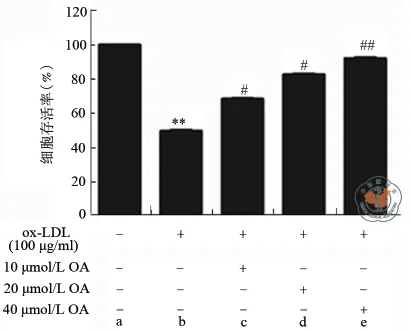
图1 OA对ox-LDL抑制HUVECs细胞活力的影响
二、OA逆转ox-LDL诱导HUVECs的氧化损伤结果
本研究进一步探讨了OA对ox-LDL作用下HUVECs细胞的抗氧化物质SOD、GSH活性和氧化损伤相关指标ROS、MDA水平的影响。结果发现,ox-LDL组的细胞SOD、GSH、ROS和MDA水平,与ox-LDL+OA(10 μmol/L)组、ox-LDL+OA(20 μmol/L)组、ox-LDL+OA(40 μmol/L)组的细胞SOD、GSH、ROS和MDA水平比较,差异具有统计学意义(P< 0.05)。同时,本研究还发现,OA对ox-LDL诱导的HUVECs细胞SOD、GSH活性的降低和MDA、ROS水平的增加抑制作用呈剂量依赖关系。以上结果表明OA可抑制ox-LDL诱导HUVECs细胞SOD,GSH含量的降低以及ROS和MDA水平的增加(表1)。
三、OA减弱ox-LDL对HUVECsPPARγ蛋白的下调作用结果
基于PPARγ抗动脉粥样硬化作用,于是猜想OA抗ox-LDL氧化损伤作用是否与调控内皮细胞PPARγ的表达水平有关。因此,进一步检测预处理OA的情况下,ox-LDL作用下的HUVECs细胞中PPARγ蛋白水平是否有变化。Western blot结果显示,OA预处理能明显逆转ox-LDL诱导的PPARγ蛋白水平的降低,且随着浓度的增加,OA的这种逆转作用也不断提高。以上结果提示,OA可拮抗ox-LDL导致的HUVECs细胞PPARγ蛋白水平的降低 (图2)。

图2 OA对ox-LDL抑制HUVECs细胞PPARγ蛋白表达水平的影响
表1 OA对ox-LDL抑制HUVECs细胞氧化损伤的影响(±s)
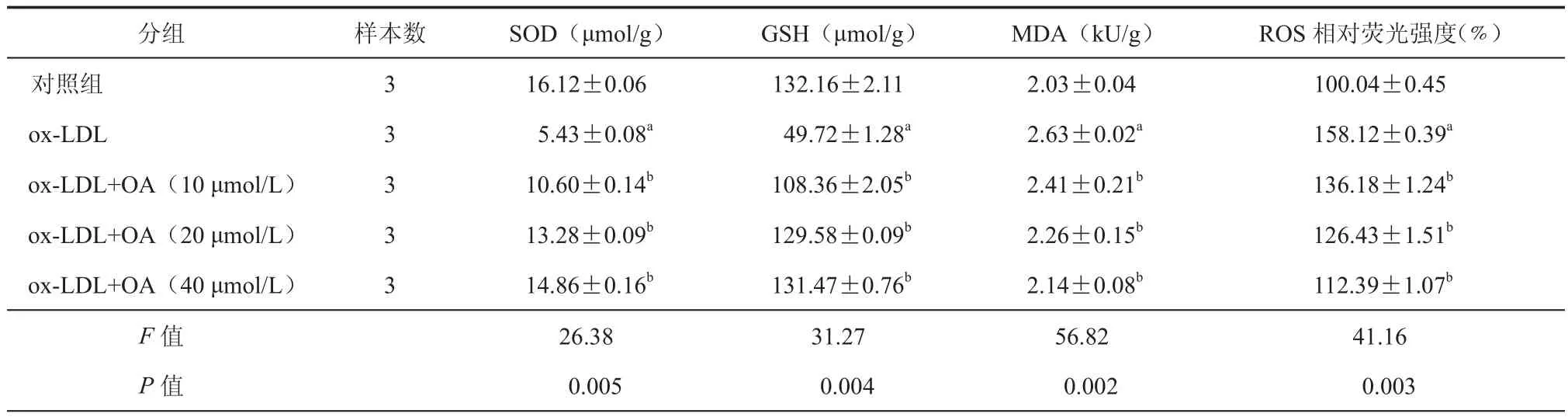
表1 OA对ox-LDL抑制HUVECs细胞氧化损伤的影响(±s)
注:与对照组比较,aP < 0.01;与ox-LDL组比较,bP < 0.01
分组样本数SOD(μmol/g)GSH(μmol/g)MDA(kU/g)ROS相对荧光强度(%)对照组316.12±0.06132.16±2.112.03±0.04100.04±0.45 ox-LDL3 5.43±0.08a 49.72±1.28a 2.63±0.02a 158.12±0.39a ox-LDL+OA(10 μmol/L)3 10.60±0.14b 108.36±2.05b 2.41±0.21b 136.18±1.24b ox-LDL+OA(20 μmol/L)3 13.28±0.09b 129.58±0.09b 2.26±0.15b 126.43±1.51b ox-LDL+OA(40 μmol/L)3 14.86±0.16b 131.47±0.76b 2.14±0.08b 112.39±1.07b F值26.3831.2756.8241.16 P值 0.005 0.004 0.002 0.003
表2 PPARγ抑制剂对OA抗ox-LDL抑制HUVECs细胞氧化损伤的影响(±s)
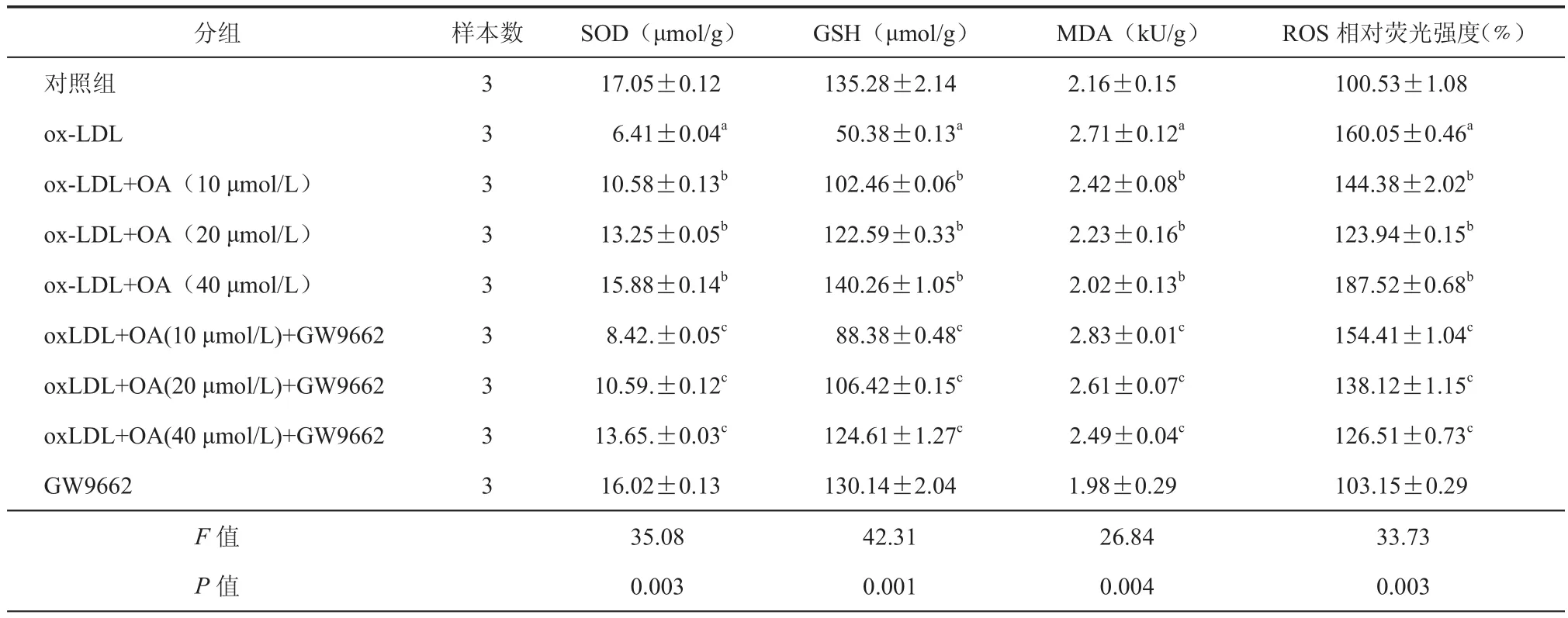
表2 PPARγ抑制剂对OA抗ox-LDL抑制HUVECs细胞氧化损伤的影响(±s)
注:与对照组比较,aP < 0.01;与ox-LDL组比较,bP < 0.01;与各自ox-LDL+OA组比较,cP < 0.01
分组样本数SOD(μmol/g)GSH(μmol/g)MDA(kU/g)ROS相对荧光强度(%)对照组3 17.05±0.12135.28±2.142.16±0.15100.53±1.08 ox-LDL3 6.41±0.04a 50.38±0.13a2.71±0.12a160.05±0.46a ox-LDL+OA(10 μmol/L)3 10.58±0.13b 102.46±0.06b2.42±0.08b144.38±2.02b ox-LDL+OA(20 μmol/L)3 13.25±0.05b 122.59±0.33b2.23±0.16b123.94±0.15b ox-LDL+OA(40 μmol/L)3 15.88±0.14b 140.26±1.05b2.02±0.13b187.52±0.68b oxLDL+OA(10 μmol/L)+GW96623 8.42.±0.05c 88.38±0.48c2.83±0.01c154.41±1.04c oxLDL+OA(20 μmol/L)+GW96623 10.59.±0.12c 106.42±0.15c2.61±0.07c138.12±1.15c oxLDL+OA(40 μmol/L)+GW96623 13.65.±0.03c 124.61±1.27c2.49±0.04c126.51±0.73c GW96623 16.02±0.13130.14±2.041.98±0.29103.15±0.29 F值35.0842.3126.8433.73 P值0.0030.0010.0040.003
四、PPARγ抑制剂部分逆转OA对ox-LDL抑制HUVECs细胞活力的拮抗作用结果
为了探讨PPARγ在OA抗ox-LDL导致的HUVECs细胞氧化损伤的作用,首先检测了PPARγ抑制剂GW9662(10 μmol/L)预处理对OA拮抗ox-LDL导致的HUVECs细胞活力降低的影响。结果显示,与ox-LDL+OA(20 μmol/L)组比较,ox-LDL+OA(20 μmol/L)+GW9662组的细胞活力明显降低,为(63.31±1.15)%。以上结果表明GW9662预处理可部分逆转OA对ox-LDL导致的HUVECs细胞存活率降低的拮抗作用,提示PPARγ蛋白可能参与了OA的抗ox-LDL导致的HUVECs细胞氧化损伤作用(图3)。
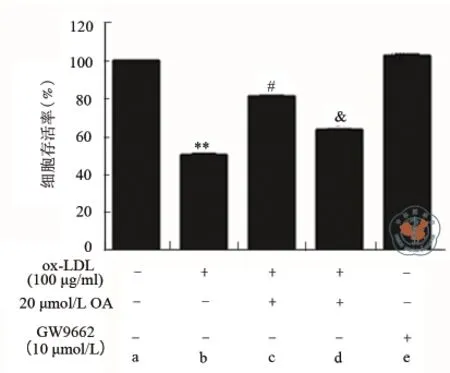
图3 PPARγ抑制剂对OA抗ox-LDL抑制HUVECs细胞活力的影响
五、PPARγ抑制剂可减弱OA对ox-LDL诱导HUVECs细胞氧化损伤的改善作用结果
接下来本研究探讨PPARγ抑制剂GW9662对OA抗ox-LDL诱导HUVECs细胞氧化损伤的逆转作用,以进一步阐明PPARγ蛋白对OA拮抗ox-LDL诱导HUVECs细胞氧化损伤的介导作用。结果显示,与ox-LDL+OA(10 μmol/L)组比较,ox-LDL+OA(10 μmol/L)+GW9662组的SOD、GSH水平明显降低而MDA、ROS水平明显升高与ox-LDL+OA(20 μmol/L)组比较,ox-LDL+ OA(20 μmol/L)+GW9662组的SOD、GSH水平明显降低而MDA、ROS水平明显升高与ox-LDL+OA(40 μmol/ L)组比较,ox-LDL+OA(40 μmol/ L)+GW9662组的SOD、GSH水平明显降低,而MDA、ROS水平明显升高。此外,本研究还发现,抑制PPARγ后,OA抑制ox-LDL诱导的HUVECs细胞的氧化损伤仍存在剂量效应。以上结果表明PPARγ抑制剂GW9662OA预处理可减弱OA对ox-LDL诱导的HUVECs细胞SOD,GSH含量降低以及ROS和MDA水平增加的抑制作用,提示OA可通过PPARγ拮抗ox-LDL导致的HUVECs细胞氧化损伤(表2)。
讨 论
氧化应激在心血管疾病的发生发展中扮演着重要角色,特别是活性氧常常伴随在AS的发展过程中[10-11]。过多活性氧的产生可直接损伤细胞膜、蛋白质和DNA。且线粒体DNA对氧化损伤极其敏感[11]。最近有研究表明,活性氧水平的增加参与炎症的发生,可导致血流量和剪切应力的异常以及诱导动脉壁的重塑[12]。正常生理条件下,机体的抗氧化系统能够消除多余的活性氧,发挥抗氧化应激功能。然而,当机体处于病理状态时,细胞内活性氧生成量增加,抗氧化物酶活性受到抑制,进而损伤蛋白质、脂质和核酸等生物大分子,导致细胞功能发生障碍,最终诱导有关疾病的形成[13-14]。机体调控活性氧的抗氧化剂主要有由抗氧化剂如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)以及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)[15]。有研究表明,ox-LDL的生产量增加可促进AS进程[16]。GALLE和他的同事等发现,浓度为10 ~ 300 mg/L的ox-LDL可诱导HUVEC细胞中活性氧的产生,并呈浓度依赖性关系,且高浓度的ox-LDL可诱导内皮细胞发生死亡[17]。
OA是一种天然的五环三萜类化合物,普遍存在于许多的药用植物中,能够产生抗氧化效应。目前的研究资料表明,OA在治疗氧化应激有关的疾病包括炎症、糖尿病以及癌症等方面取得了明显的效果[18]。研究进一步发现,OA的抗氧化作用与其提高多种抗氧化酶的活性有关[19]。本研究结果显示,浓度为10 μmol/L,20 μmol/L和40 μmol/L的OA预处理可显著减弱ox-LDL对HUVECs细胞存活率的抑制作用,且呈浓度依赖性关系。为了探讨OA对ox-LDL诱导的HUVECs细胞氧化应激的影响,本研究检测了OA对ox-LDL作用下的抗氧化剂SOD和GSH活性以及氧化应激相关指标ROS和MDA水平的影响。结果显示,OA预处理可减弱ox-LDL诱导HUVECs细胞SOD,GSH含量的降低。同时,OA预处理可拮抗ox-LDL诱导HUVECs细胞ROS和MDA水平的增加。以上结果表明OA可改善ox-LDL诱导HUVECs细胞的氧化损伤。
PPARγ是核受体超家族成员之一,其在心血管疾病中起重要作用。PPARγ可通过抗炎,保护血管内皮细胞以及抑制血管平滑肌增殖和迁移作用发挥抗AS功能[9]。有趣的是,γ-谷氨酰半胱氨酸乙酯对环磷酰胺诱导的肝损伤的保护作用与PPARγ的表达上调以及氧化应激的减弱有关[20]。以上资料提示,PPARγ在OA抗ox-LDL诱导HUVECs细胞的氧化损伤中具有重要作用。于是,首先检测了OA对ox-LDL作用下的HUVECs细胞中PPARγ蛋白表达的影响。结果显示,OA能剂量依赖性的抑制ox-LDL诱导的PPARγ蛋白水平的下调,这表明OA可减弱ox-LDL导致的HUVECs细胞PPARγ蛋白水平的降低。为了进一步确定PPARγ蛋白是否参与OA的抗ox-LDL导致的HUVECs细胞氧化损伤作用,接着探讨了PPARγ抑制剂GW9662预处理对OA抗ox-LDL诱导HUVECs细胞氧化损伤的影响,以阐明PPARγ蛋白对OA拮抗ox-LDL导致的HUVECs细胞氧化损伤的介导作用。结果显示,PPARγ抑制剂可逆转OA对ox-LDL抑制HUVECs细胞活力的拮抗作用。此外,抑制PPARγ后,OA减弱ox-LDL诱导的HUVECs细胞活性降低仍存在剂量效应。本研究进一步发现PPARγ抑制剂GW9662OA可减弱OA对ox-LDL诱导HUVECs细胞,SOD,GSH含量的降低以及ROS和MDA水平的增加的抑制作用。此外,抑制PPARγ后,OA抑制ox-LDL诱导的HUVECs细胞的氧化损伤仍存在剂量效应。这表明抑制PPARγ蛋白表达可部分逆转OA对ox-LD导致的HUVECs细胞氧化损伤,提示OA可通过PPARγ拮抗ox-LDL导致的HUVECs细胞氧化损伤。
综上所述,OA对ox-LDL诱导的HUVECs细胞氧化产生保护作用的分子机制与其调控PPARγ蛋白有关,这为OA治疗AS的分子机制提供了新的视角。
1 Libby P, Ridker PM, Hansson GK. Progress and challenges in translating the biology of atherosclerosis[J]. Nature, 2011,473(7347):317-325.
2 Vogiatzi G, Tousoulis D, Stefanadis C. The role of oxidative stress in atherosclerosis[J]. Hellenic J Cardiol, 2009, 50(5):402-409.
3 Goyal SN, Mahajan UB, Chandrayan GA, et al. Protective effect of oleanolic acid on oxidative injury and cellular abnormalities in doxorubicin induced cardiac toxicity in rats[J]. Am J Transl Res, 2016,8(1):60-69.
4 Yang EJ, Lee W, Ku SK, et al. Anti-infl ammatory activities of oleanolic acid on HMGB1 activated HUVECs[J]. Food Chem Toxicol, 2012,50(5):1288-1294.
5 Buus NH, Hansson NC, Rodriguez-Rodriguez R, et al. Antiatherogenic effects of oleanolic acid in apolipoprotein E knockout mice[J]. Eur J Pharmacol, 2011, 670(2-3):519-526.
6 王玉, 韩志武. 齐墩果酸对氧化损伤人脐静脉内皮细胞线粒体中一氧化氮合酶的调控作用[J]. 中国药房, 2015(19):2617-2620.
7 王道艳, 王志, 张峥, 等. 齐墩果酸对oxLDL诱导人脐静脉内皮细胞氧化损伤的保护作用[J]. 青岛大学医学院学报, 2014 (6):487-489.
8 Wang C, Gan Q, Han S, et al. The regulation of peroxisome proliferator-activated receptor-gammaon apoptotic related genes p53 and bcl-2 in cultured vascular smooth muscle cells[J]. Chinese Journal of Pathophysiology, 2004, 20(4):590-594.
9 朱莹, 张文高, 郑广娟, 等. PPARγ与动脉粥样硬化及中医药干预研究[J]. 中西医结合心脑血管病杂志, 2007, 5(3):225-227.
10 He F, Li Z. Redox roles of reactive oxygen species in cardiovascular diseases[J]. Int J MolSci, 2015, 16(11):27770-27780.
11 Cai H, Harrison DG. Endothelial dysfunction in cardiovascular diseases: the role of oxidant stress[J]. Circ Res, 2000, 87(10):840-844.12 Alexander RW. Pathogenesis of atherosclerosis: redox signaling as a unifying theme[J]. Georgia Tech, 2003,114:273.
13 Yao YS, Wang YB, Zhang YB, et al. Klotho ameliorates oxidized low density lipoprotein(ox-LDL)-induced oxidative stress via regulating LOX-1 and PI3K/Akt/eNOSpathways[J]. Lipids Health Dis, 2017,16(1):77.
14 Ganguly G, Chakrabarti S, Chatterjee U, et al. Proteinopathy, oxidative stress and mitochondrial dysfunction: cross talk in Alzheimer's disease and Parkinson's disease[J]. Drug Des DevelTher, 2017, 11:797-810.
15 Victor VM, Rocha M, Fuente ML. Immune cells:free radicals and antioxidants in sepsis[J]. IntImmunopharmacol, 2004, 4(3):327-347.
16 Zampetaki A, Dudek K, Mayr M. Oxidative stress in atherosclerosis:The role of microRNAs in arterial remodeling[J]. Free Radical Biology and Medicine, 2013, 64(SI):69-77.
17 Galle J, Heinloth A, Wanner C, et al. Dual effect of oxidized LDL on cell cycle in human endothelial cells through oxidative stress[J].Kidney IntSuppl, 2001, 78(78):S120-S123.
18 Liu J. Oleanolic acid and ursolic acid: research perspectives[J]. J Ethnopharmacol, 2005, 100(1-2):92-94.
19 Liu JZ, Wang X, Liu R, et al. Oleanolic acid co-administration alleviates ethanol-induced hepatic injury via Nrf-2 and ethanolmetabolizing modulating in rats[J]. ChemBiol Interact, 2014,221:88-98.
20 Alqahtani S, Mahmoud AM. Gamma-glutamylcysteine ethyl ester protects against cyclophosphamide-induced liver injury and hematologic alterations via upregulation of PPARγ and attenuation of oxidative stress, inflammation, and apoptosis[J]. Oxid Med Cell Longev, 2016, 2016: 4016209.

