干细胞对皮肤瘢痕的治疗作用
张文博 孙善全
以成纤维细胞过度增生和细胞外基质过度聚集为基本病理特征的皮肤瘢痕形成,是皮肤损伤愈合后最常见的并发症之一,通常是真皮损伤后组织异常修复的结果。皮肤瘢痕主要表现为增生性瘢痕或(和)瘢痕疙瘩,常伴有瘙痒、疼痛、感染、甚至导致功能障碍,特别是出现在面部的瘢痕,严重影响美观,给患者的身心带来极大伤害。皮肤瘢痕的治疗,目前多采用手术切除,皮质类固醇、抗代谢药、免疫抑制剂,放射、激光治疗以及冷冻、加压疗法,硅胶凝胶膜外贴,咪喹莫特外用等的综合治疗等,但效果不够理想,复发率极高,成为长期困扰整形外科、皮肤科的难题。
干细胞由于具有调节免疫、抗炎、抗纤维化等作用,其在皮肤瘢痕防治中的作用,越来越受到人们的重视[1-3],肯定、良好的治疗效果使人们备受鼓舞[4-7],但目前的研究,多集中在干细胞促进皮肤伤口愈合、减少疤痕形成方面,干细胞对已经形成的皮肤瘢痕治疗效果的研究相对较少,而干细胞对皮肤瘢痕的治疗作用,更是临床的迫切需求。
为评估干细胞对皮肤瘢痕的治疗作用,探索皮肤疤痕的有效治疗方法,本文对干细胞对皮肤瘢痕的治疗作用进行综述。
一、干细胞治疗皮肤瘢痕的实验研究
1.兔自体脂肪源性干细胞(adipose-derived mesenchymal stem cells,ADSCs)抑制早期增生性瘢痕进展:Chen 等[8]将取自腹股沟区的ADSCs,以5×106个/ml的浓度,每3天1次、共3次,注射在新西兰兔耳腹侧面、直径6 mm皮肤缺损25 d后、形成的增生性瘢痕(hyperplastic scar)处,实验结果见,ADSCs治疗使增生性瘢痕变得小、扁平、柔软、色素浅,胶原密度显著下降、排列规律,Ⅰ型胶原蛋白、Ⅲ型胶原蛋白含量减少,转化生长因子-β(transforming growth factor-β,TGF-β)1表达显著降低,证明,自体ADSCs移植,可以抑制增生性瘢痕早期阶段的进展。张琪等[9]将新西兰兔ADSCs,以2×107个/ml浓度,环形注射在兔耳1 cm损伤形成的疤痕处,发现ADSCs瘢痕内注射可以降低α-SMA、CollagenⅠ基因表达,改善瘢痕内胶原堆积,改善瘢痕增生情况。卞媛媛等[10]实验亦证实,5×106个/ml浓度的ADSCs,对兔耳增生性瘢痕的发展有抑制作用。
2.人ADSCs通过刺激早期增生性瘢痕重建,发挥对瘢痕的治疗作用:Yun等[11]将人抽脂术分离、培养的ADSCs,以1×106个/ml浓度,注射在约克郡猪背部3 cm×3 cm全厚度皮肤缺陷50 d后形成的早期皮肤瘢痕的皮下组织处,间隔10天1次、共3次。实验结果见,人ADSCs治疗,可使皮肤瘢痕变小、柔软、颜色接近瘢痕周围的正常皮肤;疤痕组织肥大细胞减少、胶原蛋白排列更成熟;早期的TGF-β3、MMP1表达增高,晚期α-SMA和MMP1组织抑制剂表达减低。可见,人ADSCs局部治疗,通过减少肥大细胞的活性、抑制纤维化形成,积极刺激了疤痕的重建,从而发挥对皮肤瘢痕的治疗作用。
3.人骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)条件培养基通过旁分泌的方式发挥抗瘢痕的作用:Fang 等[12]以BMSCs条件培养基,分别处理培养正常皮肤成纤维细胞(normal skin fi broblasts,NFs)、增生性瘢痕成纤维细胞(hypertrophic scar fi broblasts,HSFs)、萎缩性瘢痕成纤维细胞(matured scar fi broblasts,MSFs)、和瘢痕疙瘩成纤维细胞(keloid fi broblasts,KFs),发现,人BMSCs条件培养基抑制HSFs和KFs增殖、迁移,抑制细胞外基质、羟脯氨酸合成,抑制促纤维化表型相关基因和蛋白、Ⅱ型胶原和纤连蛋白的表达;但不影响HSFs和KFs的凋亡;并且促进HSFs和KFs抗纤维化表型相关基因和蛋白表达。表明,BMSCs可能通过旁分泌的方式发挥抗瘢痕作用[12]。
4.人BMSCs条件培养基对人增生性瘢痕成纤维细胞具有显著抑制作用:武艳等[13]用人BMSCs条件培养基,处理培养6例住院患者手术切除的增生性瘢痕组织的成纤维细胞,研究发现,BMSCs条件培养液对增生性瘢痕成纤维细胞TGF-β的分泌、胶原的合成有显著抑制作用,并明显增强TGF-β/Smad信号通路中关键抑制性蛋白Smad7基因的表达,表明BMSCs条件培养液对增生性瘢痕成纤维细胞具有显著抑制作用。
5.人真皮间充质干细胞(human dermis derived mesenchymal stem cells,hDMSCs)抑制增生性瘢痕成纤维细胞活性:张文夺等[14]利用hDMSCs与人瘢痕形成6个月、1年、2年的增生性瘢痕成纤维细胞非接触式共培养的方法,研究了hDMSCs对HSFs的α-SMA和细胞外基质组成成分核心蛋白多糖(decorin,DCN)表达的影响。研究发现,hDMSCs通过下调HSFs的α-SMA mRNA和蛋白,及上调DCN mRNA和蛋白的表达,发挥抗瘢痕形成作用,特别对早期HSFs的作用明显。
二、干细胞治疗皮肤瘢痕的临床研究
1.羊膜干细胞移植治疗皮肤瘢痕:2014年,Hemphill等[15]首次报道了羊膜干细胞治疗胸部瘢痕的临床尝试。一例73岁白人男性患者,因多次心室辅助装置植入,出现手术切口处瘢痕,疤痕组织周围严重的疼痛,导致睡眠困难和生活质量下降。在进行多次手术之前,患者每天行走4英里,由于疤痕疼痛和相关的呼吸困难,行走减少到每天1英里。传统的治疗方法未能缓解疼痛。200万个人羊膜干细胞和羊膜基质的混合物直接注入疤痕周围的上、下、内侧和外侧部分后,患者疼痛显著减轻,在6周内能够坚持每天锻炼。30 d后,再次给予羊膜干细胞治疗,患者完全消除了疼痛,锻炼水平提高到基线水平。可见,干细胞促进了疤痕的重塑(图1),并完全缓解了患者的疼痛。作者认为,羊膜干细胞可作为治疗瘢痕的一种新颖有效的治疗方法。
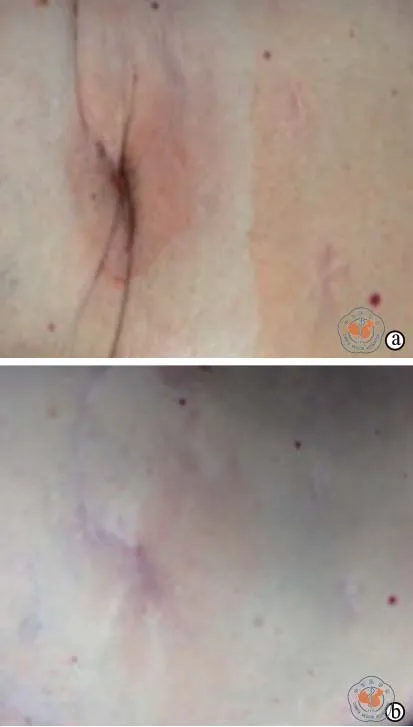
图1 胸廓瘢痕羊膜细胞治疗前后对比
2.自体BMSCs移植治疗痤疮瘢痕:Ibrahim等[16]利用自体BMSCs治疗痤疮萎缩性瘢痕的初步研究。14例中度至重度萎缩疤痕的患者,在骨髓抽吸前给予5 μg/(kg·d)粒细胞集落刺激因子(G-CSF)皮下注射,连续2 d。所有患者均接受一次性的自体BMSCs治疗,干细胞溶液注射到每一个瘢痕皮内。在治疗前、后,患者接受卡迪夫痤疮残疾指数(CADI)的评估。结果见,在自体BMSCs治疗6个月后,定性评分、定量评分和CADI评分,所有类型的疤痕都有显著的改善,且任何患者中都没有出现显著的副作用,从而认为,自体BMSCs是一种安全有效的治疗方法,可用于治疗各种类型的萎缩性面部痤疮疤痕。
3.自体脂肪干细胞源性脂肪细胞移植治疗皮肤疤痕:Kim等[17]进行了自体ADSCs源性脂肪细胞治疗凹陷性皮肤瘢痕的效果及安全性研究。年龄大于19岁、凹陷性疤痕少于5 ml的36例患者参加了研究,其中34例接受了腹部抽脂手术,31例接受了ADIPOCELL治疗。在接受ADIPOCELL治疗的病例中,凹陷性疤痕分布在前额(n=8)、脸颊(n= 9)、眉间(n= 4)、太阳穴(n= 3)、下巴(n= 2)、和其他部位(n= 5),细胞以1×108个/ml浓度,按凹陷性疤痕体积3/8剂量,注射在疤痕真皮下。在注射后的12周时痊愈率为74.6%,随访1年,效果可以维持,且没有严重的不良事件发生(图2)。作者认为,自体ADIPOCELL是一种安全、有效、可长期维持的治疗凹陷性疤痕的方法。
4.ADSCs条件培养基联合二氧化碳激光治疗面部萎缩性痤疮疤痕:Zhou等[18]观测了ADSCs条件培养基(ADSCCM)联合二氧化碳激光治疗面部萎缩性痤疮疤痕的效果及副作用。13名受试者在接受了3次二氧化碳激光治疗后,给予ADSC-CM进行治疗,治疗后1周、1个月时进行评估。结果见,一次治疗后,增加了对皮肤的满意程度、弹性、皮肤含水量和皮肤弹性,减少了皮肤水分丧失、痘痕、粗糙程度和黑色素指数,组织学分析显示,增加皮肤胶原密度,弹性蛋白密度,并按顺序排列,从而认为,ADSC-CM联合二氧化碳激光是一种治疗萎缩性痤疮疤痕的良好组合疗法。
5.脂肪移植治疗皮肤疤痕:脂肪移植是近年来开展的一项治疗皮肤瘢痕的新方法,一般认为是脂肪中存在的干细胞发挥的效应[19]。
2008年,Klinger等[19]初步观察了脂肪组织移植对肥厚性疤痕的治疗效果。选择3例在2 ~ 13年前因严重烧伤而产生面部肥厚性疤痕的成年患者,利用腹部皮下提取的脂肪组织,移植注射到面部肥厚性疤痕皮下,治疗6个月后临床表现和患者主观感觉表明,自体脂肪组织治疗后,皮肤纹理、柔软度、厚度和弹性等方面都有明显的改善,组织学检查显示,新组织的胶原沉积、局部血管增生和真皮增生的模式,与原组织有很高的一致性。认为,脂肪组织移植对肥厚性疤痕重建、减小的新观点。
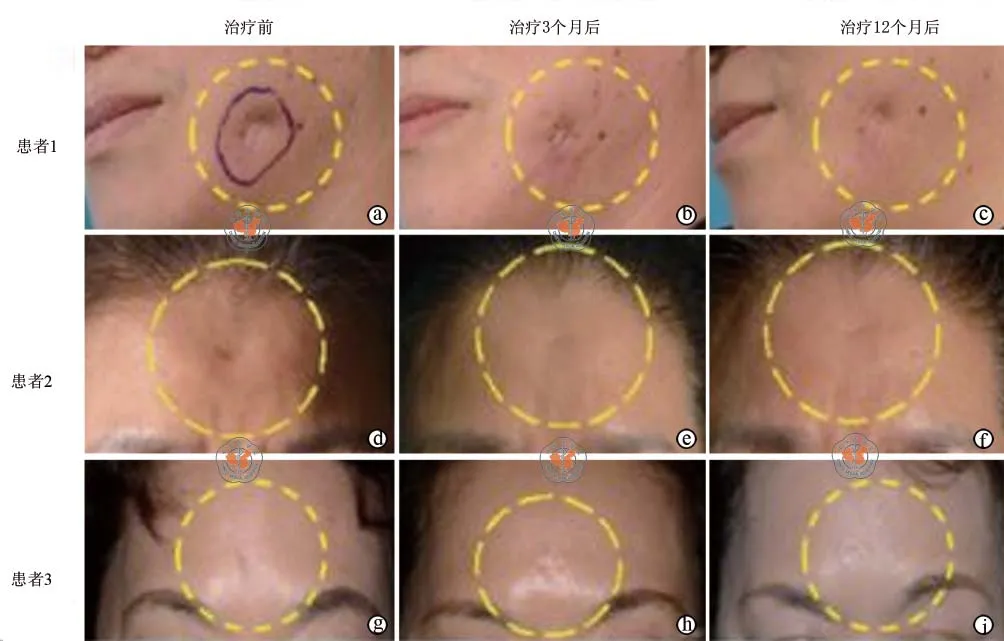
图2 接受自体ADIPOCELL治疗的3例患者
2013年,Klinger等[20]总结了6年时间内,脂肪组织移植治疗16 ~ 62岁,平均38.3岁的694例患者皮肤瘢痕的结果。这些患者,均有反复的疤痕疼痛和涉及关节正常日常活动的限制,包括376名烧伤、54名道路创伤,92名家庭事故及172名手术原因导致的疤痕,他们利用腹部和(或)转子区域抽取的脂肪组织进行了移植治疗,患者和观察者疤痕评估量表(POSAS,医生对瘢痕血管分布、色素沉着、厚度、凹凸程度、柔软度、表面范围和总体评价进行评分,患者对疼痛、瘙痒、颜色、硬度、厚度、形状和总体评价精心评估、并用硬度计进行测量),发现,在所有治疗的疤痕中均减少或完全消除了疼痛、增加了疤痕弹性、硬度指标明显下降、治疗的区域恢复了与正常皮肤相似的特征,从美学和功能的角度来看,都有质的改善。
Pallua等[21]报道了26例患者的35处面部疤痕接受自体脂肪填充治疗的效果。POSAS、照片记录、激光多普勒光谱(O2C)测量见,自体脂肪填充治疗后,所有疤痕的疼痛、颜色、硬度、不规则性、色素沉着和柔软度都得到了改善;在最后的随访检查中,患者的满意率达到了很高的水平。证明,自体脂肪填充是治疗面部疤痕的一项有价值的技术。鉴于脂肪组织移植对皮肤瘢痕的良好治疗效果及安全性,近年来临床进行了广泛的应用,均取得了较为满意的结果,其脂肪组织中干细胞的作用得到充分肯定[22-24]。
Azzam等[25]比较了二氧化碳激光和脂肪移植治疗痤疮疤痕的效果,这项研究中包括20例患者,10例接受了3次二氧化碳激光治疗,10例接受了脂肪移植。所有患者随访3个月,结果由3名医生组成的委员会进行评估,结果见,脂肪移植比二氧化碳激光治疗更有效。
三、干细胞治疗皮肤瘢痕的展望
干细胞是近年来生命科学领域的前沿和研究热点,对多种疾病,特别是对目前临床尚无较好治疗措施疾患的治疗,进行了大量研究。皮肤瘢痕亦是临床顽疾之一,特别在人们追求美观的今天,积极探索干细胞治疗皮肤瘢痕的方法,具有重要的临床和社会意义。可喜的是已报道的临床多种干细胞治疗皮肤疤痕,均取得了较为肯定的治疗效果,这为临床皮肤瘢痕的治疗提供了一种新的治疗方法。但是,从整体水平观察,还处于初步探索阶段,实验研究较为粗浅。
干细胞治疗皮肤瘢痕的研究目前尚存在如下问题:(1)已报道的实验和临床研究,探讨了多种干细胞,干细胞选取有较大随意性;仅观测了使用干细胞的治疗效果,没有和其他干细胞的治疗效果相比较;(2)对干细胞治疗皮肤瘢痕的治疗机制缺乏深入探讨,特别应搞清楚干细胞是对疤痕进展期起作用,还是对稳定期的瘢痕起作用;(3)目前的临床研究,多属初步观测,尚缺乏多中心系统的规范研究。
对干细胞治疗皮肤瘢痕研究,应积极开展不同种类干细胞对不同种类皮肤瘢痕类型的治疗效果比较研究,以确定最理想的干细胞种类;积极进行干细胞治疗皮肤瘢痕机制的研究,搞清楚干细胞对皮肤疤痕什么期具有治疗效果,以确定干细胞治疗皮肤瘢痕的适应证;积极进行干细胞体内演变过程的研究,搞清干细胞在瘢痕微环境下的演变规律;应积极开展干细胞治疗皮肤瘢痕的多中心系统规范研究,搞清适应症、给药途径、干细胞浓度、剂量、安全性等问题,以及干细胞治疗皮肤瘢痕的客观效果。
目前已报道的干细胞治疗皮肤瘢痕的基础、实验研究结果,初步证明了干细胞治疗各种皮肤瘢痕的有效性,值得进行临床广泛的开展和深入研究。
1 Utsunomiya T, Shimada M, Imura S, et al. Human Adipose-Derived stem cells: potential clinical applications in surgery[J]. Surg Today,2011, 41(1):18-23.
2 Akita S, Yoshimoto H, Akino K, et al. Early experiences with stem cells in treating chronic wounds[J]. Clin Plast Surg, 2012, 39(3):281-292.
3 Zhang J, Li Y, Bai X, et al. Recent advances in hypertrophic scar[J].Histol Histopathol, 2017:11908.
4 Li Q, Zhang C, Fu X. Will stem cells bring hope to pathological skin scar treatment?[J]. Cytotherapy, 2016, 18(8):943-956.
5 江兰, 刘世宇, 李海建, 等. 人羊膜上皮干细胞对皮肤增生性瘢痕形成的作用[J]. 中国皮肤性病学杂志, 2011, 25(10):747-750, 782.
6 邱林, 金先庆, Paul A Kingston, 等. 基因修饰bmscs抑制增生性瘢痕的实验研究[J].中国修复重建外科杂志, 2008, 22(2):212-216.
7 武艳, 杨岚, 陈志会, 等. 骨髓间充质干细胞抑制皮肤瘢痕形成的机制研究[J]. 医学研究杂志, 2016, 45(5):81-85.
8 陈璐, 王达利, 魏在荣, 等. 自体脂肪源性间充质干细胞局部移植对兔耳增生性瘢痕形成的影响[J]. 中华烧伤杂志, 2016, 32(10):582-587.
9 张琪, 刘李娜, 邓景成, 等. 瘢痕内注射脂肪来源干细胞对兔耳增生性瘢痕的抑制作用研究[J]. 组织工程与重建外科杂志, 2015,11(3):139-143.
10 卞媛媛, 梁久龙, 韩悦, 等. 兔自体脂肪来源干细胞对增生性瘢痕的作用研究[J]. 实用皮肤病学杂志, 2013, 6(1):3-6.
11 Yun IS, Jeon YR, Lee WJ, et al. Effect of human adipose derived stem cells on scar formation and remodeling in a pig model: a pilot study[J].Dermatol Surg, 2012, 38(10):1678-1688.
12 Fang F, Huang RL, Zheng Y, et al. Bone marrow derived mesenchymal stem cells inhibit the proliferative and profibrotic phenotype of hypertrophic scar fi broblasts and keloid fi broblasts through paracrine signaling[J]. J Dermatol Sci, 2016, 83(2):95-105.
13 武艳, 袁晓环, 杨岚, 等. 间充质干细胞条件培养液对正常成纤维细胞及瘢痕成纤维细胞转化生长因子β产生和信号通路的影响[J]. 中国组织工程研究, 2016, 20(29):4349-4354.
14 张文夺, 邓呈亮, 郭常敏, 等. 人真皮间充质干细胞对增生性瘢痕成纤维细胞α-SMA和DCN表达的影响[J]. 中华整形外科杂志, 2016,32(4):285-292.
15 Hemphill C, Stavoe K, Khalpey Z. First in man: amniotic stem cell injection Promotes scar remodeling and healing processes in late-stage fi brosis[J]. Int J Cardiol, 2014, 174(2):442-443.
16 Ibrahim ZA, Eltatawy RA, Ghaly NR, et al. Autologus bone marrow stem cells in atrophic acne scars:A pilot study[J]. J Dermatolog Treat,2015, 26(3):260-265.
17 Kim M, Kim I, Lee SK, et al. Clinical trial of autologous differentiated adipocytes from stem cells derived from human adipose tissue[J].Dermatol Surg, 2011, 37(6):750-759.
18 Zhou BR, Zhang T, Bin Jameel AA, et al. The effi cacy of conditioned media of adipose-derived stem cells combined with ablative Carbon dioxide fractional resurfacing for atrophic acne scars and skin rejuvenation[J]. J Cosmet Laser Ther, 2016, 18(3):138-148.
19 Klinger M, Marazzi M, Vigo D, et al. Fat injection for cases of severe burn outcomes: A new perspective of scar remodeling and reduction[J].Aesthetic Plast Surg, 2008, 32(3):465-469.
20 Klinger M, Caviggioli F, Klinger FM, et al. Autologous fat graft in scar treatment[J]. J Craniofac Surg, 2013, 24(5):1610-1615.
21 Pallua N, Baroncini A, Alharbi Z, et al. Improvement of facial scar appearance and microcirculation by autologous lipofilling[J]. J Plast Reconstr Aesthet Surg, 2014, 67(8):1033-1037.
22 Ciancio F, Parisi D, Innocenti A, et al. Effectiveness of autologous fat grafting in adherent scars: results obtained by a comprehensive scar evaluation protocol[J].Plast Reconstr Surg, 2017,140(2):355e-356e.
23 Jaspers MEH, Middelkoop E, van Zuijlen PPM. Reply:effectiveness of autologous fat grafting in adherent scars: results obtained by a comprehensive scar evaluation protocol[J]. Plast Reconstr Surg, 2017,139(5):1217e-1218e.
24 Negenborn VL, Groen JW, Smit JM, et al. Reply:the use of autologous fat grafting for treatment of scar tissue and scar-related conditions:a systematic review[J]. Plast Reconstr Surg, 2016, 138(3):552e-553e.
25 Azzam OA, Atta AT, Sobhi RM, et al. Fractional CO(2)laser treatment vs autologous fat transfer in the treatment of acne scars:a comparative study[J]. J Drugs Dermatol, 2013, 12(1):e7-e13.

