TGF-β、GFAP及免疫细胞的表达对恶性胶质瘤术后同期推量调强放疗患者生存情况的影响
苏优勒
胶质瘤是颅内肿瘤中最常见也是最严重的恶性病变,约占颅内占位性病变40%~ 60%,预后非常差,生存时间仅1年左右[1]。恶性胶质瘤(maligantglioma,MG)细胞以浸润性生长为主,对正常脑组织侵袭性强容易转移,手术难以彻底清除,术后复发率高[2]。同期推量调强放疗[3](simultaneous intensity modulated radiotherapy,SIB-IMRT)是随着计算机技术发展而应用在放射治疗中一种先进的放疗技术,在每次照射剂量上存在一定差别,在病变组织和周围造成组织中形成梯度,治疗中使靶区剂量提升并能有效保护周围正常组织,改善患者预后降低恶性胶质瘤局部复发[4]。转化生长因子β(transforming growth factor-β,TGF-β),是对人体免疫细胞主要起抑制作用的多功能生长因子,在恶性胶质瘤患者脑组织中高度异常表达[5]。血清胶质纤维酸性蛋白(glial fi brillary acidic pretein,GFAP)是胶质瘤诊断中重要的肿瘤标志物,是胶质瘤的标志蛋白[6]。免疫细胞通过分泌包括IL6、IL8、IL10和TNF-α在内的一系列细胞因子,通过不同的方式参与对肿瘤细胞的杀伤[7]。本研究具体报道如下。
材料与方法
一、一般资料
选取2015年2月至2017年2月在内蒙古医科大学附属医院神经外科诊治的Ⅲ级脑胶质瘤80例患者术后SIB-IMRT进行研究,其中男43例,女37例,年龄24 ~ 67岁,平均年龄(45±6)岁。所有患者在手术后均采取同期推量强调放疗的治疗方案治疗。本研究已通过医院伦理委员会审核,与患者签订知情同意书。
纳入标准:(1)一般资料完整;(2)术后病理确诊为Ⅲ级胶质瘤;(3)无重要脏器功能失代偿;(4)无放疗禁忌症,卡式生活质量评分(KPS)60分以上。排除标准:(1)存在严重手术并发症;(2)治疗期终止前死亡。肿瘤位于颞叶29例,额叶23例,顶叶28例。根据肉眼下观察是否存留肿瘤组织的参考标准,80例患者中肿瘤完全切除40例,部分切除40例。
二、方法
1.诊断及分类标准:胶质瘤诊断及分级依照神级系统肿瘤WHO分类标准(2000年版)。
2.治疗方案:患者术后2周开始接受放疗。(1)定位:患者取仰卧位,用专业热塑型个性化面罩固定患者头部保持稳定。64排双源CT(德国西门子公司)从头顶向下至下颌下缘2.0 cm行增强扫描定位,扫描层厚3.0 mm,逐层扫描。(2)放疗计划:将CT增强扫描的影像资料导入计算机内调强治疗计划系统。根据国际辐射单位与测量委员会(ICRUM)第52号和69号报告中关于放射治疗靶区定义并参考患者手术前、手术CT等影像学资料,在CT增强扫描定位图像上根据患者颅内胶质瘤位置和大小,对肿瘤组织区域逐层勾画并重建肿瘤靶区[肿瘤体积(gross tumor volume,GTV)包括术前肿瘤病灶以及根据邻近组织向外扩大2.0 cm的边缘区域、临床靶区(clinical target volume,CTV)为肿瘤完全切除或部分切除后残余病灶],避开各个临近的重要器官组织如眼球、脊髓、视交叉、视神经等部位,做出最合理优化的调强方案。SIB-IMRT计划共照射25次,每周5次。CTV处方剂量50.0 Gy,每次分割剂量2.0 Gy;CTV处方剂量60.0 Gy,每次分割剂量2.4 Gy。(3)化疗计划:所有患者根据自身病情和经济条件进行化疗方案优化后,并接受规律化疗。50例患者接受同步放化疗方案,30例患者接受序贯放化疗方案。
3.随访:放疗期间随时观察患者病情变化。采用门诊复查和电话随访办法,放疗结束后第1年每季度随访1次,以后每6个月随访1次,随访3年为止。随访率100.00%。
三、观察指标
1.近期疗效:根据SIB-IMRT后1个月复查头颅增强CT颅内病灶变化分为完全缓解(CR)、部分缓解(PR)、稳定(NC)、病变进展(PD)。有效率=(CR+PR)/总例数×100.00%
2.远期疗效:根据随访结果统计患者放疗结束后6个月、1年、2年、3年生存率。
3.TGF-β、GFAP及免疫细胞的表达:酶联免疫吸附法(ELISA)检测患者术前、术后、SIB-IMRT后的血清TGF-β、GFAP、IL6、IL8、IL10和TNF-α含量的变化。
四、统计学分析方法
采用SPSS16.0软件进行数据统计,两组TGF-β、GFAP、IL6、IL8、IL10和TNF-α含量采用±s表示,组间比较采用独立t检验,各时间段比较采用方差分析;近期疗效和远期疗效采用卡方检验和秩和检验(Wilcoxon两样本比较法)进行比较。以P< 0.05为差异具有统计学意义。
结 果
一、肿瘤完全切除和部分切除患者近期疗效比较分析
患者近期疗效总有效率为77.50%,完全切除(85.00%)和部分切除(70.00%)差异无统计学意义(P> 0.05)。恶性胶质瘤完全切除完全缓解(62.50%)高于部分切除(40.00%)(P< 0.05),完全切除肿瘤病变进展要低于部分切除(P< 0.05),部分缓解、病情稳定比较差异无统计学意义(P>0.05)。切除越彻底近期疗效越好(u= 2.1993,P=0.0279,表1)。
二、肿瘤完全切除和部分切除患者远期疗效比较
随访达到6个月、1年、2年、3年的患者分别为78、61、38、19例,生存率为97.50%、76.25%、48.75%、22.50%。肿瘤完全切除和部分切除的患者随着时间的延长生存率逐渐降低,完全切除患者在2年、3年的生存率高于部分切除患者(P< 0.05),而6个月、1年的生存率比较差异无统计学意义(P> 0.05)。患者肿瘤切除程度越高SIB-IMRT后远期生存率越高(u= 1.6247,P= 0.1042,表2)。
三、患者术前、术后、SIB-IMRT后患者血清TGF-β、GFAP含量比较分析
肿瘤完全切除患者术前血清TGF-β、GFAP含量与部分切除患者对比差异无统计学意义(P>0.05),术后及SIB-IMRT后均明显低于部分切除的患者(P< 0.05)。患者在术后和SIB-IMRT后患者血清TGF-β、GFAP含量均较术前明显降低(P<0.05),且SIB-IMRT后血清TGF-β、GFAP较术前也有明显降低(P< 0.05,表3)。

表1 完全切除和部分切除的近期疗效比较[例(%)]

表2 完全切除和部分切除的远期疗效比较[例(%)]
表3 术前、术后、同期推量调强放疗后患者血清TGF-β、GFAP含量比较(ng/L,±s)

表3 术前、术后、同期推量调强放疗后患者血清TGF-β、GFAP含量比较(ng/L,±s)
TGF-β分组GFAP术前术后同期推量调强放疗后F值P值术前术后同期推量调强放疗后F值P值完全切除50.91±11.7320.78±12.3013.55±9.667.53420.031982.49±80.1245.04±73.605.12±33.438.35460.0117部分切除51.47±10.8833.16±13.0821.92±8.796.31350.045283.59±81.3557.61±82.3321.05±35.698.03150.0236 t 值0.2214 4.3608 4.05310.03600.71992.0603 P值0.8254< 0.0001< 0.00010.97140.47420.0427
表4 术前、术后、同期推量调强放疗后患者血清IL6、IL-8含量比较(ng/L,±s)

表4 术前、术后、同期推量调强放疗后患者血清IL6、IL-8含量比较(ng/L,±s)
IL-8术前术后同期推量调强放疗后F值P值术前术后同期推量调强放疗后F值P值完全切除14.19±4.7812.36±5.18 9.44±3.1010.42020.015555.51±4.9042.77±5.2822.30±3.659.32140.0174部分切除14.37±4.6214.05±4.5112.11±3.429.95320.015253.59±5.1044.51±4.9730.53±4.605.91280.0356 t 值0.1412 5.3573 6.05640.10672.3492 6.0490 P值0.6515< 0.0001< 0.00010.57120.2745< 0.0001 IL-6分组
表5 术前、术后、同期推量调强放疗后患者血清IL10和TNF-α含量比较(ng/L,±s)
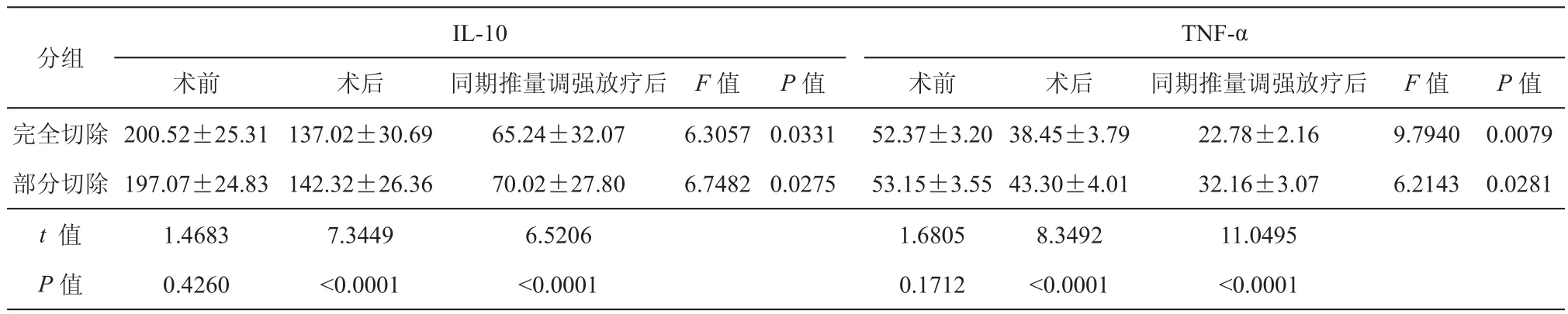
表5 术前、术后、同期推量调强放疗后患者血清IL10和TNF-α含量比较(ng/L,±s)
TNF-α术前术后同期推量调强放疗后F值P值术前术后同期推量调强放疗后F值P值完全切除200.52±25.31137.02±30.6965.24±32.076.30570.033152.37±3.2038.45±3.7922.78±2.169.79400.0079部分切除197.07±24.83142.32±26.3670.02±27.806.74820.027553.15±3.5543.30±4.0132.16±3.076.21430.0281 t 值1.46837.34496.52061.68058.349211.0495 P值0.4260<0.0001<0.00010.1712<0.0001<0.0001 IL-10分组
四、患者术前、术后、SIB-IMRT后患者免疫细胞表达比较分析
肿瘤完全切除和部分切除患者术前血清IL6、IL8、IL10和TNF-α含量对比差异无统计学意义(P>0.05),术后及SIB-IMRT后相比于术前均有降低(P< 0.05),SIB-IMRT后低于术后水平(P< 0.05)。患者SIB-IMRT后血清IL6、IL8、IL10和TNF-α含量与术前、术后对比差异具有统计学意义(P< 0.05),肿瘤切除越彻底越明显(表4、5)。
讨 论
胶质瘤是发源于神经外胚层细胞最常见的颅内肿瘤,发病率较高,复发率高、预后差。临床上将Ⅲ~Ⅳ级胶质瘤定义为恶性胶质瘤,其中位生存期小于18个月,2年存活率低至5%[8]。由于恶性胶质瘤浸润性生长的生物学特性,导致肿瘤病灶和正常脑组织之间的界限在肉眼下难以分清,手术治疗难度极大,难以完整切除,术后复发率高且常于原发灶2.0 cm内复发[9]。因此,临床采取手术后优化局部放化疗方案作为主要治疗手段。SIB-IMRT在放射治疗靶区内按处方剂量分布照射剂量,对杀灭恶性胶质瘤术后残余肿瘤组织效果好,能最大程度地保护周围正常脑组织和临近器官,既往学者报道了此放疗方法在临床有良好的应用效果[10]。
胶质瘤由于病理组织取材困难,在判断预后方面检测血清内的相关标志物具有很高的临床应用价值[11]。恶性胶质瘤患者肿瘤细胞分泌TGF-β对免疫细胞进行抑制,有研究显示TGF-β在恶性胶质瘤患者中高度异常表达[12],TGF-β的表达与胶质瘤恶性程度正相关而与患者远期生存率成负相关[13],这一观点还未得到完全确认。GFAP是可以用于确定胶质瘤起源的标志蛋白,相对分子量50 000 ~ 52 000[14]。GFAP在恶性胶质瘤过度表达,虽然GFAP的表达和恶性胶质瘤之间的关系还没有确切的阐述,但是两者之间的相关性已经得到临床的共识[15],是胶质瘤患者诊断和预后判断中一项非常重要的指标。GFAP表达水平越低患者预后越好,远期存活率越高[16]。本研究设计采用两种放化疗方案对于TGF-β水平的影响差异无统计学意义,结果显示患者血清TGF-β和GFAP含量在SIB-IMRT后降低,病灶切除越彻底下降越明显,近期疗效和远期预后都明显好转。
免疫细胞通过表达细胞因子发挥肿瘤免疫作用[17]。肿瘤的发生发展和细胞因子之间的密切关系在既往许多研究中得以证实[18-19]。IL-6会促进肿瘤细胞增殖、迁移和促进肿瘤组织生成心血管;IL-8通过募集和激活吞噬细胞抵御肿瘤细胞的侵袭;IL-10是一类免疫抑制因子,胶质瘤分泌IL-10可抑制机体对肿瘤细胞的杀伤;TNF-α是机体主要的抗肿瘤因子,表达越低肿瘤恶性程度越高。本研究中患者在SIB-IMRT后血清IL6、IL8、IL10和TNF-α含量都有明显降低,肿瘤切除越彻底下降越明显。一方面肿瘤组织通过手术和SIB-IMRT有效的清除,分泌利于肿瘤细胞生长的细胞因子下降;另一方面同样由于肿瘤细胞的凋亡清除,机体对肿瘤的免疫杀伤降低,基本符合既往研究结果[20]。
综上所述,恶性胶质瘤术后SIB-IMRT患者血清TGF-β、GFAP表达水平越低,患者治疗疗效和生存率越好,IL6、IL8、IL10和TNF-α在治疗后表达水平降低也表明免疫细胞表达的降低有助于患者预后。血清TGF-β、GFAP和免疫细胞表达水平可有效判断恶性胶质瘤患者术后SIB-IMRT后的疗效和预后,具有较高的临床价值。
1 曹志成. 颅内肿瘤综合治疗及其分子治疗研究进展[J]. 南方医科大学学报, 2007, 27(7):1047-1051.
2 Truc G, Bernier V, Mirjolet C, et al. A phase I dose escalation study using simultaneous integrated-boost IMRT with temozolomide in patients with unifocal glioblastoma[J]. Cancer Radiother, 2016,20(3):193-198.
3 薛强. 恶性胶质瘤术后同期推量调强放疗的疗效及其预后影响因素分析[J]. 东南大学学报(医学版), 2016, 35(5):746-751.
4 苏琼菲, 王希成. 顶枕叶胶质瘤非共面三维适形放疗与调强放疗的剂量学对比研究[J]. 中华肿瘤防治杂志, 2015, 22(8):614-617.
5 冯九庚, 封荣华, 洪涛, 等. TGF-β1及Ⅰ型受体ALK1在人脑胶质瘤细胞的表达及意义[J]. 重庆医学, 2014 (24):3139-3142.
6 张正保, 覃川, 晏怡, 等. 血清胰岛素生长因子-1和胶质纤维酸性蛋白在脑胶质瘤分级及预后评估中的临床价值[J]. 华西医学, 2013(01):19-21.
7 单铁英, 潘秀兰, 董静, 等. 枸杞多糖对实验性脑胶质瘤大鼠免疫功能的影响[J]. 广东医学, 2015, 36(23):3601-3603.
8 王琳, 王馨. 靶向时代肿瘤疗效评价标准的探索[J]. 中国肿瘤临床,2015 (6):366-370.
9 Ratajczyk E, Ledzewicz U, Leszczynski M, et al. The role of TNF-α inhibitor in glioma virotherapy:A mathematical model[J]. Math Biosci Eng, 2017, 14(1):305-319.
10 刘艳梅, 倪玲琴, 王赛赛. 全脑调强放疗同期推量治疗脑转移瘤的疗效观察[J]. 中国辐射卫生, 2012, 21(4):488-489.
11 殷长江, 董保忠, 杜晓光, 等. 脑胶质瘤患者围术期脑脊液中HGF、TNF-α、IL-17水平变化及意义[J]. 山东医药, 2016, 56(9):51-52.
12 Yang X, Lv S, Zhou X, et al. Retraction Note to:the clinical implications of transforming growth factor beta in pathological grade and prognosis of glioma patients:a Meta-Analysis[J]. Mol Neurobiol,2017, 54(3):2378.
13 Jiang L, Zhou J, Zhong D, et al. Overexpression of SMC4 activates TGFβ/Smad signaling and promotes aggressive phenotype in gliomacells[J]. Oncogenesis, 2017, 6(3):e301.
14 Su X, Liu XJ, Ni LC, et al. GFAP expression is regulated by Pax3 in brain glioma stem cells[J]. Oncol Rep, 2016, 36(3):1277-1284.
15 覃川, 杨秀江, 晏怡, 等. 脑胶质瘤患者血清胶质纤维酸性蛋白浓度及临床价值[J]. 第三军医大学学报, 2012, 34(21):2214-2215.
16 Guichet PO, Guelfi S, Ripoll CA, et al. Asymmetric distribution of GFAP in glioma multipotent cells[J]. PLoS One, 2016, 11(3):e0151274.
17 Bouffet E, Larouche V, Campbell BB, et al. Immune checkpoint inhibition for hypermutant glioblastoma multiforme resulting from germline biallelic mismatch repair defi ciency[J]. J Clin Oncol, 2016,34(19):2206-2211.
18 Fu JW, Wang KW, Qi ST. Role of IL-8 gene polymorphisms in glioma development in a Chinese population[J]. Genet Mol Res, 2016, 15(3).
19 张午临, 刘晖, 贾涛, 等. 胸腔镜小切口手术对非小细胞肺癌患者CRP、TNF-α及IL-6等指标水平的影响[J]. 实用癌症杂志, 2014(10):1294-1297.
20 刘雅琦, 顾金海, 孟锐, 等. 重组人白细胞介素-6对胶质瘤细胞U87增生侵袭的影响[J]. 中国老年学杂志, 2015 (10):2617-2619.

