诱导多能干细胞向角膜上皮细胞分化的研究进展
熊蓉 冯刚 李战梅,2
角膜疾病是我国主要致盲眼病之一,也是眼球摘除的第一致病因素。据国家卫计委数据显示,我国有200多万的眼角膜盲症患者。角膜是非角质化的多层透明无血管组织,由上皮细胞层、前弹力层、基质层、后弹力层和内皮细胞层组成,位于眼球最外层,极易受到化学、物理和生物等因素的伤害。角膜的表面即上皮细胞层由一种独特的非角化上皮细胞构成,称为角膜上皮细胞(cornea epithelial cells,CECs)。角膜缘深部的角膜缘干细胞(limbal stem cells,LSCs)不断分化,并且迁移至角膜中央维持着CECs的数量稳定,从而维持着角膜的正常视觉功能。急性创伤、慢性疾病甚至佩戴接触镜[1]等都容易导致LSCs缺乏,产生角膜缘干细胞缺乏症(limbal stem cell defi ciency,LSCD)。LSCs缺乏会使CECs更新和修复功能受阻,角膜上皮反复缺损、糜烂、溃疡;角膜结膜化;新生血管长入及假性胬肉形成等,最终造成视力损害。LSCD是导致眼盲病的第二大因素[2-3]。
目前,LSCD的治疗方式有自体或异体角膜缘移植、体外培养的LSCs移植、体外培养的口腔黏膜细胞移植、自体或异体结膜移植等[3]。总的来说,虽然这些治疗具有一定疗效,但是慢性炎症和免疫排斥反应常常影响手术的成功率。并且对于双侧LSCs缺失的患者来说,不能自体组织或细胞移植,若进行体外培养的口腔黏膜细胞移植,移植体又存在新生血管的风险[4]。利用多能干细胞诱导分化为CECs,再进行移植来治疗双眼LSCD患者以规避免疫排斥反应和新生血管生成的治疗方案得到大家认可。目前已有大量研究探索了将多能干细胞诱导为CECs的方法及其相关的信号通路和关健信号分子,为重建眼表提供了新的种子细胞和临床治疗提供了新方向。
一 、多能干细胞
多能干细胞,具有分化出多种细胞组织的潜能,包括胚胎干细胞(embryonic stem cell,ESCs)和诱导性多能干细胞(induced pluripotent stem cells,iPSCs),是目前细胞领域研究的热点。ESCs是从早期胚胎(原肠胚期之前)内细胞团中分离出来的一类细胞,它具有体外培养无限增殖、自我更新和多向分化的特性。研究表明,ESCs可诱导分化为机体大部分细胞类型[5],包括角膜上皮样细胞。虽然ESCs具有强大的分化潜能,是一种良好的种子细胞,但ESCs的获得存在伦理学争议,而且由ESCs分化得到的CECs在临床应用中还会存在免疫排斥的风险,伦理学及免疫排斥问题,限制了其进一步的临床应用。
2006年,Yamanaka等[6]将反转录病毒介导的Oct-3/4、Sox2、Klf4及c-Myc四个基因转入小鼠成纤维母细胞,将成体细胞重编程为具有多向分化潜能的干细胞,并将该类干细胞命名为iPSCs。iPSCs的成功突破为组织再生提供了一种新的多能干细胞,它具有与ESCs同样的多能性。iPSCs细胞在体内可分化为3个胚层来源的所有细胞,进而参与形成机体所有组织和器官。在体外,iPSCs细胞可定向诱导分化出多种成熟细胞[7],包括CECs。将自身来源的iPSCs诱导为角膜上皮样细胞,既消除了免疫排斥的风险,也避免了社会伦理的问题,可为临床治疗和重建眼表提供来源充足的细胞。
二、iPSCs分化为CECs的方法
目前,将多能干细胞诱导分化为CECs主要是通过转染导入外源基因、小分子诱导或模拟CECs的微环境与其他细胞共培养等方法(表1),达到下调iPSCs或ESCs的干性基因表达量、激活CECs的标记基因表达的效果,从而将iPSCs或ESCs诱导分化为角膜上皮样细胞,角膜上皮样细胞的鉴定则通过检测分化细胞的角蛋白K3/12(keratin 3/12)、转录因子p63(tumourprotein63)等的表达情况来判断。
(一)转基因iPSCs分化为CECs
人类Pax6基因(Paired box 6,Pax6)是眼部发育过程中重要的转录因子,维持着CECs正常的表型,并且可以调节角膜细胞数量[8]。Ueno等[9]将Pax6基因转染入小鼠ESCs,可将ESCs诱导分化形成单层角膜上皮样细胞,检测结果显示,该细胞可表达角蛋白CK12、E-cadherin和CD44,进一步将诱导分化后的角膜上皮样细胞移植到小鼠的受损角膜模型上,结果表角膜上皮样细胞能够成活并向角膜损伤区迁移,恢复受损视力。近年研究揭示[10],WNT7A通过Pax6控制CECs分化,沉默WNT7A或Pax6都将导致LSCs向皮肤上皮样细胞分化,将Pax6基因转染入皮肤上皮干细胞重编程为LSCs样细胞,移植到兔受伤眼表,这些重编程细胞添补了CECs,修复了受伤眼表。但又有研究表明,小鼠Pax6过表达导致CECs形态学改变、新生血管、免疫细胞浸润和屏障破坏,指出Pax6的直接功能是维持CECs表型正常[11]。此外,Pax6基因在胚胎发育过程中也起着重要作用,Pax6基因突变有可能导致先天性无虹膜、视网膜母细胞瘤、黄斑发育不良、Peters异常等眼病。因此,Pax6不仅在早期眼部发育过程中起关键作用,也是LSCs分化的关键信号分子,其表达的正常与否对角膜发育和维持CECs的数量至关重要,调控Pax6或和其他信号分子的表达可能实现其他类型细胞转分化为角膜上皮样细胞,激活Pax6基因可能有助于治疗眼表上皮细胞的鳞状化病变[12]。
(二)模拟微环境iPSCs分化为CECs
干细胞的微环境维持着其未分化状态,微环境中各因素也共同决定着干细胞的分化方向。LSCs的微环境是由角膜基底膜和胞外基质组成,包含胶原、非胶原蛋白和蛋白多糖,还有多种自分泌和旁分泌细胞因子及其受体[13]。在胶原成分中,最重要的是Ⅳ型胶原,维持LSCs的正常分化、增殖和未分化状态。根据角膜缘微环境能够调控干细胞生理特性的原理,将小鼠iPSCs培养于Ⅳ型胶原包被的培养板中,通过Transwell共培养系统与分离的角膜缘成纤维细胞共培养,第12天出现大量圆形扁平上皮样细胞,并且RT-PCR结果显示CECs特异性标记物角蛋白K12和LSCs标记物Pax6均有所表达,干性标记基因Nanog表达降低,表明iPSCs经共培养定向诱导为角膜上皮样细胞是可行的[14]。
为了促进诱导的角膜上皮样细胞的临床应用,研究者们试想模拟LSCs的微环境,将来源于人的多能干细胞分化为角膜上皮样细胞。Ahmad等[15]将人ESCs与3T3细胞分别在Ⅳ型胶原、层粘连蛋白、纤维蛋白原共培养,6 d后发现大多数细胞变为扁平样,在分化过程中,RT-PCR结果显示K3/12、p63以及皮肤上皮细胞标志物CK10均有表达,表明实现了人ESCs向角膜上皮样细胞的分化。虽然终末分化结果显示不仅有角膜上皮样细胞还有皮肤上皮样细胞,但是此方法为探索早期角膜上皮发育过程中的变化提供了分化模型。Kawasaki等[16]通过基质细胞诱导方法(stromal cellderived inducing activity,SDIA),将人成纤维细胞和角膜缘上皮干细胞来源的iPSCs分别和小鼠骨髓来源的基质细胞PA-6细胞单层(MMC-treated PA6 feeder layer)共培养,首次实现人源iPSCs分化为CECs,表达角蛋白CK3/12,但培养时间为12 ~ 16周,周期太长,不适宜临床应用。
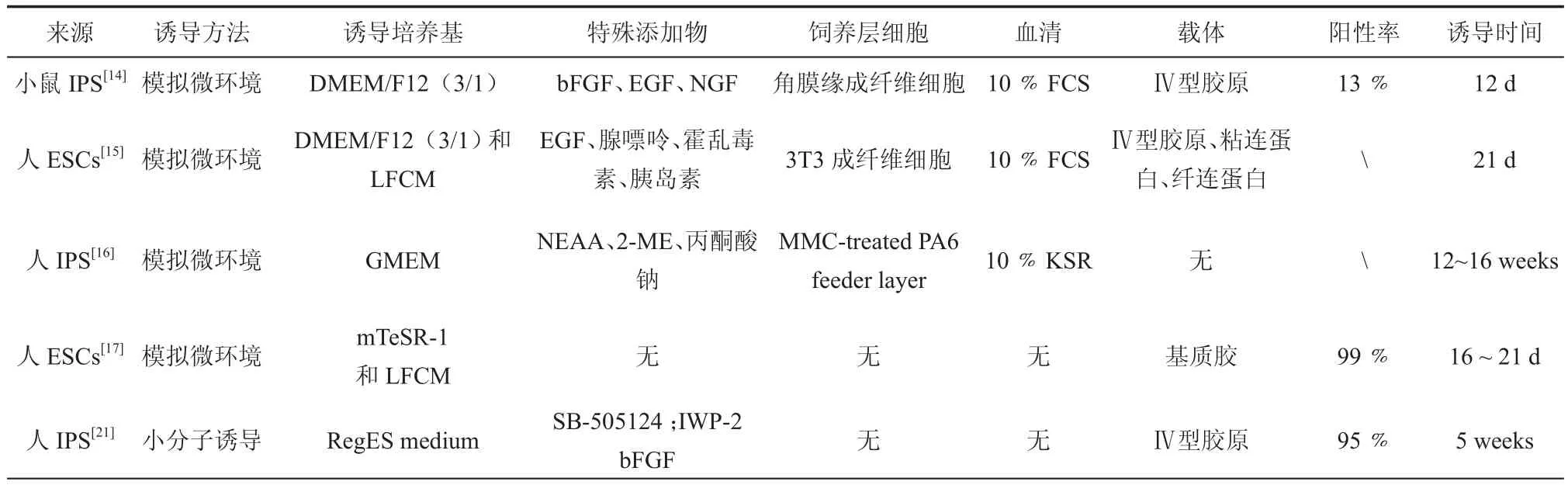
表1 诱导多能干细胞分化为角膜上皮样细胞典型方法的比较
此外,研究者不断探索通过改进细胞培养条件,尝试应用不加血清和饲养层细胞的条件培养基iPSCs定向分化,既能避免由于动物血清加入而带来的培养条件复杂性和不确定性,同时也能保证细胞的正常增殖和分化。研究者用人成纤维细胞条件培养基(LFCM)和无血清的生长培养基(mTeSR-1),将人ESCs诱导分化为CEC样细胞,21 d时就达到了99%CK3阳性率,该方法既无饲养层细胞又无血清,操作简便,为改进后续诱导方法提供了一种新思路[17]。也有研究者仅用角膜缘成纤维细胞条件培养基(limbal fi broblast conditioned medium,LFCM)培养人皮肤角质形成细胞,转分化为角膜上皮样细胞,这项研究为使用自体细胞重编程为角膜上皮样细胞治疗LSCD提供了新方法[18]。
(三)小分子iPSCs分化为CECs
外源性小分子化合物,因其调节作用单一和操作简单的优点,作为干细胞调节药物的潜力越发受到人们重视[19]。Arkell等[20]研究表明,在胚胎发育过程中,角膜上皮来源于头(眼)表面外胚层的分化,并且此过程的完成必须阻断TGF-β/节点和Wnt/β-catenin通路,Mikhailova等[21]使用小分子抑制剂(TGF-β抑制剂:SB-505124,Wnt抑制剂:IWP-2)和bFGF,阻断人iPSCs的TGF-β/节点和Wnt/β-catenin通路,并且激活FGF信号,将hiPSCs分化为CEC样细胞,诱导5周后有95%的p63阳性细胞,蛋白质组学分析结果表明,诱导的角膜上皮样细胞和CECs蛋白质表达水平极为相似,证实使用小分子将iPSCs诱导为CECs是可行的,该方法既没有添加血清也没有饲养层细胞,并且具有很高的重复性,具有很好的临床医用价值。
此外,还有一些生长因子也对角膜细胞的增殖和分化起重要作用。在早期胚胎发育过程中,成纤维细胞生长因子受体2(FGFR2)是CECs增殖和分化所必需的,且通过ERK单独信号通路维持Pax6表达水平[22]。胰岛素样生长因子(IGF)与LSCs的增殖、分化和迁移相关,并且IGF-2可诱导LSCs分化为K12阳性的细胞[23]。另外表皮生长因子(EGF)信号通路是刺激细胞增殖、迁移和促进CECs愈合的主要信号通路,并且表皮生长因子受体(EGFR)信号激活NF-κB通路,激活转录阻遏因子CTCF,下调Pax6表达,引起CECs增殖和迁移[24]。
利用小分子化合物诱导患者自身来源的iPSCs分化为角膜上皮样细胞,能减少外源基因和病毒的使用,并且以促进CECs增殖和迁移的细胞因子和蛋白建立可替代血清的营养物质,不添加血清和饲养层细胞,提高了安全性,必将成为iPSCs在角膜盲病治疗中未来研究的主要方向。
三、角膜上皮样细胞应用前景分析
综上所述,将多能干细胞诱导分化为角膜上皮样细胞,应用于临床上受伤眼表恢复视力是具有前景的。但目前的分化方法得到角膜上皮样细胞,不能达到100%阳性率,存在未分化细胞和其他类型的细胞,分化时间较长,限制了角膜上皮样细胞的临床应用。
诱导获得的角膜上皮样细胞是否具有人体内CECs的生物学功能,其安全性、致瘤性以及移植到体内模型中的存活率、免疫排斥反应、抗血管生成作用等都是进入临床应用前必须考虑和解决的问题。研究者还需要进一步探索更加高效、快速的诱导分化方案和纯化方法,并移植到动物模型进行可行性应用研究,为CECs移植治疗最终进入临床医用奠定基础。
1 Rossen J, Amram A, Milani B, et al. Contact lens-induced limbal stem cell defi ciency [J]. Ocul Surf, 2016, 14(4):419-434.
2 王振宇, 周庆军, 史伟云. 多能干细胞向角膜上皮分化的研究进展[J/CD]. 中华细胞与干细胞杂志(电子版), 2015, 5(4):51-56.
3 Kocaba V, Damour O, Auxenfans C, et al. Limbal stem cell defi ciency management. A review[J]. J Fr Ophtalmol, 2016, 39(9):791-803.
4 Sheth R, Neale MH, Shortt AJ, et al. Culture and characterization of oral mucosal epithelial cells on a fibrin gel for ocular surface Reconstruction[J]. Curr Eye Res, 2015, 40(11):1077-1087.
5 Rossant J. Stem cells and early lineage development[J]. Cell, 2008,132(4):527-531.
6 Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell, 2006, 126(4):663-676.
7 Papapetrou EP. Induced pluripotent stem cells, past and future[J].Science, 2016, 353(633):991-993.
8 Kitazawa K, Hikichi T, Nakamura T, et al. PAX6 regulates human corneal epithelium cell identity[J]. Exp Eye Res, 2017, 154:30-38.
9 Ueno H, Kurokawa MS, Kayama M, et al. Experimental transplantation of corneal epithelium-like cells induced by Pax6 gene transfection of mouse embryonic stem cells[J]. Cornea, 2007, 26(10):1220-1227.
10 Ouyang H, Xue Y, Lin Y, et al. WNT7A and PAX6 define corneal epithelium homeostasis and pathogenesis[J]. Nature, 2014, 511(7509):358-361.
11 Davis J, Piatigorsky J. Overexpression of Pax6 in mouse cornea directly alters corneal epithelial cells: changes in immune function,vascularization, and differentiation[J]. Invest Ophthalmol Vis Sci,2011, 52(7):4158-4168.
12 Li W, Chen YT, Hayashida Y, et al. Down-regulation of Pax6 is associated with abnormal differentiation of corneal epithelial cells in severe ocular surface diseases[J]. J Pathol, 2008, 214(1):114-122.
13 Nowell CS, Radtke F. Corneal epithelial stem cells and their niche at a glance[J]. J Cell Sci, 2017, 130(6):1021-1025.
14 Yu D, Chen M, Sun X, et al. Differentiation of mouse induced pluripotent stem cells into corneal epithelial-like cells[J]. Cell Biol Int,2013, 37(1):87-94.
15 Ahmad S, Stewart R, Yung S, et al. Differentiation of human embryonic stem cells into corneal epithelial-like cells byin vitroreplication of the corneal epithelial stem cell niche[J]. Stem Cells,2007, 25(5):1145-1155.
16 Kawasaki H, Suemori H, Mizuseki K, et al. Generation of dopaminergic neurons and pigmented epithelia from Primate ES cells by stromal cell-derived inducing activity[J]. Proc Natl Acad Sci U S A,2002, 99(3):1580-1585.
17 Brzeszczynska J, Samuel K, Greenhough S, et al. Differentiation and molecular profiling of human embryonic stem cell-derived corneal epithelial cells[J]. Int J Mol Med, 2014, 33(6):1597-1606.
18 Gopakumar V, Chatterjee N, Parameswaran S, et al.In vitrotransdifferentiation of human skin keratinocytes to corneal epithelial cells[J]. Cytotherapy, 2016, 18(5):673-685.
19 李兰玉, 朱露露, 朱秀生, 等. 小分子化合物促进体细胞重编程为多能干细胞的研究进展[J]. 黑龙江畜牧兽医, 2017(1):61-64.
20 Arkell RM, Tam PP. Initiating head development in mouse embryos:integrating signalling and transcriptional activity[J]. Open Biol, 2012,2(3):120030.
21 Mikhailova A, Ilmarinen T, Uusitalo H, et al. Small-molecule induction promotes corneal epithelial cell differentiation from human induced pluripotent stem cells[J]. Stem Cell Reports, 2014, 2(2):219-231.
22 Zhang J, Upadhya D, Lu L, et al. Fibroblast growth factor receptor 2 (FGFR2) is required for corneal epithelial cell proliferation and differentiation during embryonic development[J]. PLoS One, 2015,10(1):e0117089.
23 Jiang Yanyan, Ju Zhicai, Zhang Junfu, et al. Effects of insulin-like growth factor 2 and its receptor expressions on corneal repair[J]. Int J Clin Exp Pathol, 2015, 8(9):10185-10191.
24 Huo YN, Chen W, Zheng XX. ROS, MAPK/ERK and PKC play distinct roles in EGF-stimulated human corneal cell proliferation and migration[J]. Cell Mol Biol, 2015, 61(7):6-11.

