抑制NANOG表达对人食管鳞癌Eca-109干细胞增殖的影响
邓丽 向小聪 张若兰 刘康 冯刚
我国是食管癌的高发区,年平均死亡人数约15万,占全国肿瘤死亡率21.8%[1],由于细胞侵袭、转移及耐药的产生使目前该病的主要治疗方法,即联合性的综合治疗,疗效不甚乐观,食管癌的死亡率处于很高的水平[2-4]。因此,探寻食管癌的发生机制、寻找其早期肿瘤标志物对于提高该病的早期诊断及治疗具有重要意义。肿瘤干细胞作为肿瘤细胞群体中数量极少且特殊的一部分细胞,它们有完成细胞自我更新及分化、成瘤性强和抗凋亡等特性,在肿瘤的发生、侵袭及转移中发挥重要作用[5]。肿瘤干细胞对临床上常用的放化疗极为敏感且耐受性强,因此它们是引起肿瘤复发及耐药性形成的重要原因之一,也是导致治疗最终失败的重要因素,因而如果能提出针对食管癌干细胞的基因治疗手段,就有望实现对食管癌的控制。
胚胎干细胞转录调控因子OCT3/4、SOX2以及NANOG等是维持干细胞自我更新、调控细胞分化的关键因素[6]。大量的实验数据表明,转录因子NANOG在乳腺癌等多种肿瘤干细胞中高表达,同时各功能性实验也证明了在多种肿瘤组织中NANOG的异常表达与肿瘤浸润、侵袭及转移密切相关[7-8],但截至目前为止,它与食管癌干细胞自我更新间的关系还未见详细报道。因此,本研究拟通过悬浮培养法分离培养食管癌干细胞,并通过基因沉默技术研究NANOG的表达与食管癌干细胞增殖间的关系。
材料与方法
一、材料
NANOG1、2、NC-shRNA购自上海吉凯基因化学技术有限公司,NANOG、GAPDH、CD133等引物均由成都豪乙生物科技有限公司合成,免疫印迹蛋白实验(Western-Blot)中相关试剂均购自美国Thermo公司,嘌呤霉素、Lipofectamine 2000、RNA提取试剂Trizol、M-MLV逆转录试剂、qPCR Mix均购自美国Invitrogen公司,活死细胞染色试剂购自美国AAT Bioquest公司,细胞因子β-FGF、EGF购自美国PeproTech公司,DMEM/F12、细胞生长添加成分B27购自美国Gibco公司,胎牛血清、高糖DMEM培养基、100X双抗添加剂、0.25%胰蛋白酶均购自美国HyClone公司,NANOG、GAPDH抗体购自美国SANTA CRUZ公司,CD133抗体购自英国Abcam公司,人食管鳞癌细胞系Eca-109为川北医学院基础医学实验中心冻存。
二、方法
1.悬浮培养法分离食管鳞癌干细胞并检测:复苏培养Eca-109食管鳞癌细胞,以含10%胎牛血清的DMEM高糖培养基常规培养。待细胞处于对数生长期,将其消化传代并以无血清培养基(serumfree medium,SFM)重悬,1×105/ml密度接种于低黏附性10 cm培养板中,待食管鳞癌肿瘤干细胞增殖形成肿瘤干细胞球,6 ~ 8 d后,将其收集并机械吹打成单细胞悬液,重悬于SFM,按1 : 5比例传代于10 cm培养板中,继续培养、进一步纯化形成食管鳞癌肿瘤干细胞球。SFM培养基成分:DMEM/F12为基础培养基,添加B27(1 : 50)、EGF(20 ng/ml)、β-FGF(20 ng/ml)生长因子。
分别提取成球前后细胞总RNA(逆转录合成cDNA)和蛋白,进行RT-PCR和Western-Blot检测细胞中肿瘤干细胞标志物CD133、CD44分子及蛋白水平的表达。mRNA表达量,实验结果以GAPDH作为内参照,实验测得数据用2-ΔΔCt分析法进行分析计算。CD133上游引物序列:5'-ACAA TTCACCAGCAACGAGTCC-3';CD133下游引物序列:5'-GACGCTTTGGTATAGAGTGCTCAG-3';CD44上游引物序列:5'-AGACAACCACAAGGA TGACTGATG-3';CD44下游引物序列:5'-TCCAG TTTCCTTCATAAGCAGTGG-3';GAPDH上游引物:5'-TGCACCACCAACTGCTTAGC-3';GAPDH下游引物:5'-GGCATGGACTGTGGTCATGAG-3'。Western-Blot法检测蛋白表达:提取总蛋白并进行蛋白定量。聚丙烯酰胺凝胶电泳法进行蛋白分离。PVDF膜电转移后,封闭45 min,加入CD133、CD44和GAPDH一抗抗体,4 ℃过夜后洗涤,加辣根过氧化物酶标记的二抗抗体。增强化学发光显色,胶片曝光检查蛋白表达水平,以GAPDH作为内参照。每组实验重复3次。
2.细胞转染和分组培养:悬浮培养得到的食管鳞癌干细胞分为如下3组,按照说明书要求,以脂质体2000作为基因载体进行转染:(1)无靶向mRNA的对照(NC)组;(2)靶向沉默NANOG的1号质粒(sh-N1)组;(3)靶向沉默NANOG的2号质粒(sh-N2)组。Sh-N1靶向序列:5'-TAAACTAC TCCATGAACAT-3';sh-N2靶向序列:5'-TGGAACA GTCCCTTCTATA-3'。各组转染后,培养24 h后用含2.5 μg/ml嘌呤霉素的筛选培养基培养48 ~ 72 h用于后续实验。
3. NANOG基因沉默及CD133、CD44表达检测:提取方法2中转染并筛选培养后细胞的总RNA(逆转录合成cDNA)和蛋白,进行RT-PCR和Western-Blot检测NANOG的表达是否被有效敲低。并进一步检测肿瘤干细胞标志物CD133、CD44的表达变化。实验结果以GAPDH作为内参照,实验测得数据用2-ΔΔCt分析法进行分析计算。NANOG上游引物:5'-ACCTATGCCTGTGATTTGTGG-3';下游引物:5'-AGTGGGTTGTTTGCCTTTGG-3'。Western-Blot方法同1,一抗抗体分别为NANOG和CD133。
4.细胞增殖能力检测:取方法2中各组转染并筛选后的细胞,各实验组以2×104个细胞/孔重悬于200 μl培养基中,接种于96孔板。分组继续培养24,48,72和96 h后分别加入CCK-8溶液,继续培养4 h后,酶标仪测量450 nm波长的各孔吸光度(A)值。所有实验重复3次。
5.活死细胞染色:取方法2中各组转染并筛选后的细胞以及75%酒精(EtOH)孵育30 min的凋亡对照组细胞,消化、重悬将细胞接种于六孔板中,培养24 h后,弃培养基,用PBS洗涤细胞3 ~ 5次,配置终浓度为1 μmol/L和2 μmol/L的Calcein-AM和PI染色液,500 μl染色液/孔加入细胞中,置于37 ℃培养箱孵育15 min,显微镜下观察并拍照记录。
6.肿瘤干细胞球形成能力检测:取方法2中各组转染并筛选后的细胞,将其消化传代并重悬于SFM,同方法1中步骤进行肿瘤干细胞成球培养。拍照并对形成的细胞球计数,整理数据比较NANOG表达水平的高低与食管鳞癌肿瘤干细胞成球间的关系。
三、统计学分析方法
采用SPSS 16.0统计学软件进行数据分析。RT-PCR表达水平、CCK-8实验测得A值、肿瘤干细胞球形成数量实验数据采用±s表示,组间比较采用单因素方差分析和t检验。以P< 0.05为差异有统计学意义。
结 果
一、悬浮培养法富集Eca-109肿瘤干细胞球
以无血清的DMEM/F12作为基础培养基,添加EGF、β-FGF、B27生长因子,并辅以低黏细胞培养板降低食管鳞癌细胞的贴壁性。利用该条件从Eca-109食管鳞癌细胞系中成功获得悬浮生长的肿瘤干细胞球,并可以连续传代,如图1。RT-PCR实验结果显示,与未分离的贴壁细胞相比(1.03±0.02,1.02±0.02),Eca-109干细胞球的肿瘤干细胞标志物CD133、CD44表达明显增强(10.12±0.19,9.21±0.26),差异具有统计学意义(P< 0.01)。Western-Blot实验与RT-PCR结果一致。结果如表1、图2。
表1 两组Eca-109细胞CD133、CD44表达量(±s)

表1 两组Eca-109细胞CD133、CD44表达量(±s)
注:实验重复3次
分组CD133CD44

图1 光学显微镜下观察悬浮培养法获得的Eca-109肿瘤干细胞球(×100)
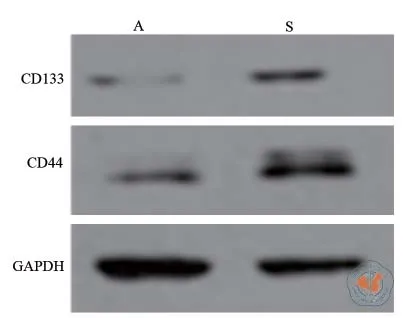
图2 Western Blot检测Eca-109 干细胞分离前后CD133、CD44蛋白表达水平
二、三组食管鳞癌肿瘤干细胞中NANOG表达水平比较
RT-PCR实验检测发现,NANOG沉默质粒转染组(sh-N1、sh-N2)食管鳞癌肿瘤干细胞中NANOG的相对表达水平(0.18±0.01,0.23±0.01)较对照(NC)组(1.03±0.02)下调,即NANOG shRNA有效沉默其mRNA表达,差异具有统计学意义(P< 0.01)。Western-Blot检测与RT-PCR结果一致,NANOG shRNA有效沉默了NANOG蛋白水平的表达,如图3所示。
三、NANOG敲低抑制食管鳞癌肿瘤干细胞增殖
CCK-8实验结果发现,sh-N1、sh-N2组Eca-109干细胞于24、48、72、96 h测得的A值分别为(0.33±0.02,0.52±0.04,0.61±0.06,0.81±0.03),(0.33±0.02,0.45±0.04,0.53±0.04,0.72±0.07),增殖能力低于NC组(0.90±0.01,1.41±0.01,2.31±0.02,3.12±0.07),差异具有统计学意义(P< 0.01,表2)。同时,以酒精处理为阳性对照组的活死细胞染色实验结果表明,NANOG敲低并未引起细胞凋亡,如图4所示。结果提示:NANOG敲低使Eca-109肿瘤干细胞增殖能力明显降低。
四、NANOG敲低抑制食管鳞癌细胞干细胞球形成能力

图3 Western Blot检测NANOG shRNA转染Eca-109干细胞后NANOG的蛋白表达水平
对Eca-109肿瘤干细胞进行NANOG敲低操作后,在悬浮培养的条件下,sh-N1、sh-N2组富集肿瘤干细胞、形成肿瘤干细胞球的能力(12±1,16±2)低于对照NC组(80±3),差异具有统计学意义(P<0.01)。
讨 论
食管癌在世界范围内是常见性的恶性肿瘤,并且仍在持续蔓延。据统计,其5年生存率仅20%左右,中国年发患者数占全球总发病的60%[9-10]。目前,临床上治疗食管癌以根治性手术、放疗、化疗以及中医药治疗为主要治疗手段,并已取得了一定的治疗效果,然而化疗后细胞耐药性出现,并进一步导致肿瘤复发等现象极为常见,这与肿瘤干细胞的存在密切相关。越来越多的研究在乳腺癌、前列腺癌、脑神经瘤等恶性肿瘤中分离得到肿瘤干细胞,并证实它们参与了肿瘤的发生、发展[11-13]。随着对肿瘤干细胞认识的深入,针对肿瘤干细胞进行治疗以抑制肿瘤复发、转移的治疗模式越来越受到重视。目前,对肿瘤干细胞的鉴定多依赖其表面标志物,CD133、CD44是两种被广泛认可的人肿瘤干细胞标志物[14-16]。本研究采用悬浮培养的方法分离Eca-109食管鳞癌干细胞,经过流式细胞术测定,培养所形成的肿瘤干细胞球CD44、CD133的阳性率高达85.2%和91%,表明该方法高效地分离出食管鳞癌干细胞。
表2 三组Eca-109干细胞CCK-8实验测得的(A)值比较(±s)

表2 三组Eca-109干细胞CCK-8实验测得的(A)值比较(±s)
注:实验重复3次
分组24 h48 h72 h96 h NC组0.90±0.011.41±0.012.31±0.023.12±0.07 sh-N1组0.33±0.020.52±0.040.61±0.040.81±0.03 sh-N2组0.33±0.020.45±0.040.53±0.040.72±0.07 F值1121.33525.731022.161198.29 P值< 0.01< 0.01< 0.01< 0.01

图4 荧光显微镜下观察NANOG敲低后细胞存活及凋亡情况(Calcein-AM/PI活死细胞染色,×100)
NANOG是维持胚胎干细胞自我更新最为灵敏的转录调控因子之一,被视为胚胎干细胞重要的“看门人”,其表达量一旦下调就会导致细胞分化[17-19]。肿瘤细胞,尤其是低分化肿瘤细胞,与干细胞相似,具有自我更新和分化增殖的能力,在多种恶性肿瘤的研究中均发现NANOG参与肿瘤干细胞调控,并在肿瘤的侵袭、迁移及耐药中发挥重要作用[19]。研究者发现NANOG在食管癌等多种恶性肿瘤细胞中高表达,同样,在食管鳞癌中也分离出得到肿瘤干细胞[8][20],但NANOG在食管鳞癌干细胞中的作用尚不明确。本研究利用RNA干扰技术,将NANOG作为靶点对食管鳞癌干细胞的功能进行干预。
本研究采用NANOG 短发夹RNA(shRNA)转染Eca-109食管鳞癌干细胞,以探究它对食管鳞癌干细胞增殖的影响。笔者首先通过RTPCR和Western-Blot实验检测转染后各组细胞中NANOG的mRNA及蛋白表达水平,发现与对照(NC组)相比,所采用的NANOG shRNA有效的降低了细胞中NANOG的表达水平。基于此,本研究进一步采用CCK-8实验检测食管鳞癌干细胞增殖能力,同时采用悬浮培养方法检测细胞成球能力。实验结果表明,与对照(NC组)相比,转染NANOG shRNA后的食管鳞癌干细胞增殖和成球能力明显减弱。既往研究也表明,NANOG在胶质细胞瘤等多种恶性肿瘤中高表达,并在肿瘤的发生、发展过程中发挥重要的积极作用[8][21-22]。
综上所述,敲低NANOG对Eca-109食管鳞癌干细胞的增殖具有明显的抑制效果,有望成为针对食管鳞癌的有效靶向性治疗靶点,提高食管鳞癌基因治疗效果。
1 Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J].CA Cancer J Clin, 2016, 66(2):115-132.
2 Xu M, Huang H, Xiong Y, et al. Combined chemotherapy plus endostar with sequential stereotactic radiotherapy as salvage treatment for recurrent esophageal cancer with severe dyspnea: A case report and review of the literature[J]. Oncol Lett, 2014, 8(1):291-294.
3 孙志强, 于静萍, 张志明, 等. 重组人血管内皮抑素对食管癌细胞的放射增敏作用及其机制[J]. 中华放射医学与防护杂志, 2013,33(4):346-350.
4 Zhang X, Komaki R, Wang L, et al. Treatment of radioresistant stem-like esophageal cancer cells by an apoptotic gene-armed,telomerase-specific oncolytic adenovirus[J]. Clin Cancer Res, 2008,14(9):2813-2823.
5 Al-Hajj M, Wicha MS, Benito-Hernandez A, et al. Prospective identifi cation of tumorigenic breast cancer cells[J]. Proc Natl Acad Sci U S A, 2003, 100(7):3983-3988.
6 Rajasekhar VK, Vemuri MC. Regulatory Networks in Stem Cells[M].Humana Press, America, 2009.
7 Amini S, Fathi F, Mobalegi J, et al. The expressions of stem cell markers: Oct4, Nanog, Sox2, nucleostemin, Bmi, Zfx, Tcl1, Tbx3,Dppa4, and Esrrb in bladder, colon, and prostate cancer, and certain cancer cell lines[J]. Anat Cell Biol, 2014, 47(1):1-11.
8 Jeter CR, Badeaux M, Choy G, et al. Functional evidence that the selfrenewal gene NANOG regulates human tumor development[J]. Stem Cells, 2009, 27(5):993-1005.
9 Napier KJ, Scheerer M, Misra S. Esophageal cancer: A Review of epidemiology, pathogenesis, staging workup and treatment modalities[J]. World J Gastrointest Oncol, 2014, 6(5):112-120.
10 冯飞跃, 郑健, 姜岚, 等. MKK4基因启动子区-1304T > G 多态与食管癌易感性研究[J]. 中华肿瘤防治杂志, 2012 (2):88-91.
11 Chen R, Xiao W, Li D, et al. Combination of simvastatin and imatinib sensitizes the CD34+cells in K562 to cell death[J]. Med Oncol, 2011,28(2):528-531.
12 Singh SK, Clarke ID, Terasaki M, et al. Identifi cation of a cancer stem cell in human brain tumors[J]. Neurosurgery, 2003, 53(2):487-488.
13 Gu GY, Yuan JL, Wils M, et al. Prostate cancer cells with stem cell characteristics reconstitute the original human tumorin vivo[J]. Cancer Res, 2007, 67(10):4807-4815.
14 Mccord AM, Jamal M, Williams ES, et al. CD133+glioblastoma stemlike cells are radiosensitive with a defective DNA damage response compared with established cell lines[J]. Clin Cancer Res, 2009,15(16):5145-5153.
15 López J, Poitevin A, Mendoza-Martínez V, et al. Cancer-initiating cells derived from established cervical cell lines exhibit stem-cell markers and increased radioresistance[J]. BMC Cancer, 2012, 12:48.
16 Filipovic A, Stebbing J, Giamas G. Cancer stem cells:therapeutic targeting or therapy?[J]. Lancet Oncol, 2013, 14(7):579-580.
17 Yasuda SY, Tsuneyoshi N, Sumi T, et al. NANOG maintains selfrenewal of Primate ES cells in the absence of a feeder layer[J]. Genes Cells, 2006, 11(9):1115-1123.
18 Bourguignon LY, Peyrollier K, Xia W, et al. Hyaluronan-CD44 interaction activates stem cell marker Nanog, Stat-3-mediated MDR1 gene expression, and ankyrin-regulated multidrug effl ux in breast and ovarian tumor cells[J]. J Biol Chem, 2008, 283(25):17635-17651.
19 Schoenhals M, Kassambara A, De Vos J, et al. Embryonic stem cell markers expression in cancers[J]. Biochem Biophys Res Commun,2009, 383(2):157-162.
20 Zhang G, Ma L, Xie YK, et al. Esophageal cancer tumorspheres involve cancer stem-like populations with elevated aldehyde dehydrogenase enzymatic activity[J]. Mol Med Rep, 2012, 6(3):519-524.
21 Zbinden M, Duquet A, Lorente-Trigos A, et al. NANOG regulates glioma stem cells and is essentialin vivoacting in a cross-functional network with GLI1 and p53[J]. EMBO J, 2010, 29(15):2659-2674.
22 Ben-Porath I, Thomson MW, Carey VJ, et al. An embryonic stem cell-like gene expression signature in poorly differentiated aggressive human tumors[J]. Nat Genet, 2008, 40(5):499-507.

