靶向捕获-高通量测序法对一个先天性白内障家系致病基因的研究
李 乾 张 静 曹琴英 高华方 马 旭*
1.国家卫生计生委科学技术研究所国家人类遗传资源中心(北京,100081);2.河北省石家庄市妇产医院产前诊断中心
靶向捕获-高通量测序法对一个先天性白内障家系致病基因的研究
李 乾1张 静2曹琴英2高华方1马 旭1*
1.国家卫生计生委科学技术研究所国家人类遗传资源中心(北京,100081);2.河北省石家庄市妇产医院产前诊断中心
目的:应用靶向高通量测序技术鉴定一个常染色体显性遗传先天性白内障家系的致病基因。方法:采用靶向捕获已知白内障致病基因并行高通量测序,筛选出候选基因,并对其进行家系内外的共分离检验。结果:该家系符合常染色体显性遗传规律,所有患者均为核性白内障。靶向基因测序发现,位于主要内源性蛋白MIP基因的一个杂合突变c.97C>T(p.R33C)可能是该家系的致病突变,该变异造成MIP基因编码的水通道蛋白氨基酸序列错义改变,并引起蛋白质结构异常,从而影响其功能。通过一代测序验证并确定该杂合突变为该家系的致病突变。结论:MIP基因c.97C>T(p.R33C)突变是造成该先天性白内障家系致病的分子机制。
先天性白内障;靶向测序;突变基因;水通道蛋白
先天性白内障是儿童常见的主要致盲眼病,世界范围内发病率在0.6/10000~6/10000,其发病机制复杂,其中约1/3患者为家族性,由遗传因素引起[1]。先天性白内障可单独发病,也可以是全身病的眼部表现。绝大多数先天性白内障为单基因遗传病,3种遗传方式为常染色体显性遗传、常染色体隐性遗传和性连锁遗传,其中以常染色体显性遗传最为多见[2]。先天性白内障具有明显的遗传异质性和复杂的临床表型异质性,目前已有约40个基因被克隆证实与先天性白内障相关[3]。通过传统的测序法对所有已知基因的突变进行测序分析,有助于先天性白内障病因学诊断,但花费时间较长。近年来,新一代测序技术的发展为检查可疑基因突变提供了一种更快捷、高效的方法,目前针对不同目的基因的靶向捕获和大规模平行测序方法已经成功地应用于遗传性眼病家系或散发病例致病基因的筛查中。本研究应用靶向捕获并行高通量测序的方法对一个连续三代的先天性白内障家系进行致病基因的检测,为先天性白内障产前基因诊断和遗传咨询提供实验依据。
1 对象与方法
1.1 研究对象
本研究中的先天性白内障家系由石家庄市第四医院遗传门诊收集,该家系来自内蒙古自治区,家系三代有14人参与研究。本研究是在《赫尔辛基宣言》指导下,并在患者及其家属知情同意的原则下,详细记录家系患病家族史,收集所有参与成员的相关临床资料(包括收集患者的眼部照片、视力、眼压、眼轴、验光、裂隙灯及眼底),采集血液样本。
1.2 研究方法
1.2.1外周血DNA提取利用QIAGEN血液抽提试剂盒,参照试剂盒说明书提取血液样本DNA,紫外分光光度计测定DNA的浓度和纯度,并进行电泳验证提纯后的DNA。
1.2.2基因靶向富集和高通量测序以家系先证者为研究对象,采用北京迈基诺基因科技有限公司研发的白内障基因外显子序列捕获试剂盒(包含所有已知先天性白内障致病基因以及类似眼部疾患相关共计163个基因的全部外显子),所有基因的全部外显子进行靶向富集。高通量测序以及数据分析按照迈基诺基因科技有限公司标准操作流程。
1.2.3候选基因变异与家系白内障表型的共分离验证验证上述靶向外显子组测序所确定的候选基因突变是否与家系白内障表型共分离,设计引物扩增目的基因片段,应用Sanger测序验证。
2 结果
2.1 家系系谱分析及眼科检查
经家系系谱调查和全面的眼科检查发现,在三代系谱中发病者连续出现,男女患病机会均等,符合常染色体显性遗传规律(图1)。该家系14人中5人患病,发病特点是出生后即发病,双眼不同程度的核性混浊,为核性白内障(图2),视力较差。
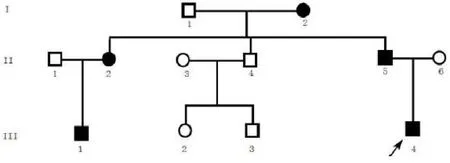
图1 先天性白内障患者家系图
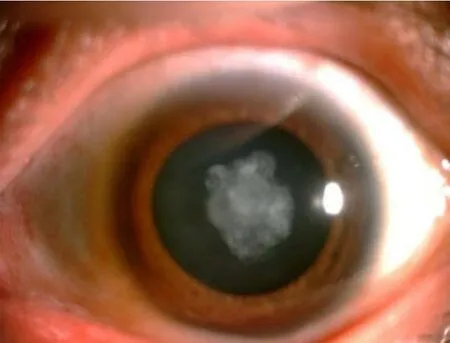
图2 先证者眼部照片
2.2 目标基因组富集及靶向测序结果
以200×测序深度对家系先证者富集序列文库进行测序。质量控制:目标基因区域覆盖度>99%,
目标区域碱基测序深度≥20×所占的比例>99%。经过滤公共数据库比对、致病性分析,留下致病性变异,并对照千人基因组数据库等正常人突变数据库中没有出现或基因频率<5%的位点,去除数据集中的同义突变位点,另外对比数据库中常见的与白内障疾病相关的基因突变热点,找出样本中是否有明确致病的白内障热点基因突变。经过多次层层过滤、筛选,最终4个变异保留下来,其中一个变异位点chr12:56848301C>T,是位于先天性白内障已知致病基因MIP第1外显子,引起该基因编码序列97位的错义突变c.97C>T(p.R33C)。
2.3 MIP基因Sanger测序与家系内白内障表型的共分离验证
针对外显子组测序所发现的MIP基因c.97C>T基因错义突变位点设计引物,对所有家系成员进行扩增和测序分析,结果显示家系中所有患者存在MIP基因的杂合突变,而正常人均未检出该突变(图3),即该突变与家系白内障表型完全共分离。
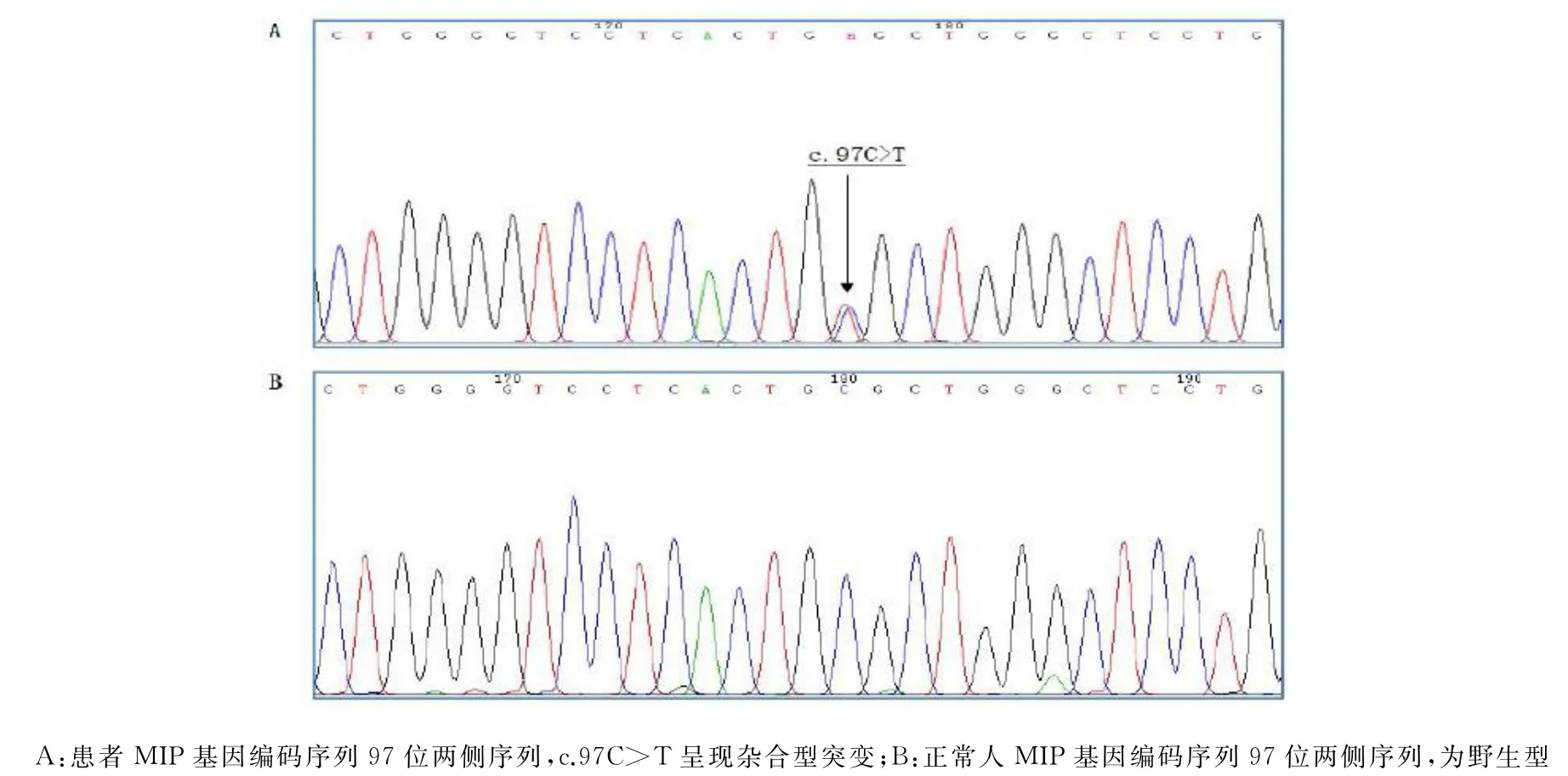
图3 家系中患者及正常人MIP基因测序图
3 讨论
MIP基因位于12号染色体长臂12q13,共有4个外显子,其编码的由263个氨基酸组成的26kD的水通道蛋白(AQP0)是晶状体的主要内源性蛋白,是水通道蛋白家族的一员,主要表达于晶状体纤维细胞膜,约占晶状体纤维细胞膜蛋白的50%[4]。其主要功能是参与晶状体的水代谢,有助于维持晶状体的透明性和内环境稳定,并且它能作为黏附分子在晶状体纤维细胞外形成细小链接来减少晶状纤维细胞间的空隙。水通道蛋白家族成员大小均在28~30kD,具有6个跨膜结构域(H1-H6),3个胞外环(LA,LC,LE),2个胞内环(LB,LD)以及 N 端和C端的2个跨膜结构域[5]。
目前,已有大量研究表明AQP0与白内障的发生有密切关联,因而MIP基因突变会引起AQP0蛋白的异常表达,从而影响晶状体的水代谢及其透明性与内环境稳定。有文献报道,MIP基因突变能够导致AQP0蛋白的错误折叠而影响其运输以及抑制正常表达的AQP0蛋白转运到晶状体纤维细胞膜上,从而引起水通道活性的丧失,并且还能改变晶状体纤维细胞内的PH和钙离子浓度,进而导致白内障的产生[6]。
至今,多个研究报道了导致人常染色体显性先天性白内障发生的 MIP基因致病突变[7-13]。本研究家系中所发现的c.97C>T突变与以往报道的突变位点相同[11],该突变造成了AQP0的33位密码子由精氨酸(R)突变为半胱氨酸(C),这是迄今发现的唯一的一个位于AQP0胞外环LA的氨基酸改变。为明确该变异导致白内障的分子机制,Kumar等[14]设计该变异突变体表达质粒转染非洲爪蟾卵母细胞和犬肾细胞以及黏附功能缺如的细胞,检测表达了AQP0突变体的细胞在水通透性和细胞黏附能力等方面的功能改变,结果发现此突变并不影响细胞的水通透性,但是明显降低细胞黏附能力,并且伴随细胞黏附性下降,细胞间的缝隙连接及胞间通讯也受到影响。因此,MIP基因c.97C>T突变造成AQP0胞外环LA的结构改变,进一步影响到了晶体纤维细胞间的黏附性,导致晶状体的内部稳态被打乱,透明度受到影响,表现为白内障病变。
本研究中所发现的c.97C>T(p.R33C)突变与以往一个中国白内障家系中报道的突变位置相同[11],但是本研究家系患者为核性白内障,与报道中的全白内障的表型不同,其机制尚不清楚,可能与先天性白内障的临床表型异质性有关,即多种白内障表现型也以由同一个基因突变所引起。同时,本研究的结果也进一步证实了MIP基因c.97C>T(p.R33C)突变与白内障发生的密切关系,MIP基因c.97C>T(p.R33C)突变可能是引起中国人群先天性白内障发生的突变热点之一。本研究为先天性白内障基因诊断、产前诊断和遗传咨询提供了一定的实验和理论依据。
(志谢:感谢参与本研究的患者及家属成员)
[1] Apple DJ,Ram J,Foster A,et al.Elimination of cataract blindness:aglobal perspective entering the new millennium[J].Surv Ophthalmol,2000,45(Suppl1):1-196.
[2] Francis PJ,Berry V,Bhattacharya SS,et al.The genetics of childhood cataract[J].J Med Genet,2000,37(7):481-488.
[3] Hejtmancik JF:Congenital cataracts and their molecular genetics[J].Semin Cell Dev Biol,2008,19(2):134-149.
[4] Hall JE,Ehring GR,Simon SA,et al.The structural organization and protein composition of lens fiber junctions [J].J Cell Biol.1989,108(6):2255-2275.
[5] Chepelinsky AB.Structural function of MIP/aquaporin 0in the eye lens;genetic defects lead to congenital inherited cataracts[J].Handb Exp Pharmacol,2009,190(3):265-297.
[6] Berry V,Francis P,Kaushal S,et al.Missense mutations in MIP underlie autosomal dominant polymorphic and lamellar cataracts linked to 12q[J].Nat Genet,2000,25(1):15-17.
[7] Senthil K G,Kyle JW,Minogue PJ,et al.An MIP/AQP0 mutation with impaired trafficking and function underlies an autosomal dominant congenital lamellar cataract[J].Exp Eye Res,2013,110(3):136-141.
[8] Wang K J,Li S,Yun B,et al.A novel mutation in MIP associated with congenital nuclear cataract in a Chinese family[J].Mol Vis,2011,17(1):70-77.
[9] Yang G,Zhang G,Wu Q,et al.A novel mutation in the MIP gene is associated with autosomal dominant congenital nuclear cataract in a Chinese family[J].Mol Vis,2011,17(2):1320-1323.
[10] Wang W,Jiang J,Zhu Y,et al.A novel mutation in the major intrinsic protein (MIP)associated with autosomal dominant congenital cataracts in a Chinese family[J].Mol Vis,2010,16(5):534-539.
[11] Gu F,Zhai H,Li D,et al.A novel mutation in major intrinsic protein of the lens gene(MIP)underlies autosomal dominant cataract in a Chinese family[J].Mol Vis,2007,13(9):1651-1656.
[12] Shentu X,Miao Q,Tang X,et al.Identification and Functional Analysis of a Novel MIP Gene Mutation Associated with Congenital Cataract in a Chinese Family[J].PLoS One,2015,10(5):e0126679.doi
[13] Ding X.Zhou N,Lin H,et al.A novel MIP gene mutation analysis in a Chinese family affected with congenital progressive punctate cataract[J].PLoSOne,2014,9(7):e102733.doi:10.1371
[14] Sindhu SS,Gandhi J,Mohammed MH,et al.Functional characterization of an AQP0missense mutation R33Cthat causes dominant congenital lens cataract,reveals impaired cell-to-cell adhesion[J].Exp Eye Res,2013,116(11):371-385.
The study of identifying a missense mutation of MIP in a Chinese family with congenital cataracts by target region capturesequencing
LI Qian1,ZHANG Jing2,CAO qinying2,GAO huafang1,MA Xu1*
1.NationalHumanGeneticResourcesCenter,NationalResearchInstituteforFamilyPlanning,Beijing,100081;2.PrenatalDiagnosisCenter,ShijiazhuangObstetricsandGynecologyHospital
*Correspondingauthor:genetic@263.netc.n
Objective:To investigate the pathogenesis gene of a Chinese family with autosomal dominant congenital cataracts(ADCC)by target rejoin capture sequencing.Methods:A three generation Chinese family with ADCC were recruited and all patients from this family were underwent comprehensive ophthalmic examinations.The periphery blood of the proband was collected for target rejoin capture sequencing,then the sequencing results were compared with the data of Human Genomic Database,the synonymous mutation was matched the reported common variants,and false positive results were finally excluded by sanger sequencing and then the candidate gene were identified.Results:The patients were distributed in each generation with equal incidence rates in male and female subjects,which was in accordance with autosomal dominant inheritance.Target rejoin capture sequencing found an identified heterozygous mutation c.97C>T (p.R33C)in major intrinsic protein(MIP)gene.This missense mutation resulted in an abnormal Aquaporin 0(AQP0)protein.Then the Sanger sequencing was used to verify the MIP gene.Conclusion:The heterozygous mutation c.97C>T (p.R33C)in MIP gene is the molecular pathogenesis of this ADCC family.
congenital cataracts;target rejoin capture sequencing;Mutant gene;Aquaporin0
10.3969/j.issn.1004-8189.2017.09.004
国家卫生计生委科学技术研究所科技创新基金面上项目(2016GJM05)
2017-05-24
2017-07-10
* 通讯作者:genetic@263.net.cn
张 璐]

