左卡尼汀合成工艺改进
吴 静, 阎 欢, 刘九知, 于河舟
(东北制药集团股份有限公司, 辽宁 沈阳 110027)
左卡尼汀,又称左旋肉碱,化学名称:(R)-3-羟基-4-(三甲基胺基)丁酸盐,结构式为:

左卡尼汀为人体代谢所必需,被认为是“类维生素”的营养素,临床上有许多应用,对左卡尼汀缺乏症、心血管疾病、高血脂、透析的肾病、肝硬化和糖尿病等均有疗效或辅助治疗作用,已被世界卫生组织规定为法定多用途营养剂,我国卫生部也已将左卡尼汀列入营养强化剂.
目前文献报道左卡尼汀的制备方法概括划分为化学合成法[1-5]、提取法[6]和生物合成法[7-8].提取法和生物合成法由于提取纯化的步骤较多,且产量较低,难以形成规模生产.
近期报道的化学合成法主要有以下4种:(a)以环氧氯丙烷为起始原料,采用(S)-Salen Co 催化剂经过动力学拆分得到右旋环氧氯丙烷,其与三甲胺盐酸盐反应制得季铵盐,再和氰化钠反应,经过水解得到左卡尼汀[1];(b)以4-氯乙酰乙酸乙酯为原料,在手性催化剂{[Ru(p-cymene)I(+)TMBTP]I}作用下,于高温经催化氢化制得(R)-4-氯-3-羟基丁酸乙酯,再与质量分数为45 %的三甲胺水溶液在高温反应24 h转化为左卡尼汀[2];(c)以氯乙醛和乙烯酮为原料,在催化剂三甲硅基奎宁作用下,合成β-内酯,进一步与三甲胺反应生成左卡尼汀[3];(d)以4-氯乙酰乙酸乙酯为原料,在手性催化剂L-酒石酸修饰的Ni-B/SiO作用下低温氢化还原,得到(R)-4-氯-3-羟基丁酸乙酯,再与质量分数为33 %的三甲胺反应生成左卡尼汀[4-5].
方法(a)工艺路线长,设备投资大,并且用到剧毒氰化钠,危险性强,环境不友好,三废处理困难,并且需要拆分,造成收率低且制造成本高.方法(b)已申请专利,采用的{[Ru(p-cymene)I(+)TMBTP]I}手性催化剂没有工业化生产,制备工艺复杂,成本极高,不能用于工业化生产;其用质量分数为45 %的三甲胺水溶液进行胺化、水解制备左卡尼汀,存在温度高、反应时间长,导致副反应多、杂质多、收率低(仅为有70 %)等问题.方法(c)路线优点是原料易得,价格便宜,缺点是乙烯酮为有毒气体,不易保存,操作条件苛刻,催化剂三甲硅基奎宁不易得,且有毒.方法(d)虽然申请了中国专利,但有文献报道对映体选择性差,(R)-4-氯-3-羟基丁酸乙酯的纯度低,且催化剂L-酒石酸修饰的Ni-B/SiO2没有销售.
目前有文献[9]报道以4-氯乙酰乙酸甲酯为原料,以甲醇为反应溶剂,在90~120 ℃条件下,采用高效廉价的Ru(OCOMe)2[(S)-BINAP]手性还原剂不对称氢化得到(R)-4-氯-3-羟基丁酸甲酯,收率为95 %.该方法所得到的(R)-4-氯-3-羟基丁酸甲酯的纯度高,且催化剂Ru(OCOMe)2[(S)-BINAP]有市售.虽然该文献合成目标为(R)-4-氯-3-羟基丁酸甲酯,而且没有进一步合成下游系列产品,但对我们进行左卡尼汀的合成工艺改进提供了很好的借鉴.
在查阅、分析和综合大量文献的基础上,对左卡尼汀合成工艺进行改进:以4-氯乙酰乙酸乙酯为原料,以乙醇为反应溶剂,在60 ℃条件下,采用Ru(OCOMe)2[(S)-BINAP]手性还原剂不对称氢化得到(R)-4-氯-3-羟基丁酸乙酯,收率为98 %;再采用氢氧化钾与质量分数为25 %的三甲胺水溶液的混合物在室温条件下“一锅法”进行胺化、水解,制备左卡尼汀.该方法收率高,避免使用剧毒的氰化钠,环境友好,三废易于治理.“一锅法”制备左卡尼汀操作简单,温度适宜,避免了由于温度高、反应时间长所导致的副反应多、杂质多、收率低等问题,适合工业化大生产.
左卡尼汀的合成路线:

1 实验部分
1.1 主要仪器和药品
Waters′ ACQUITY UPLC-Xevo TQ 超高效液相色谱-质谱联用仪,沃特世科技(上海)有限公司;SGW X-4显微熔点仪,上海安亭科学仪器厂;SGW-2自动恒温旋光仪,上海仪分科学仪器有限公司.
4-氯乙酰乙酸乙酯,浙江兰溪市灵申化工厂生产;Ru(OCOMe)2[(S)-BINAP],北京伊诺凯科技有限公司生产;其他试剂均由天津博迪化工股份有限公司生产,所用试剂均为分析纯.
1.2 合 成
1.2.1 (R)-4-氯-3-羟基丁酸乙酯的合成
向0.5 L氢化高压釜中加入4-氯乙酰乙酸乙酯100 g(0.608 mol)、催化剂Ru(OCOMe)2[(S)-BINAP]0.1 g和88 g乙醇,密闭反应釜,通氢气置换反应釜中的空气3次,保持反应釜的压力为5 MPa,升温至60 ℃,搅拌1 h,然后降温至室温.反应液减压浓缩,剩余棕色油状物高真空蒸馏,在压力达到并稳定在5 mmHg时,接收沸程在93~95 ℃的馏出物,得无色透明液体(R)-4-氯-3-羟基丁酸乙酯99.2g,收率98.0 %,旋光纯度为99 %.
1.2.2 左卡尼汀化合物的制备
将300 g纯化水加入到1 000 mL 四颈瓶中,室温条件下加入38.3 g(0.683 mol)氢氧化钾,搅拌至固体全溶.滴加质量分数为25 %的三甲胺水溶液240 g.滴毕,继续滴加99.2 g(0.595 mol)(R)-4-氯3-羟基丁酸乙酯.滴加结束后继续反应12 h.滴加浓盐酸调pH值为6,用732型阳离子树脂柱纯化.
加入反应液,控制柱下流速≤0.5 L/h,加料毕,向树脂柱中加入纯化水,开始控制柱下流速≤0.5 L/h,测柱下排液pH值为6时结束.加入质量分数为4 %~6 %的稀氨水,控制柱下流速≤0.2 L/h,当柱下排液的pH值为7时开始接收,pH值>8停止接收.接收液旋干,得白色固体左卡尼汀产品86.4 g,收率90.1 %,总收率88.3 %,比旋度为-29.8°(c=1,H2O).经过质谱(图1)和熔点方法确认了结构,LC-MS:M=161;熔点:204.5~206.3 ℃.

图1 质谱
2 结果与讨论
2.1 工艺优化
为了寻找合成(R)-4-氯-3-羟基丁酸乙酯的最佳工艺条件,分别考察了催化剂Ru(OCOMe)2[(S)-BINAP]的用量、反应温度和反应压力对纯度和收率的影响.
2.1.1 催化剂Ru(OCOMe)2[(S)-BINAP]用量对还原产物光学纯度的影响
只改变Ru(OCOMe)2[(S)-BINAP]催化剂用量,其余反应条件同1.2.1,考察催化剂Ru(OCOMe)2[(S)-BINAP]用量对还原产物光学纯度的影响,结果见表1.由表1可见:既保证光学纯度又考虑成本,Ru(OCOMe)2[(S)-BINAP]催化剂在此反应条件下的最佳用量为0.1 g.

表1 催化剂Ru(OCOMe)2[(S)-BINAP]用量对还原产物光学纯度的影响
2.1.2 反应温度对反应时间和收率的影响
只改变反应温度,其余反应条件同1.2.1,考察还原反应温度对还原反应时间和收率的影响,结果见表2.由表2可见:反应温度为60 ℃可使还原反应获得的收率最高,为98.0 %,反应温度过高或过低对反应收率均产生负面影响.

表2 反应温度对反应时间和收率的影响
2.1.3 反应压力对还原反应时间的影响
只改变反应压力,其余反应条件同1.2.1,考察反应压力对还原反应时间的影响,结果见表3.由表3可见:综合反应效率与安全,在此条件下的最佳反应压力为5 MPa.
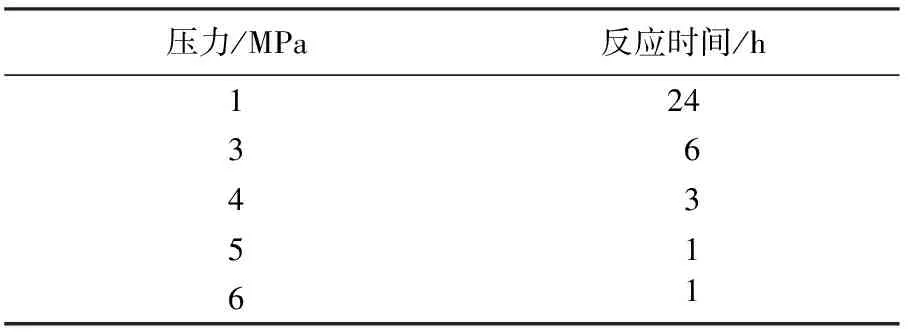
表3 反应压力对反应时间的影响
2.2 实验结果
综上所述,合成(R)-4-氯-3-羟基丁酸乙酯的最佳条件为:原料4-氯乙酰乙酸乙酯为100 g时,催化剂Ru(OCOMe)2[(S)-BINAP]用量为0.1 g,反应温度为60 ℃,反应压力为5 MPa,反应时间为1 h,收率98.0 %.
3 结 论
采用4-氯乙酰乙酸乙酯为起始原料,在Ru(OCOMe)2[(S)-BINAP]催化下以乙醇为反应溶剂,经过手性还原反应制得(R)-4-氯-3-羟基丁酸乙酯,再采用氢氧化钾和质量分数为25 %的三甲胺水溶液的混合物在室温条件下“一锅法”进行胺化、水解制备左卡尼汀,并且考察了合成(R)-4-氯-3-羟基丁酸乙酯的最佳反应条件,总收率88.3 %,比现有的合成工艺收率显著提高. 摒弃了现有左卡尼汀合成工艺步骤繁琐、需要用到剧毒氰化物的不利因素,全新的左卡尼汀合成工艺原料易得,操作简单,绿色环保,适合工业化生产.
[1] 沈大冬,朱锦桃.L-(-)-肉碱的合成[J].中国医药工业杂志,2006,37(12):801-803.
[2] 白君林,张晓娟,熊飞,等.一种l-肉碱及其中间体的制备方法:CN102952028A[P].2013-03-06.
[3] CASATI P,FUGANTI C.Process for the Preparation of L-Carnitine:US4664852[P].1987-05-12.
[4] MIDLAND M M,GREER S,TRAMONTANO A,et al.Chiral Trialkylborane Reducing Agents.Preparation of 1-Deuterio Primary Alcohols of High Enantiomeric Purity[J].J.Am.Chem.Soc.,1979,101(9):2352-2355
[5] 胡建荣.一种左卡尼汀化合物及其新制法:CN101875616A[P].2011-11-03.
[6] 朱晓萍,刘安军,王丽霞.肉中L-肉碱的提取及含量比较研究[J].食品科技,2003(Z1):127-130.
[7] VANDECASTEELE J P,LEMAL J.Enzymatic Synthesis of L-Carnitine:US4221869[P].1980-09-09.
[8] 张晓媛.L-肉碱的微生物酶合成法研究进展[J].赣南师范学院学报,2006,27(3):81-84.
[9] RYOJI N,MASATO K,TAKESHI O,et al.Process for Preparing Carnitine: EP0339764A1[P].1989-11-02.

