靛玉红对神经胶质瘤细胞U251的增殖抑制及Bcl-2表达的影响*
张 涛,易昊天,王帮华,王泽夏,宁志丰,胡美纯
(湖北科技学院基础医学院基础医学研究中心,湖北 咸宁 437100)
神经胶质瘤是神经系统肿瘤中发病率最高的原发性恶性肿瘤,其高死亡率严重危害人类健康[1-2]。神经胶质瘤对放化疗具有较强的耐受性,治疗效果差,且治疗后易复发,患者中位生存期不足1 年[3-4]。靛玉红(Indirubin)是从中药青黛(Indigofera tinctoria L)中分离出来的有效成分,为一双吲哚类小分子化合物。已有研究表明[5]靛玉红对人乳腺癌细胞、人结肠癌细胞、人体鼻咽癌细胞等多种恶性肿瘤均具有明显的抑制作用,其作用机制可能是抑制DNA和蛋白质的合成。目前,靛玉红因其具有毒性低、副作用小、对多种肿瘤具有较好的抑制作用等抗癌特性,临床上已被批准用于治疗慢性粒细胞白血病。然迄今为止,靛玉红在神经胶质瘤方面的抑制作用却鲜有报道。Williams与Lawler等曾报道过靛玉红对神经胶质瘤细胞迁移的抑制[6],但关于靛玉红对神经胶质瘤细胞增殖的影响尚无人报道。本研究发现靛玉红抑制神经胶质瘤的增殖并通过下调Bcl-2起作用,为靛玉红治疗神经胶质瘤的临床应用提供理论依据。
1 材料与方法
1.1 实验材料
细胞:正常人脑星型胶质细胞HEB及人多形性胶质母细胞瘤细胞U251购自ATCC。主要试剂:MTT和二甲基亚砜(Dimethyl sulfoxide,DMSO)购自Sigma-Aldrich公司;DMEM高糖培养基(Gibco)、Tris碱、甘氨酸(glycine)、十二烷基磺酸钠(SDS)、牛血清白蛋白、甘油、甲醇、溴酚蓝、40%丙烯酰胺、四甲基乙二胺(TEMED)等试剂购自上海生工生物;NC膜(Millipore)、过硫酸铵(Sigma-Aldrich)、胎牛血清(Gibco)、100X青霉素+链霉素混合液P/S (Invitrogen)、胰蛋白酶trypsin+0.25% EDTA (Hyclone)、免疫组化试剂盒 (上海明睿生物技术有限公司),来源于兔的抗Bcl-2的多克隆抗体(YY0032R,Abbkine),来源于小鼠的抗β-Actin的单克隆抗体(#A5441,Sigma-Aldrich);靛玉红购买自南京泽朗生物科技有限公司(HPLC检测纯度 98%以上)。
1.2 方法
1.2.1 MTT比色法检测靛玉红对U251细胞增殖的抑制作用
收集对数期U251及HEB细胞,调整细胞悬液浓度,每孔加入100μL铺板使细胞密度为5000个/孔。5%CO2,37℃孵育至细胞单层铺满孔底(96孔平底板),加入经DMSO溶解的浓度分别为0、5、10、20、50μM的靛玉红处理48h。每孔加入20μL MTT溶液(5mg/ml,即0.5%MTT)继续培养4h。PBS冲洗2~3遍后,再加入含MTT的培养液终止培养。每孔加入150μL DMSO使碘硝基四唑甲臜结晶充分溶解。酶标仪于490nm处测量各孔的吸光值OD。以靛玉红浓度0μM为对照组,后续所有实验均按此原则进行。细胞存活率=(实验组OD-对照组OD)/(对照组OD),设定对照组存活率为1。实验组存活率与之相比,小于1,药物有抑制增殖作用;大于1,药物有促进增殖作用。实验均重复3次以上。
1.2.2 Western blot检测靛玉红作用后Bcl-2的表达量
靛玉红处理好的细胞用加强型RIPA lysis buffer裂解蛋白,具体方法为,细胞用预冷PBS洗涤两遍,加入适合体积的裂解液将细胞充分刮下,置于冰上裂解15min。4℃12,000rpm离心15min,收集上清。BCA蛋白定量。加入5X SDS-loading buffer于100℃煮沸10min后进行蛋白电泳。一抗过夜。二抗孵育1h。Odyssey成像系统扫膜,分析结果。
1.2.3 免疫组化分析靛玉红干预后皮下肿瘤中Bcl-2的表达水平
将U251细胞皮下注射到免疫缺陷小鼠(裸鼠)背部皮下,待皮下肿瘤长到100mm3左右将小鼠分为药物干预组和对照组,实验共采用20只小鼠,每组各10只:动物实验所用的药物剂量按mg/kg体重计算,经称量小鼠平均体重为25g,应用时从已知药液的浓度换算出相当于每mg体重应注射的药液量,以便给药。实际每只小鼠每天腹腔注射药物100μL。干预组小鼠腹腔注射靛玉红剂量20mg/(kg·d);对照组小鼠腹腔注射等体积的100μL DMSO。待30d后实验结束时剥离皮下肿瘤组织块,免疫组化方法按照试剂盒说明书进行。DAB显色5min。苏木精染色5min。1%盐酸酒精分色10s,自来水冲洗返蓝10min。脱水,透明,封片,镜检,拍照。干预组和对照组的每张切片计数4个高倍视野的棕黄色染色细胞为阳性细胞,然后得出均值做为每张切片的阳性细胞数,将实验组的阳性细胞个数与对照组的阳性细胞个数进行百分比即为阳性相对表达量。
1.3 统计分析
2 结 果
2.1 靛玉红抑制神经胶质瘤细胞增殖
图1(封二)的细胞存活实验发现,经靛玉红处理的U251细胞增殖活性显著下降。随着靛玉红给药浓度的升高,U251细胞的存活率逐渐下降。在给药浓度为20 μM时,细胞存活率降低了约62%。在最大浓度50 μM时,细胞相对存活率下降了85%以上,说明靛玉红对肿瘤细胞具有明显的杀伤效果,而对正常细胞HEB的毒性较低。即使是在最大浓度50 μM时,靛玉红对正常细胞的存活下降率仍不足20%,这说明靛玉红在正常细胞及肿瘤细胞之间具有较好的选择性。
2.2 靛玉红下调体外细胞Bcl-2蛋白表达水平
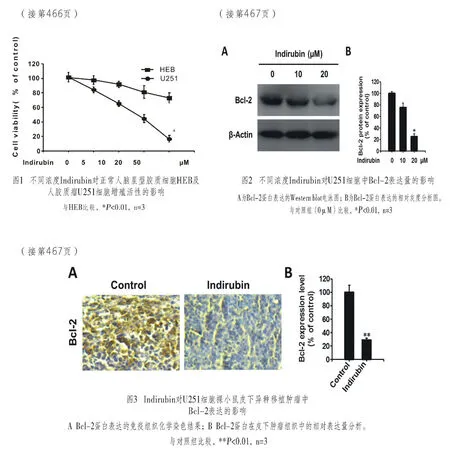
不同浓度的靛玉红处理U251细胞后检测Bcl-2蛋白表达水平,结果如图2(封二)所示。Bcl-2随着靛玉红浓度的增加而逐渐下降(图2A),至靛玉红浓度为20μM时为最低。图2B为根据图2A的结果所进行的灰度值统计分析,由图可见20μM时Bcl-2的蛋白浓度下降了75%以上。以上结果初步证明靛玉红可下调Bcl-2的表达。
2.3 靛玉红降低体内肿瘤Bcl-2阳性表达率
在U251裸小鼠皮下肿瘤模型中进行靛玉红腹腔注射。剂量为20 mg/(kg·d)的靛玉红显著降低皮下肿瘤的生长。剥离肿瘤组织行免疫组化,图3A(封二)的结果显示,对照组(0μM)中,棕黄色的附性细胞明显多于实验组(20μM)的阳性细胞数。图3B(封二)为根据图3A的结果进行的Bcl-2蛋白阳性表达率分析,当对照组阳性表达率为100%时,实验组的阳性表达率仅为25%,两组间的阳性表达率呈显著性差异(P<0.01)。提示靛玉红在体内具有下调Bcl-2蛋白表达的功能。
3 讨 论
与传统药物相比,小分子靶向药物具有副作用更小、特异性更高以及药效更高等优势,目前是神经胶质瘤药物治疗的研究热点[7]。传统神经胶质瘤治疗采用放化疗结合的方法,这对正常细胞的损伤较大,且患者到中后期会出现许多不良反应。分子靶向治疗有望克服上述不足,在神经胶质瘤治疗方面将得到广泛应用。甲磺酸伊马替尼(Gleevec),第一个小分子靶向药物于2001 年被FDA批准上市后,陆续有许多小分子靶向药物如阿法替尼(afatinib)、色瑞替尼(cerritinib)等被发现[8-9]。研发具有我国自主知识产权的抗神经胶质瘤靶向药物对于延长神经胶质瘤患者生命具有重要意义。
U251是一株高度恶性的神经胶质瘤细胞,常作为研究的理想细胞模型。Bcl-2蛋白的异常高表达与多种肿瘤的进展相关,在细胞存活过程中起关键作用。以Bcl-2蛋白家族为靶点设计抗肿瘤药物已成为药物开发领域的广泛策略。本研究结果显示,靛玉红对神经胶质瘤具有显著抑制作用;Western blot及免疫组化结果显示靛玉红通过下调Bcl-2对神经胶质瘤起抑制作用。然而,靛玉红是否通过与Bcl-2直接作用抑制神经胶质瘤尚未得到证实。关于Bcl-2蛋白水平的降低,我们猜想有更多种可能的分子机制参与其中:靛玉红是通过上游转录水平下调Bcl-2的mRNA从而降低了Bcl-2的表达量?亦或靛玉红有可能直接促进Bcl-2的降解?这些深入的分子机制有待本课题组进一步探讨。
总之,本研究在细胞模型及动物模型基础上明确了靛玉红对神经胶质瘤的抑制作用,重点研究了靛玉红对Bcl-2蛋白表达量的效果,初步探讨了靛玉红抑制神经胶质瘤的分子机制。本研究结果有望为以靛玉红为先导化合物的一类新型小分子化合物治疗神经胶质瘤提供理论支持,为抗神经胶质瘤的新药研发工作奠定基础。
[1]SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics[J].CA Cancer J Clin,2017,67(1):7
[2]TRIFILETTI D M,ALONSO C,SHOWALTER T N,et al.Prognostic implications of extent of resection in glioblastoma:analysis from a large database[J].World Neurosurg,2017,103:330
[3]SATHORNSUMETEE S,RICH J N,REARDON D A.Diagnosis and treatment of high-grade astrocytoma[J].Neurol Clin,2007,25(4):1111
[4]RASHEED B K,WILTSHIRE R N,BIGNER D D,et al.Molecular pathogenesis of malignant gliomas[J].Curr Opin Oncol,1999,11(3):162
[5]BLAZEVIC T,HEISS E,UHRIN P,et al.Indirubin and indirubin derivatives for counteracting proliferative diseases[J].Evid Based Complement Alternat Med,2015,2015:654098
[6]WILLIAMS S P,NOWICKI M O,LAWLER S E,et al.Indirubins decrease glioma invasion by blocking migratory phenotypes in both the tumor and stromal endothelial cell compartments[J].Cancer Res,2011,71(16):5374
[7]PEARSON A D,HEROLD R,CHESLER L,et al.Implementation of mechanism of action biology-driven early drug development for children with cancer[J].Eur J Cancer,2016,62:124
[8]LELAIS G,EPPLE R,BURSULAYA B,et al.Discovery of (R,E)-N-(7-Chloro-1-(1-[4-(dimethylamino)but-2-enoyl]azepan-3-yl)-1H-benzo[d]imid azol-2-yl)-2-methylisonicotinamide (EGF816),a novel,potent,and WT sparing covalent Inhibitor of oncogenic (L858R,ex19del) and resistant (T790M) EGFR mutants for the Treatment of EGFR mutant Non-Small-Cell lung cancers[J].J Med Chem,2016,59(14):6671
[9]GUO T,ZHAO L,LI H,et al.A monoclonal antibody targeting the dimer interface of epidermal growth factor receptor (EGFR) [J].Immunol Lett,2016,180:39