溃疡性结肠炎患者TNF-α基因启动子-308G/A单核苷酸多态性观察
常廷民,张超贤,张利利,李秀敏
(新乡医学院第一附属医院,河南卫辉 453100)
溃疡性结肠炎患者TNF-α基因启动子-308G/A单核苷酸多态性观察
常廷民,张超贤,张利利,李秀敏
(新乡医学院第一附属医院,河南卫辉 453100)
目的分析溃疡性结肠炎(UC)患者肿瘤坏死因子-α(TNF-α)基因启动子-308G/A单核苷酸多态性。方法UC患者750例(观察组),健康体检者750例(对照组),采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)技术分析两组TNF-α基因启动子-308G/A单核苷酸多态性;ELISA法检测两组血浆TNF-α。结果观察组GG、GA、AA基因型频率及G、A等位基因频率分别为14.93%、42.27%、42.80%、36.07、63.93%,对照组分别为67.73%、16.40%、15.87%、75.93、24.07%,两组比较,P均<0.05。观察组及对照组血浆TNF-α水平分别为(31.48±11.52)、(14.82±5.61)pg/L,两组比较,P<0.05。观察组GG、GA、AA基因型携带者TNF-α水平分别为(17.95±7.82)、(34.32±0.75)、(34.64±13.83)pg/L,对照组分别为(10.63±3.29)、(21.25±10.47)、(21.91±8.51)pg/L,GA、AA基因型与同组GG基因型携带者比较,两组GG、GA、AA基因型携带者比较,P均<0.05。结论UC患者TNF-α基因启动子-308G/A存在单核苷酸多态性,GA、AA基因型是UC的易患因素,这可能与两基因型可提高患者血浆TNF-α水平密切相关。
肿瘤坏死因子-α基因启动子-308G/A;单核苷酸多态性;溃疡性结肠炎;肿瘤坏死因子α
溃疡性结肠炎(UC)的病因和发病机制尚未完全明确,目前认为肠道微生态失衡及肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)等炎症细胞因子调节紊乱起重要作用[1~4]。TNF-α是由单核巨噬细胞产生的一种细胞因子,具有广泛的生物学活性,除有抗肿瘤作用外,对免疫反应、机体代谢、炎症反应均有重要的调节介导作用[5,6]。TNF-α参与UC致病作用主要是使中性粒细胞聚集、内皮细胞黏附分子表达上调及引起凝血酶原效应等。在肠道中,TNF-α介导黏膜损伤的作用,同时刺激炎症细胞分泌其他细胞因子,如诱导产生血小板激活因子、白三烯等,使结肠固有膜内小血管在炎症基础上形成微血栓,导致黏膜微循环障碍,使肠黏膜组织损伤进一步加重,TNF-α通过上述过程参与UC发病,为UC发病机制中的启动因子[7,8]。TNF-α基因具有单核苷酸多态性位点,即一个单核苷酸多态性位点具有2个或多个等位基因,不同的等位基因编码的TNF-α活性有差异[9~12]。TNF-α基因的多态性可使机体对外界环境饮食因素(如高脂饮食)的反应能力有所不同,这是决定机体炎症性疾病易感性的一个重要因素。本研究对750例UC患者和750例健康体检者的TNF-α基因启动子-308G/A单核苷酸多态性进行了观察,并探讨TNF-α基因启动子-308G/A单核苷酸多态性与UC发病的关系。
1 资料与方法
1.1 临床资料 选取2009年4月~2014年8月新乡医学院第一附属医院收治的UC患者750例(观察组),男466,女284例;年龄40~68(50.67±9.14)岁;所有患者均经内镜检查结合病理学确诊,体检显示无肿瘤、其他自身免疫性及遗传性疾病,纳入研究时均为第一次就诊,未经任何药物和手术治疗。另选750例健康体检者作为对照组,男466,女284例;年龄39~69(50.38±8.63)岁。均为豫北居民或在豫北10年及以上,在年龄、性别、民族、籍贯和生活习惯上比较无统计学差异,且无血缘关系。观察组有饮酒史389例(51.87%)、吸烟史360例(48.00%),对照组分别为172例(22.93%)、563例(75.07%),两组比较,P均<0.05。
1.2 TNF-α基因启动子-308G/A基因单核苷酸多态性分析 参照文献[13]方法。于清晨抽取受试者静脉血8 mL,其中4 mL置于乙二胺四乙酸钠抗凝管中,分离白细胞层。用QIAampDNA提取试剂盒(德国QIAgen公司)提取白细胞DNA,DNA置于-30 ℃低温冰箱保存备用。引物序列:5′-AGGCAATAGGTTTTGAGGGCCAT′,5′-TCCTCCCTGCTGCTCCGATTCCG-3′,由Invitrogen公司合成,PCR反应体系包括:dNTPmix 4 μL(终浓度0.2 mol/L),10×缓冲液5 μL,MgCl24 μL(终浓度1.5 mol/L),基因组DNA 1 μL,上下游引物各0.5 μL,Taq DNA聚合酶Mix液(Takara公司)6 μL,使用美国PE-2400型PCR扩增仪。反应条件:95 ℃预变性5 min;95 ℃变性1 min,58 ℃退火1 min,72 ℃延伸1 min,35个循环;最后72 ℃延伸8 min。PCR产物长度为107 bp,经Bio-Rad染色琼脂糖凝胶电泳确认扩增结果后,以限制性内切酶NcoⅠ酶切,37 ℃孵育4 h,取酶切产物4 μL经Bio-Rad染色琼脂糖凝胶电泳。酶切产物放入紫外线凝胶成像仪观测。可见3种带型:GG纯合子完全被酶切,产生87、20 bp两种片段,20 bp片段在电泳图中不能显示,可见87 bp的1条区带;GA杂合子部分被酶切,产生为107、87、20 bp的三种片段,20 bp片段不能显示,在电泳图中可见为107、87 bp的两条区带;AA纯合子不能被酶切,显示107 bp的1条区带。每组随机抽取30个初步确定了基因型的样本,用PCR扩增后,送上海生工生物工程技术服务公司进行DNA序列测定进行验证。
1.3 血浆TNF-α检测 采用ELISA法检测血浆TNF-α。
1.4 统计学方法 采用SPSS11.0统计软件。Hardy-Weinberg平衡检验研究样本的群体代表性,以P>0.05为符合Hardy-Weinberg规律。用相对风险度的比值比(OR)和95%可信区间(95%CI)评价相对风险,观察组和对照组之间的基因型频率和等位基因频率采用χ2检验。P<0.05为差异有统计学意义。
2 结果
TNF-α基因启动子-308G/A的基因型分别为GG、GA、AA,等位基因分别为G、A。符合Hardy-Weinberg遗传平衡(P>0.05),表明本实验所选取人群具有群体代表性。两组TNF-α基因启动子-308G/A基因型、等位基因分布见表1。由表1可知,两组GG、GA、AA基因型频率及G、A等位基因频率比较,P均<0.05。观察组及对照组血浆TNF-α水平分别为(31.48±11.52)、(14.82±5.61)pg/L,两组比较,P<0.05。两组不同基因型携带者血浆TNF-α水平比较见表2。
3 讨论
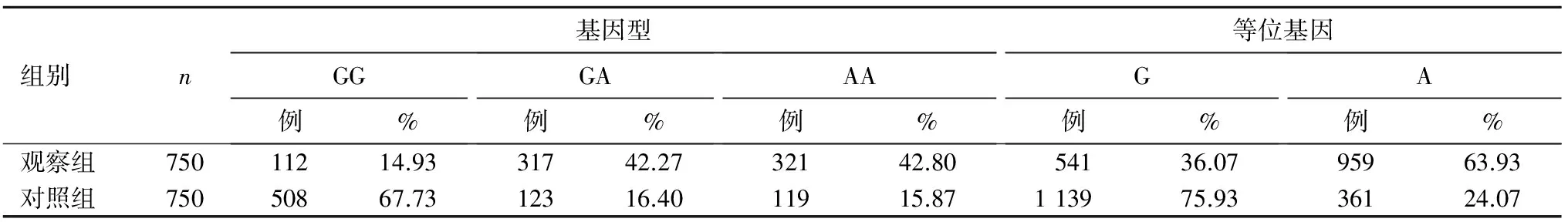
表1 两组TNF-α基因启动子-308G/A基因型、等位基因分布
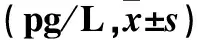
表2 两组不同基因型携带者血浆TNF-α水平比较
注:与同组GG基因型携带者比较,*P<0.05;与对照组比较,△P<0.05。
TNF-α是一种促炎症细胞因子,是机体炎症反应与免疫反应应答的重要调节因子,可使中性粒细胞聚集,产生呼吸爆发、脱颗粒,对淋巴细胞有刺激作用,可上调趋化因子IL-8的表达,IL-8可进一步通过对中性粒细胞的趋化作用,导致肠组织内各种炎症细胞浸润[14,15]。此外,TNF-α可增强干扰素-γ诱导的组织相容性复合物表达,协同IFN -γ改变肠道上皮的屏障功能,还可诱导肠上皮细胞凋亡;在IL-6的参与下,诱导凝血酶形成,使小血管在炎症基础上形成微血栓,导致黏膜微循环障碍;还可激活磷脂酶,继而生成白三烯和氧自由基等[16]。大量研究[17,18]表明,TNF-α在UC中呈高表达并在UC中发挥重要的作用。人类TNF-α基因位于第6条染色体短臂Ⅲ类MHC区域,包括4个外显子和3个内含子,与MHCⅠ类抗原基因的HLA-B相邻,这个区域的差异能决定某些疾病发生的易感素质。
TNF-α基因的单核苷酸多态性多发生在TNF-α基因的启动子区内,目前研究较多的是5′端侧翼序列的启动子-308G/A位点多态性。-308G/A位点多态性有三种基因型,即-308G/A(GG)、-308G/A(GA)和-308G/A(AA),国内外已有研究报道认为-308G/A位点的多态性与多种炎症性、自身免疫性的易感性有关[19,20],但机理还不清楚。相关研究显示,-308G/A处于与转录调控的活化子蛋白-2相结合的共同序列中,A等位基因可增强TNF-α转录6~7倍,并在基因转染中能诱导mRNA的表达。启动子区域G→A的突变使TNF-α基因转录、翻译水平失常,导致TNF-α表达、功能异常[21],增加了炎症相关性疾病发生的危险性。本研究显示,观察组GG、GA、AA基因型频率高于对照组,提示携带-308G/A(GG)、-308G/A(GA)、-308G/A(AA)基因者患UC的风险高。本文结果显示,观察组血浆TNF-α水平高于对照组,提示血浆TNF-α表达和UC的发生密切相关,血浆TNF-α增高可能促进UC的发生发展。本研究还显示,观察组和对照组突变基因型携带者血浆TNF-α表达水平均明显高于同一组野生纯合子基因型携带者,提示-308G/A基因突变可以明显提高血浆TNF-α表达,这可能是血浆TNF-α表达基因突变促进UC发生发展的重要机制;两组三个基因型携带者血浆TNF-α水平比较均有统计学差异,说明-308G/A基因型虽是影响血浆TNF-α表达的重要因素,但不是惟一因素,还有哪些因素影响血浆TNF-α表达水平值得进一步研究。
总之,UC的发生是涉及多种基因相互作用的复杂过程,本研究提示携带TNF-α基因启动子-308G/A突变基因型的个体属UC发生高危险人群,UC诊治方案中应加以重视,虽然尚不能通过改变其易感基因型来防治UC,但可以通过TNF-α基因启动子-308G/A基因检测,预测个体发生UC的风险性,并采取相应的措施如调控基因表达、对可能的危险因素的控制等,以达到有效预防UC的目的。
[1] Al-Rejaie SS, Abuohashish HM, Al-Enazi MM, et al. Protective effect of naringenin on acetic acid-induced ulcerative colitis in rats[J]. World J Gastroenterol, 2013,19(34):5633-5644.
[2] Sakthivel KM, Guruvayoorappan C. Amentoflavone inhibits iNOS, COX-2 expression and modulates cytokine profile, NF-κB signal transduction pathways in rats with ulcerative colitis[J]. Int Immunopharmacol, 2013,17(3):907-916.
[3] Ghoshal UC, Verma A. Biologicals in treatment of acute ulcerative colitis[J]. Trop Gastroenterol, 2015,36(2):80-85.
[4] Ananthakrishnan AN. The exposome in inflammatory bowel disease[J]. Trop Gastroenterol, 2014,35(3):135-140.
[5] Wang XM, Lu Y, Wu LY, et al. Moxibustion inhibits interleukin-12 and tumor necrosis factor alpha and modulates intestinal flora in rat with ulcerative colitis[J]. World J Gastroenterol, 2012,18(46):6819-6828.
[6] Werberich GM, Strava T, Vizioli C, et al. Human papillomavirus-induced cancer: late relapse in a patient treated with tumor necrosis factor-Alpha inhibitor[J]. J Glob Oncol, 2016,3(3):275-277.
[7] Lv R, Qiao W, Wu Z, et al. Tumor necrosis factor alpha blocking agents as treatment for ulcerative colitis intolerant or refractory to conventional medical therapy: a meta-analysis[J]. PLoS One, 2014,9(1):e86692.
[8] Voiosu T, Bengus A, Bǎlǎnescu P, et al. Rapid fecal calprotectin testing predicts mucosal healing better than c-reactive protein and serum tumor necrosis factor α in patients with ulcerative colitis[J]. Rom J Intern Med, 2015,53(3):253-260.
[9] Wang J, He Y, Yang Y, et al. Association between the TNF-αG-308A polymorphism and risk of ischemic heart disease: a meta-analysis[J]. Int J Clin Exp Med, 2015,8(6):8880-8892.
[10] Kotowski M, Bogacz A, Bartkowiak-Wieczorek J, et al. The influence of the tumor necrosis factor-alpa-308G>A polymorphism on the efficacy of immunosuppressive therapy in patients after kidney transplantation[J]. J Physiol Pharmacol, 2016,67(6):819-826.
[11] Tarigan AP, Syafiuddin T, Yunus F, et al.Association of tumor necrosis factor alpha and lymphotoxin alpha gene polymorphisms with the presence of chronic obstructive pulmonary disease[J]. Acta Med Indones, 2015,47(4):283-290.
[12] Jamil K, Jayaraman A, Ahmad J, et al. TNF-alpha -308G/A and -238G/A polymorphisms and its protein network associated with type 2 diabetes mellitus[J]. Saudi J Biol Sci, 2017,24(6):1195-1203.
[13] Talaat RM, Esmail AA, Elwakil R, et al. Tumor necrosis factor-alpha-308G/A polymorphism and risk of hepatocellular carcinoma in hepatitis C virus-infected patients[J]. Chin J Cancer, 2012,31(1):29-35.
[14] Yu K, Li XM, Xu XL, et al. Eupatilin protects against tumor necrosis factor-α-mediated inflammation inhuman umbilical vein endothelial cells[J]. Int J Clin Exp Med, 2015,8(12):22191-22197.
[15] Dong QM, Ling C, Chen X, et al. Inhibition of tumor necrosis factor-α enhances apoptosis induced by nuclear factor-κB inhibition in leukemia cells[J]. Oncol Lett, 2015,10(6):3793-3798.
[16] Babaei M, Dashti N, Lamei N, et al. Evaluation of plasma concentrations of homocysteine, IL-6, TNF-alpha, hs-CRP, and total antioxidant capacity in patients with end-stage renal failure[J]. Acta Me Iran, 2014,52(12):893-898.
[17] Nourian M, Chaleshi V, Pishkar L, et al. Evaluation of tumor necrosis factor (TNF)-α mRNA expression level and the rs1799964 polymorphism of the TNF-α gene in peripheral mononuclear cells of patients with inflammatory bowel diseases[J]. Biomed Rep, 2017,6(6):698-702.
[18] Zhou Z, Dai C, Liu WX. Anti-TNF-A therapy about infliximab and adalimamab for the effectiveness in ulcerative colitis compared with conventional therapy: a meta-analysis[J]. Hepatogastroenterology, 2015,62(140):829-837.
[19] El Sissy MH, El Sissy AH, Elanwary S. Tumor necrosis factor-α -308G/A gene polymorphism in Egyptian children with immune thrombocytopenic purpura[J]. Blood Coagul Fibrinolysis, 2014,25(5):458-463.
[20] Mishra B, Sharma M, Sarkar S, et al. Tumour necrosis factor-alpha promoter polymorphism and its association with viral dilated cardiomyopathy in Indian population: a pilot study[J]. Indian J Med Microbiol, 2015,33(1):16-20.
[21] Yang G, Chen J, Xu F, et al. Association between tumor necrosis factor-α rs1800629 polymorphism and risk of asthma: a meta-analysis[J]. PLoS One, 2014,9(6):e99962.
SinglenucleotidepolymorphismsofTNF-αgenepromoter-308G/Ainpatientswithulcerativecolitis
CHANGTingmin,ZHANGChaoxian,ZHANGLili,LIXiumin
(TheFirstAffiliatedHospitalofXinxiangMedicalUniversity,Weihui453100,China)
ObjectiveTo analyze the single nucleotide polymorphisms of tumor necrosis factor-α (TNF-α) gene promoter-308G/A in patients with ulcerative colitis (UC).MethodsThe single nucleotide polymorphisms of TNF-α gene promoter-308G/A were analyzed in the peripheral blood leukocytes of 750 patients with confirmed UC (observation group) and 750 healthy persons (control group) by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP). The expression of TNF-α in plasma was determined by ELISA.ResultsThe frequencies of GG, GA, AA genotypes and G, A allele in the observation group were 14.93%, 42.27%, 42.80%, 36.07%, and 63.93%, respectively, and 67.73%, 16.40%, 15.87%, 75.93, and 24.07 in the control group, allP<0.05. The levels of TNF-α in the plasma of the observation group and control group were (31.48±11.52) pg/L and (14.82±5.61) pg/L, respectively (P<0.05). The levels of TNF-α in patients with GG, GA and AA genotypes of the observation group were (17.95±7.82), (34.32±0.75), and (34.64±13.83) pg/L, respectively, while those in the control group were (10.63±3.29) and (21.25±10.47), and (21.91±8.51) pg/L, respectively.The differences were significant between patients with GA and AA genotypes and patients with GG genotype in the same group, and between patients with GG, GA and AA genotypes of the two groups (allP<0.05).ConclusionThere is single nucleotide polymorphism of TNF-α gene promoter-308G/A in patients with UC, and GA and AA genotypes are the risk factors for UC, because they can increase the TNF-α expression in plasma.
tumor necrosis factor-α gene promoter-308G/A; single nucleotide polymorphism; ulcerative colitis; tumor necrosis factor-α
10.3969/j.issn.1002-266X.2017.47.006
R574.62
A
1002-266X(2017)47-0020-04
河南省科技厅科技攻关计划(112102310283)。
常廷民(1970-),男,博士,主任医师,主要研究方向为炎症性肠病和消化道肿瘤。E-mail: ctminmail@163.com
李秀敏(1964-),女,博士,主任医师,主要研究方向为炎症性肠病和消化道肿瘤。E-mail: lxm3029981@126.com
2017-07-15)
的标识
为便于文献的统计和期刊评价,确定文献的检索范围,提高检索结果的适用性,每一篇文章或资料应根据其内容性质标识一个文献标志码。文献标志码共设置以下五种:
A:基础性理论与应用研究(应具有创新性研究成果)。
B:应用性技术成果报告(科技)、理论学习与社会实践扎记(社科)。
C:业务指导与技术管理性文章(包括领导讲话、政策性评论、标准技术规范等)。
D:一般动态性信息(通讯、报道、会议活动、专访等)。
E:文件、资料(包括历史资料、统计资料、机构、人物、书刊、知识介绍等)。
不属于上述各类的文章以及文摘、零讯、补白、广告、启事等不加文献标志码。
中文文章的文献标志码以“文献标志码:”作为标志(如:文献标志码: A)。
英文文章的文献标志码以“Document code:”作为标志。
摘自《中国学术期刊(光盘版)检索与评价数据规范》(修订版CAJ-CD B/T 1-2006)

