MSA、CEA、NLR联合检测对小细胞肺癌的诊断及鉴别诊断效能
谭立明,郑葳,付慧颖,蒙仪妹,管晓琳,吴思凡,隆婷婷,王巧花,吴洋,曾婷婷,田永建,余建林,陈娟娟,李华,曹莉萍
(1南昌大学第二附属医院,江西南昌 330006;2南昌大学公共卫生学院)
MSA、CEA、NLR联合检测对小细胞肺癌的诊断及鉴别诊断效能
谭立明1,郑葳2,付慧颖2,蒙仪妹2,管晓琳2,吴思凡2,隆婷婷2,王巧花2,吴洋1,曾婷婷1,田永建1,余建林1,陈娟娟1,李华1,曹莉萍1
(1南昌大学第二附属医院,江西南昌 330006;2南昌大学公共卫生学院)
目的观察血清抗纺锤体抗体(MSA)、癌胚抗原(CEA)及全血中性粒细胞/淋巴细胞(NLR)联合检测对小细胞肺癌(SCLC)的诊断和鉴别诊断效能。方法SCLC患者53例(SCLC组)、肺腺癌(LAC)患者33例(LAC组)、肺鳞癌(LSC)患者29例(LSC组)、胃癌(GC)患者16例(GC组)、肝癌(HC)患者14例(HC组)、大肠癌(IC)患者13例(IC组)、鼻咽癌(NC)患者12例(NC组),另选健康体检者45例(对照组),采用间接免疫荧光法检测血清MSA,化学发光法检测血清CEA,电阻抗法测算全血NLR,分析MSA、CEA、NLR单独和联合检测诊断SCLC的敏感度、特异度。结果与其余组比较,SCLC组血清MSA阳性率高;与SCLC组比较,LAC组血清CEA、全血NLR阳性率高,对照组血清CEA、全血NLR阳性率低;P均<0.05。NLR单独检测诊断SCLC的灵敏度最高(43.40%),MSA单独检测诊断的特异度最高(96.58%)。MSA+CEA+NLR三者联合检测诊断SCLC的敏感度(并联,81.84%)、特异度(串联,100.00%)最高。MSA与CEA一致性较高(κ=0.654);MSA与NLR一致性中等(κ=0.451)。结论血清MSA、CEA及全血NLR联合检测有助于SCLC的诊断和鉴别诊断。
小细胞肺癌;抗纺锤体抗体;癌胚抗原;中性粒细胞;淋巴细胞
全球每年诊断肺癌病例高达180万,其中小细胞肺癌(SCLC)占15%~17%[1],SCLC是一类早期转移播散、侵袭力强、生长迅速的肺癌,多数患者由于前期症状不典型,易延误诊治,导致患者的5年生存率仅为6.4%[2],因此SCLC的早期诊断和治疗十分重要。目前,对SCLC的常规临床诊断方法有影像学、病理学、血清学等,但诊断率均不高。有研究[3]表明,抗纺锤体抗体(MSA)与SCLC有着很高的相关性。癌胚抗原(CEA)检测在临床中已得到广泛应用,其对多种类型的肿瘤病变有较高的诊断价值[4]。中性粒细胞与淋巴细胞比值(NLR)作为反映机体免疫状态和炎症反应程度的常见指标,与肿瘤的发生发展密切相关[5]。本研究对SCLC患者血清MSA、CEA及全血NLR进行检测或测算,并观察三者联合检测对SCLC的诊断和鉴别诊断效能。
1 资料与方法
1.1 临床资料 选取2013年7月~2017年7月南昌大学第二附属医院收治的SCLC患者53例(SCLC组),男38例、女15例,年龄34~79(58.0±9.6)岁,诊断参考美国NCCN的SCLC临床实践指南[6];肺腺癌(LAC)患者33例(LAC组),男27例、女11例,年龄36~78(60.0±11.2)岁;肺鳞癌(LSC)患者29例(LSC组),男21例、女8例,年龄40~81(62.0±6.4)岁;胃癌(GC)患者16例(GC组),男11例、女5例,年龄44~71(63.0±7.8)岁;肝癌(HC)患者14例(HC组),男10例、女4例,年龄38~73(56.0±12.4)岁;大肠癌(IC)患者13例(IC组),男9例、女4例,年龄42~71(57.0±10.2)岁;鼻咽癌(NC)患者12例(NC组),男7例、女5例,年龄39~72(58.0±8.6)岁。另选健康体检者45例(对照组),男21例、女9例,年龄25~69(54.0±10.6)岁。纳入标准:①肺癌患者确诊为原发性肺癌,有明确病理分型;②所有患者诊断明确,病历资料完善;③入选患者无自身免疫性疾病及合并其他癌症;④健康对照者无肿瘤或疑似肿瘤诊断;⑤健康对照者心、肺、肝、肾功能基本正常。符合以上所有条件者予以纳入。排除标准:①非原发性肿瘤或肿瘤诊断不明者;②合并心、肺、肝、肾等疾病者;③有良、恶性肿瘤病史及近期应用化学药物和免疫抑制剂者;④有明确感染证据者;⑤不符合纳入标准者。满足以上任何一条件者即排除。所有入选对象一般资料无统计学差异,具有可比性。所有标本均在患者知情同意条件下获得,并获得南昌大学第二附属医院伦理委员会批准许可。
1.2 血清MSA、CEA检测及全血NLR测算 所有入选对象均采集空腹静脉血标本2份,一份3 mL置于不加抗凝剂的管中,以1 026×g离心15 min后备用(用于检测MSA和CEA);另一份2 mL标本置于EDTA-K2真空管中直接使用(用于检测NLR)。血清MSA检测采用间接免疫荧光法,试剂由德国欧蒙公司提供,MSA抗体采用Hep-20-10细胞株,检测仪器为全自动间接免疫荧光操作一体机,型号Sprinter XL,产自德国欧蒙公司;血清CEA检测采用化学发光法,试剂盒由美国西门子医学诊断产品限公司提供,检测仪器为ADVIA Centaur全自动化学发光免疫分析仪;NLR测算采用电阻抗法,检测仪器为SISMEX全自动血液分析仪(型号:XE-2100),进行全血中性粒细胞计数(N)和淋巴细胞计数(L),通过N与L比值计算出NLR。以上各检测步骤严格按本室SOP操作。
1.3 结果判定标准 MSA阳性判定标准参照说明书,CEA的正常值上限为5 ng/mL,NLR的正常上限值为3.86,检测时指标水平高于正常上限则表明其出现异常判定为阳性。
1.4 统计学方法 采用SPSS22.0统计软件。计数资料以例(%)表示,计量资料数据正态性采用K-S法检验,方差齐性采用Levene′s法检验。组间单因素分析采用χ2检验。阳性率统计依照结果判定标准进行每组计数,计算出阳性比例。对计量资料作受试者特征曲线(ROC),计算ROC曲线下面积(AUC)以及95%置信区间(95%CI)。临床指标评价依据结果判定标准对每组阴性样本和阳性样本进行计数,串联评价(仅在评价指标都呈阳性下判定为阳性);并联评价(评价指标至少满足一项呈阳性即判定为阳性)。CEA、NLR与MSA之间采用一致性分析计算Kappa值。P<0.05为差异有统计学意义。
2 结果
2.1 各组MSA、CEA、NLR阳性率比较 结果见表1。
2.2 MSA、CEA、NLR检测结果ROC曲线分析 以其他癌症组为对照,血清MSA、CEA及全血NLR诊断SCLC的AUC分别为0.783、0.664、0.655,95%CI分别为0.710~0.857、0.579~0.750、0.567~0.742,P均<0.05。

表1 各组MSA、CEA、NLR阳性率比较(%)
注:与其余组比较,*P<0.05;与SCLC组比较,△P<0.05。
2.3 MSA、CEA、NLR单独检测诊断SCLC的敏感度、特异度、阳性似然比、阴性似然比、约登指数 结果见表2。由表2可知,NLR单独检测诊断SCLC的灵敏度最高,MSA的特异度最高。
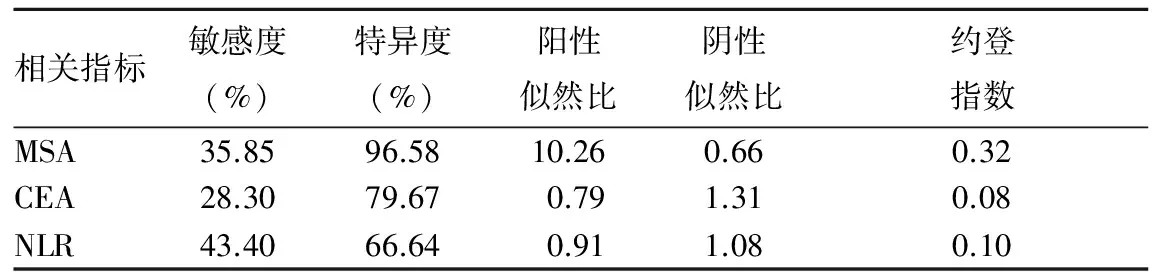
表2 MSA、CEA、NLR单独检测诊断SCLC的敏感度、特异度、阳性似然比、阴性似然比、约登指数
2.4 MSA、CEA、NLR联合检测诊断SCLC的敏感度、特异度 结果见表3。由表3可知,MSA+CEA+NLR三者联合检测诊断SCLC的敏感度(并联,81.84%)、特异度(串联,100.00%)最高。
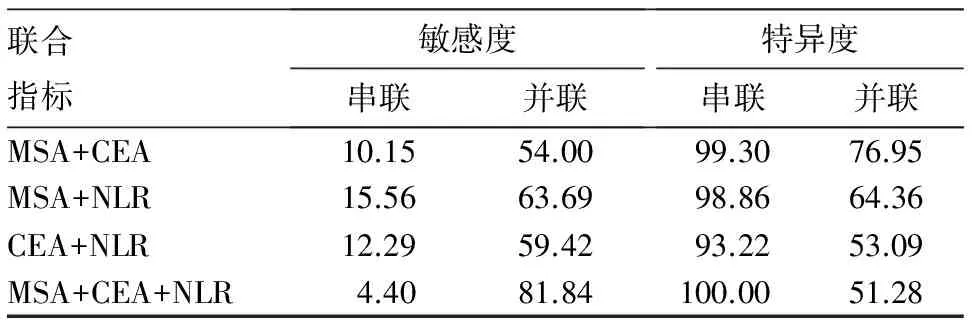
表3 MSA、CEA、NLR联合检测诊断SCLC的敏感度、特异度(%)
2.5 MSA、CEA、NLR检测诊断SCLC的一致性分析结果 SCLC组中MSA、CEA检出率比较有统计学差异(P<0.01),两者有较高的一致性(κ=0.656);MSA、NLR检出率比较有统计学差异(P<0.01),两者有中度一致性(κ=0.451)。
3 讨论
肺癌是世界范围内发病率及病死率最高的恶性肿瘤,SCLC是一种具有神经内分泌特性、恶性程度最高的肺癌,其与一些少见的属于自身免疫性疾病的神经系统副肿瘤综合征有较高的相关性。大部分SCLC患者由于较早出现淋巴转移和血行转移,确诊时病症已处于中晚期,从而失去手术治疗指征,因此SCLC的早期诊断十分重要。研究[7]表明,在一些无自身免疫系统疾病的早期SCLC患者以及将发展为SCLC患者的体内,免疫系统就已表现出症状产生了多种自身抗体,这说明SCLC的发生发展与自身免疫反应中自身抗体的产生有一定联系;而在肿瘤发生发展过程中,这些自身免疫反应往往伴随异常炎症反应,由此提示可对这些自身抗体指标以及炎症反应指标进行检测以便SCLC的早期诊断,如果在未发展为SCLC的时候进行干涉或在早期诊断后进行治疗,将有希望对SCLC治疗方法的改进提供方向,并提高患者诊断率。
研究[8]表明,SCLC的发展与烟草暴露密切相关,烟草烟雾所含的多种致癌物会引起体内关键基因发生突变,从而引发细胞正常生长控制机制失调。真核生物细胞通过有丝分裂增殖,纺锤体微管在分裂过程中有重要作用,研究[9]表明SCLC的高分裂肿瘤细胞纺锤体相关蛋白在分裂期的调节上发生异常改变,以致刺激机体产生特异度自身抗体MSA,在有关学者的临床研究中,SCLC患者中MSA检测特异度达95.19%。作为一种分裂期特异结构自身抗体,MSA影响细胞分裂异常可能是SCLC的发病机制之一,对于SCLC中的早期检测具有一定的临床意义[3]。SCLC患者体内由于自身免疫反应的发生产生了多种自身抗体,这些自身免疫应答过程中往往伴随着炎症反应,而全身炎症反应与肿瘤发生及肿瘤进展关系密切[7]。Balkwill等[10]认为,机体中一些炎症细胞(中性粒细胞、淋巴细胞等)通过释放炎症介质和趋化因子促进肿瘤生长、进展,并抑制宿主的免疫系统,通过减少宿主体内的炎症细胞介质或阻断其作用通路抑制肿瘤的进展。
大量研究[11~13]表明,NLR与多种肿瘤预后关系密切,但有关其在肿瘤早期诊断中的研究少见。中性粒细胞可促进肿瘤生长和转移[14],淋巴细胞的减少可作为机体肿瘤免疫功能低下的反映指标[15]。因此,NLR作为反映肿瘤患者抗肿瘤免疫状态和机体炎性的指标,将其与肿瘤发生过程中自身抗体MSA的水平变化联合监测,可以更好地反映机体免疫状态,从而为判断肿瘤分型以及患病程度提供参考。
CEA为临床检测中常见的原发性肺癌标志物,其司职肿瘤细胞与基质胶原间的黏附反应,对控制肿瘤的生长和浸润转移有重要作用。但单一标志物对SCLC的诊断尚缺乏足够的敏感度,且其在不同病理分型中具有一定的差异性,如在SCLC患者MSA、CEA、NLR三项指标单独检测中,CEA灵敏度最低,仅为28.30%。有研究表明[16],相比单项检测NLR,在肺癌中联合检测CEA和NLR,AUC由0.581上升为0.667,诊断特异度有所提升。研究[17]表明,CEA水平在长期吸烟者体内较正常人高,而SCLC的发生发展与烟草暴露密切相关[7],CEA表达于细胞中,通过影响细胞的增殖、迁移、黏附、极化、凋亡等激活淋巴细胞、转导细胞信号、调节肿瘤细胞生长,与真核生物有丝分裂增殖存在一定联系,这与细胞分裂异常MSA的产生或许存在一定的相关性。
本研究显示,与其余组比较,SCLC组血清MSA阳性率高;与SCLC组比较,LAC组血清CEA、全血NLR阳性率高,对照组血清CEA、全血NLR阳性率低。NLR单独检测诊断SCLC的灵敏度最高,MSA单独检测诊断的特异度最高。MSA+CEA+NLR三者联合检测诊断SCLC的敏感度(并联)、特异度(串联)最高。MSA与CEA一致性较高,MSA与NLR一致性中等。上述结果提示联合检测MSA、CEA、NLR能够弥补单项检测的不足,提高特异度和灵敏度,从而提升对SCLC的诊断价值。
[1] Kahnert K, Kauffmann-Guerrero D, Huber RM. SCLC-state of the art and what does the future have in store[J]. Clin Lung Cancer, 2016,17(5):325-333.
[2] Kazarian M, Laird-Offringa IA. Small-cell lung cancer-associated autoantibodies: potential applications to cancer diagnosis, early detection, and therapy[J]. Mol Cancer, 2011,10(1):33.
[3] 谭立明,张玉红,陈娟娟,等.小细胞性肺癌患者检测抗纺锤体抗体和抗着丝点抗体的临床意义[J].中国免疫学杂志,2017,33(3):418-421.
[4] Zhou ZH. The significance of CA153, CA125 and CEA in the clinical diagnosis of lung cancer[J]. Contemp Med, 2017,23(19):80-81.
[5] Wu G, Yao Y, Bai C, et al. Combination of platelet to lymphocyte ratio and neutrophil to lymphocyte ratio is a useful prognostic factor in advanced non-small cell lung cancer patients[J]. Thorac Cancer, 2015,6(3):275-287.
[6] Kalemkerian GP, Akerley W, Bogner P, et al. Small cell lung cancer:clinical practice guidelines in oncology[J]. Natl Compr CancNetw, 2013,11(1):78-98.
[7] Creaney J, Dick IM, Musk AW, et al. Immune response profiling of malignant pleural mesothelioma for diagnostic and prognostic biomarkers[J]. Biomarkers, 2016,21(6):551-561.
[8] Bakhoum SF, Kabeche L, Murnane JP, et al. DNA-damage response during mitosis induces whole-chromosome missegregation[J]. Cancer Discov, 2014,4(11):1281-1289.
[9] Du J, Du Q, Zhang Y, et al. Expression of cell-cycle regulatory proteins BUBR1, MAD2, Aurora A, cyclin A and cyclin E in invasive ductal breast carcinomas[J]. Histol Histopathol, 2011,26(6):761-768.
[10] Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow[J]. Lancet, 2001,357(9255):539-545.
[11] Arai K, Fukumoto T, Kido M, et al. Preoperative neutrophil-to-lymphocyte ratio as a predictor of survival after reductive surgery plus percutaneous isolated hepatic perfusion for hepatocellular carcinoma: a retrospective analysis[J]. Surg Today, 2017,47(3):385-392.
[12] Tsai PL, Su WJ, Leung WH, et al. Neutrophil-lymphocyte ratio and CEA level as prognostic and predictive factors in colorectal cancer: a systematic review and meta-analysis[J]. J Cancer Res Ther, 2016,12(2):582-589.
[13] Stotz M, Liegl-Atzwanger B, Posch F, et al. Blood-based biomarkers are associated with disease recurrence and survival in gastrointestinal stroma tumor patients after surgical resection[J]. PLoS One, 2016,11(7):e159448.
[14] Kemal Y, Yucel I, Ekiz K, et al. Elevated serum neutrophil to lymphocyte and platelet to lymphocyte ratios could be useful in lung cancer diagnosis[J]. Asian Pac J Cancer Prev, 2014,15(6):2651-2654.
[15] Anguille S, Smits EL, Bryant C, et al. Dendritic cells as pharmacological tools for cancer immunotherapy[J]. Pharmacol Rev, 2015,67(4):731-753.
[16] Yu JH, Zhu XL. ROC curve evaluation of 4 indicators for differential diagnosis of lung cancer[J]. Lab Med Clin, 2017,14(3):361-363.
[17] Liu Y, Li H Q, Luo Y H, et al. The value of combined detection of CEA, NSE and CYFRA21-1 in the early diagnosis of lung cancer[J]. Med Recapit, 2016,22(9):1774-1776.
ApplicationvalueofdetectionofperipheralMSA,CEA,andNLRindiagnosisanddifferentialdiagnosisofsmallcelllungcancer
TANLiming1,ZHENGWei,FUHuiying,MENGYimei,GUANXiaolin,WUSifan,LONGTingting,WANGQiaohua,WUYang,ZENGTingting,TIANYongjian,YUJianlin,CHENJuanjuan,LIHua,CAOLiping
(1TheSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China)
ObjectiveTo observe the application value of detection of serum anti-spindle antibodies (MSA), carcinoembryonic antigen (CEA), whole blood neutrophils/lymphocytes (NLR) in diagnosis and differential diagnosis of small cell lung cancer (SCLC).MethodsFifty-three patients with SCLC (SCLC group), 33 patients with lung adenocarcinoma (LAC) (LAC group), 29 patients with lung squamous cell carcinoma (LSC) (LSC group), 16 patients with gastric carcinoma (GC) (GC group), 14 patients with hepatic carcinoma (HC) (HC group), 13 patients with colorectal cancer (CC) (group CC), 12 patients with nasopharyngeal carcinoma (NC) (NC group), and 45 healthy controls (control group) were selected. Serum MSA was detected by indirect immunofluorescence method. Serum CEA was detected by chemiluminescence. Whole blood NLR was measured by electrical impedance method. The sensitivity and specificity of single and combined detection of serum MSA, CEA and whole blood NLR were analyzed.ResultsCompared with the other groups, the positive rate of serum MSA in the SCLC group was high. Compared with the SCLC group, the positive rates of serum CEA and whole blood NLR in the LAC group were high, while the positive rates of CEA and whole blood NLR in the control group were lower (allP<0.05). The sensitivity of detecting NLR alone in diagnosis of SCLC was the highest (43.40%), while specificity of detecting MSA alone was the highest (96.58%). The sensitivity of combined detection of MSA+CEA+NLR in diagnosis of SCLC was the highest (in parallel, 81.84%), and the specificity was the highest (in series, 100.00%). MSA and CEA had higher consistency (κ=0.654), and MSA was moderately consistent with NLR (κ=0.451).ConclusionThe combined detection of serum MSA, CEA, and whole blood NLR is helpful for the diagnosis and differential diagnosis of SCLC.
small cell lung cancer; anti-spindle antibody; carcinoembryonic antigen; neutrophils; lymphocytes
10.3969/j.issn.1002-266X.2017.47.004
R734.2
A
1002-266X(2017)47-0013-04
江西省科技计划项目(20151BBI90047,20171BAB205076)。
谭立明(1963-),男,教授,主任技师,硕士生导师,主要研究方向为自身免疫病的病因和抗体检测等。E-mail: ndefy84029@ncu.edu.cn
2017-08-27)

