皮下注射重组人生长激素对血管性痴呆大鼠学习记忆能力、空间探索能力的影响及其机制探讨
尹加珍,李蓓华,李国春,张红,黄新武
(1西南医科大学药学院药理教研室,四川泸州 646000;2西南医科大学附属中医医院)
皮下注射重组人生长激素对血管性痴呆大鼠学习记忆能力、空间探索能力的影响及其机制探讨
尹加珍1,2,李蓓华1,李国春2,张红1,黄新武1
(1西南医科大学药学院药理教研室,四川泸州 646000;2西南医科大学附属中医医院)
目的观察重组人生长激素(rhGH)对血管性痴呆(VD)大鼠学习记忆能力、空间探索能力的影响,并探讨其可能机制。方法45只大鼠随机分为实验组、模型组、正常组各15只,其中实验组和模型组通过不同时间点双侧颈总动脉结扎法(结扎左侧颈总动脉3 d后再结扎右侧颈总动脉)制备VD模型,正常组用同样方法分离双侧颈总动脉,但不结扎颈总动脉;造模后第1天开始,实验组大鼠颈部皮下注射rhGH(0.2 IU/100 g),正常组和模型组给予等量生理盐水,1次/d,连续28 d。采用水迷宫实验评价大鼠学习记忆能力及空间探索能力,ELISA法检测血清、皮质、海马中血管内皮生长因子(VEGF)、胰岛素样生长因子1(IGF-1)、生长激素(GH),TUNEL凋亡染色观察神经元凋亡情况[以积分光密度值(IOD值)表示]。结果与正常组比较,实验组第1~4天及模型组第1~6天逃避潜伏期长(P均<0.05);与模型组比较,实验组第2、4、5、6天逃避潜伏期短(P均<0.05)。与模型组比较,实验组、正常组经过平台次数多(P均<0.05)。与模型组比较,实验组血清、皮质、海马中VEGF、IGF-1、GH水平升高(P均<0.05);与正常组比较,模型组血清、皮质、海马中VEGF、IGF-1、GH水平降低(P均<0.05)。与模型组比较,实验组、正常组海马TUNEL凋亡染色IOD值降低(P均<0.05)。结论rhGH可改善VD大鼠学习记忆能力、空间探索能力,其机制可能与其可增加血清、皮质、海马中VEGF和IGF-1水平有关。
血管性痴呆;重组人生长激素;血管内皮生长因子;胰岛素样生长因子
血管性痴呆(VD)是指由各种脑血管疾病导致的脑功能障碍从而产生大脑智能及认知功能障碍的临床综合征[1],诱因以慢性脑缺血最为常见,其主要临床表现为学习及记忆能力的障碍[2]。近年来,随着人口老龄化比率增加,VD发病率日渐增高。据国外资料报道,VD是迄今为止惟一可防治的痴呆,早期干预治疗具有可逆性[3]。目前,关于VD预防的研究取得了很大的进展,但仍缺乏有效的治疗手段和药物,因此探索VD的发病机制以及治疗方法具有重要意义[4,5]。研究[6~8]发现,胰岛素样生长因子1(IGF-1)、血管内皮生长因子(VEGF)对缺血缺氧的病理改变具有重要的作用。重组人生长激素(rhGH)能促进神经修复、神经再生和神经发育,具有强大的神经保护作用[9]。然而,rhGH对VD大鼠的学习记忆是否有改善作用?IGF-1、VEGF与VD之间的关系及rhGH对脑缺血大鼠IGF-1、VEGF有何影响至今未见报到。本研究观察了rhGH对VD大鼠学习记忆能力、空间探索能力的影响,并探讨其可能机制。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠45只,体质量(200±10)g,SPF级,由西南医科大学SPF动物医学实验中心提供。
1.2 药物、试剂、仪器 注射用rhGH购自安徽安科生物工程(集团)股份有限公司。大鼠(Rat)生长激素(GH)ELISA检测试剂盒、大鼠(Rat)VEGF ELISA检测试剂盒、大鼠(Rat)IGF-1 ELISA检测试剂盒购自南京建成生物工程研究所。低温离心机(ST16R)购自赛默飞世尔科技(中国)有限公司,Morris水迷宫购自成都泰盟科技有限公司,SpectraMax®M3多功能酶标仪购自Molecular Devices公司。
1.3 VD模型制备及rhGH给予方法 45只大鼠随机分为实验组、模型组、正常组各15只,其中实验组和模型组通过不同时间点双侧颈总动脉结扎法(结扎左侧颈总动脉3 d后再结扎右侧颈总动脉)制备VD模型[10,11]。正常组用同样方法分离双侧颈总动脉,但不结扎颈总动脉。造模后第1天开始,实验组大鼠颈部皮下注射rhGH(0.2 IU/100 g),正常组和模型组给予等量生理盐水,1次/d,连续28 d。4周后正常组除去死亡的剩余13只,模型组和实验组经过水迷宫筛选出学习记忆能力明显障碍的大鼠,每组13只。
1.4 大鼠学习记忆能力及空间探索能力评价 采用水迷宫实验。Morris水迷宫中加入牛奶使水呈乳白色,水深没过平台约2 cm,水温控制在(26±1)℃。设备固定后不再移动,实验期间实验室的灯光和布置保持不变,尽量排除干扰因素。①定位航行:历时6 d,每次将实验动物分别从4个入水点面朝池壁轻轻放入水中,记录大鼠从入水至找到平台的游泳轨迹及逃避潜伏期。每次时间为120 s,如果120 s内未找到平台,则由实验者用手牵引其至平台上停留20 s,并记录潜伏期为120 s,每次实验后用干毛巾将大鼠擦干放入笼中。2次/d,连续6 d,计算平均成绩,此时的逃避潜伏期作为评价大鼠学习记忆能力的指标。②空间探索:在定位航行实验后,撤去平台,选择离原平台所在处最远的象限为入水点将大鼠放入水中,记录其在120 s内游泳经过原平台所在处的次数,将其作为评价大鼠空间探索能力的指标。
1.5 大鼠血清和脑组织VEGF、IGF-1、GH检测 实验结束后,禁食12 h,禁水4 h。各组大鼠随机取8只,称重,腹腔注射3%戊巴比妥钠(0.15 mL/100 g)麻醉,腹主动脉取血,加入含抗凝剂的真空采血管中,室温放至凝固,在4 ℃条件下以3 000 r/min离心10 min,分离血清,分装于EP管中,-80 ℃保存,测定前室温下复苏。大鼠取血后,断头取脑,立即分离大鼠的皮质和海马,称重,分别按组织重量(g)∶生理盐水(mL)=1∶10的比例制作10%匀浆,4 ℃条件下以3 000 r/min离心10 min,弃去沉淀,取其清液,分装,-80 ℃保存。 采用ELISA双抗体夹心法的原理,往预先包被VEGF、IGF-1、GH抗体的包被微孔中,依次加入待测样本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和待测样本中VEGF、IGF-1、GH呈正相关。用酶标仪在450 nm波长下测定吸光度值(OD值),并将其在标准曲线下换算成浓度。
1.6 大鼠海马神经元TUNEL凋亡染色IOD值测算 各组另取5只大鼠,取脑组织包埋切片,进行TUNEL凋亡染色,观察神经元凋亡情况。按照试剂盒说明书步骤进行染色。切片脱蜡及水合后滴加蛋白酶K工作液,滴加50 μL的TUNEL反应液(TdT酶溶液与Dutp标记液按照1∶9比例混合)于37 ℃湿盒中60 min、PBS漂洗、加POD转化剂50 μL于25 ℃湿盒10 min、PBS漂洗、DAB显色,镜下控制、苏木素复染,梯度酒精脱水,透明,封片。各组大鼠脑组织进行连续切片,每个脑组织均匀间隔选取5张进行染色,在10×40倍镜下于海马CA1区随机选取3个视野,采用IPP图像处理软件,测量积分光密度值(IOD值),取平均值作为每张切片的IOD值。

2 结果
2.1 各组大鼠定位航行实验逃避潜伏期比较 结果见表1。
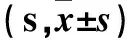
表1 各组大鼠逃避潜伏期比较
注:与正常组比较,★P<0.05;与模型组比较,▲P<0.05。
2.2 各组大鼠空间探索实验经过平台次数比较 实验组、模型组、正常组经过平台次数分别为(3.14±1.50)、(1.32±1.19)、(5.87±3.27)次,模型组与正常组比较,实验组与模型组比较,P均<0.05。
2.3 各组大鼠血清VEGF、IGF-1、GH水平比较 结果见表2。

表2 各组大鼠血清VEGF、IGF-1、GH水平比较
注:与模型组比较,▲P<0.05;与正常组比较,★P<0.05。
2.4 各组大鼠皮质和海马VEGF、IGF-1、GH表达比较 结果见表3。

表3 各组大鼠皮质和海马VEGF、IGF-1、GH表达比较
注:与模型组比较,▲P<0.05;与正常组比较,★P<0.05。
2.5 各组大鼠海马TUNEL凋亡染色IOD值比较 实验组、模型组、正常组海马TUNEL凋亡染色IOD值分别为165.30±16.51、275.02±20.60、75.99±4.95,实验组、正常组分别与模型组比较,P均<0.05。
3 讨论
VD是各种脑血管疾病导致的脑功能受损,诱因以慢性脑缺血最为常见,其主要临床表现为学习与记忆能力障碍。研究[12]表明,中国60岁及以上的老年人中,VD患病率高达1.1%。目前,临床常采取活血化淤等药物改善VD患者血液循环,拟胆碱药物改善患者学习记忆能力[13,14],但效果不是特别理想。
rhGH是由基因工程合成具有与人体内源性生长激素相同结构的蛋白质类激素,与内源性生长激素具有同等的作用,有促进内皮细胞增殖、抑制缺氧导致的内皮细胞凋亡、神经保护等作用[9]。刘海涛等[15]应用线栓法制作大鼠脑缺血/再灌注损伤模型,给予rhGH干预,并在干预后的7、14、21 d运用免疫组化法测定凋亡细胞和Nestin表达,发现神经元凋亡数较对照组明显减少,Nestin的表达显著增加,说明rhGH可抑制缺血性脑损伤后细胞的凋亡,促进神经细胞和神经干细胞增殖,从而减少神经元损伤和促进神经元修复。研究发现,腹腔注射rhGH能减小大脑中动脉供血区缺血梗死模型大鼠脑组织含水量、梗死体积,两者均明显低于缺血组。张晔等[16]采用线栓法制备SD大鼠大脑永久性闭塞模型,皮下注射rhGH后观察到大鼠脑缺血致脑梗死面积差异和神经能力恢复情况,提示rhGH能显著减小大鼠持续性脑缺血后的脑梗死面积,对大鼠神经功能的恢复有明显改善。本研究显示,与模型组比较,实验组逃避潜伏期短,穿过平台的次数多,海马CA1区凋亡神经元数量减少,说明rhGH可以显著改善VD大鼠的学习记忆能力和空间探索能力。
生长激素(GH)是由垂体前叶嗜酸细胞所分泌的非糖基化蛋白,主要功能是促进肌肉组织蛋白质合成,增加肌肉体积和肌肉力量,促进机体的生长,GH可以促进神经修复、神经再生和神经发育,具有强大的神经保护作用。VEGF通过作用于血管内皮细胞,促进血管生成,增加血管密度,改善缺血区的血液循环,改善神经系统的功能[17]。GH直接或间接地通过IGF-1来发挥作用。正常情况下,GH通过肝脏受体促进肝脏IGF-1基因的表达,从而促进IGF-1的合成和释放,血清中IGF-1通过反馈调节抑制垂体释放GH,使得血液中GH和IGF-1处于平衡状态[18]。局灶性脑缺血大鼠侧脑室注射IGF-1,发现脑组织VEGF蛋白、mRNA表达增加,缺血性脑组织的病理损伤减轻,提示GH促进IGF-1合成的同时,可以间接增加VEGF水平[19]。VD患者GH的分泌受到抑制,众多实验表明VD的发生发展与IGF-1、VEGF有紧密的联系。本研究发现,实验组血清、皮质、海马中VEGF、IGF-1、GH水平均高于模型组。表明rhGH可能通过增加VD大鼠IGF-1和VEGF的水平从来减少神经元凋亡,提高学习记忆能力,改善其认知功能障碍。
[1] 张允岭,梅建勋,谢颖桢,等.老年期血管性痴呆分期分证探讨[J].中医杂志,2008,49(2):173-175.
[2] 张岗,王发渭.血管性痴呆的中医临床研究新进展[J].时珍国医国药,2010,21(3):769-771.
[3] Gorelick PB. Status of risk factors for dementia associated with stroke[J].Stroke, 1997,28(2):459-463.
[4] He Z, Pan Z, Lu W. Neuroprotective effects of tanshinone Ⅱ A on vascular dementia in rats[J]. Zhongguo Zhong Yao Za Zhi, 2010,35(14):1883-1886.
[5] 肖迎春,刘楠,周宜灿,等.文拉法辛对血管性痴呆模型大鼠学习记忆功能的影响[J].中华老年医学杂志,2012,31(11):1027-1030.
[6] Lin S, Fan LW, Pang Y, et al. IGF-1 protects oligodendrocyte progenitor cells and improves neurological functions following cerebral hypoxia-ischemia in the neonatal rat[J]. Brain Research, 2005,1063(1):15-26.
[7] 黄体秀,张红.鼠神经生长因子治疗新生儿缺氧缺血性脑病的临床疗效及神经保护作用[J].河北医学,2014,20(12):1956-1958.
[8] 廖德荣,刘启功,程燕子,等.血管内皮生长因子拮抗缺氧诱导的血管内皮细胞凋亡及其机制研究[J].中国现代医学杂志,2007,17(22):2732-2735.
[9] 孙晓静,张皓.生长激素在神经系统疾病治疗中的作用[J].中国康复理论与实践,2015,21(1):54-57.
[10] 黄新武,李华,秦大莲,等.不同时点分别结扎左、右颈总动脉建立大鼠血管性痴呆模型[J].中国老年学杂志,2010,30(14):2006-2007.
[11] 任莹,刘静,申秀萍,等.不同亚型血管性痴呆的动物模型研究进展[J].山东医药,2012,52(35):97-99.
[12] 刘伯源,王久玲,肖义泽.中国60岁及以上人群老年期痴呆患病率Meta分析[J].中华流行病学杂志,2016,37(11):1541-1545.
[13] Zhang LD, Gong XJ, HU MM, et al. Anti-vascular dementia effect of gastrodin and its mechanism of action[J].Chin J Nat Med, 2008,6(2):130-134.
[14] 于飞,孙永馨.血管性痴呆大鼠模型的治疗方法研究进展[J].中国比较医学杂志,2014,19(9):66-71.
[15] 刘海涛,白宏英,曾志磊,等.重组人生长激素对脑缺血/再灌注损伤细胞凋亡及Nestin表达的影响[J].中国实用神经疾病杂志,2010,13(1):39-41.
[16] 张晔,王旭开,杨成明,等.重组人生长激素对AMI大鼠缺血心肌VEGF表达的影响及其生物学效应[J].第三军医大学学报,2004,26(13):1148-1151.
[17] Zimmerman MW, McQueeney KE, Isenberg JS, et al. PTP4A3 phosphatase promotes VEGF signaling and enables endothelial cell motility[J]. J Biol Chem, 2014,289(9):5904-5913.
[18] 上官芳芳,施建农.生长激素/IGF-1对认知功能的影响[J].中国心理卫生杂志,2007,21(8):568-570.
[19] Wang Y, Kilic E, Kilic U, et al. VEGF overexpression induces post-ischaemic neuroprotection, but facilitates haemodynamic steal phenomena[J]. Brain, 2005,128(Pt 1):52-63.
Effectsofsubcutaneousinjectionofrecombinanthumangrowthhormoneonabilityoflearning,memory,andspatialexplorationofratswithvasculardementia
YINJiazhen1,LIBeihua,LIGuochun,ZHANGHong,HUANGXinwu
(1SchoolofPharmacy,SouthwestMedicalUniversity,Luzhou646000,China)
ObjectiveTo observe the effects of recombinant human growth hormone (rhGH) on the ability of learning, memory and space exploration of rats with vascular dementia (VD) and to explore its possible mechanism.MethodsForty-five rats were randomly divided into three groups: the experimental group, model group, and normal group, with 15 rats in each. The VD model was prepared in the experimental group and the model group through bilateral carotid artery ligation at different time points (we ligated the right carotid artery three days after the left carotid artery was ligated). The normal group used the same method to separate the bilateral carotid arteries, but we did not ligate the common carotid artery. At the beginning of the first day after modeling, rhGH (0.2 IU/100 g) was injected into the neck of the rats in the experimental group, while rats of the normal group and model group were given the same amount of normal sodium once a day for 28 days. Water maze test was used to assess the ability of learning and memory and space exploration of rats. ELISA was used to detect the levels of vascular endothelial growth factor (VEGF), insulin-like growth factor 1 (IGF-1) and growth hormone (GH) in the serum, cortex, and hippocampus. TUNEL apoptosis staining was used to observe the status of neuronal apoptosis (IOD value).ResultsCompared with the normal group, the experimental group from the first to the fourth day and the model group from the first to the sixth day had longer escape latency (P<0.05). Compared with the model group, the experimental group had shorter escape latency on the 2nd, 4th, 5th, and 6th days (P<0.05). Compared with the model group, the experimental group and the normal group passed the platforms more (P<0.05). Compared with model group, the levels of VEGF, IGF-1, and GH in the serum, cortex, and hippocampus of the experimental group increased (allP<0.05). Compared with the normal group, the levels of VEGF, IGF-1, and GH in the serum, cortex, and hippocampus of the model group decreased (allP<0.05). Compared with the model group, the IOD value of TUNEL apoptosis staining in the hippocampus of the experimental group and the normal group decreased (P<0.05).ConclusionThe rhGH can improve the ability of learning, memory, and space exploration in VD rats by increasing the VEGF and IGF-1 levels in the serum, cortex, and hippocampus.
vascular dementia; recombinant human growth hormone; vascular endothelial growth factor; insulin-like growth factor
10.3969/j.issn.1002-266X.2017.47.007
R743
A
1002-266X(2017)47-0024-04
四川省教育厅课题(13ZB0266)。
尹加珍(1989-),女,硕士,药师,主要研究方向为神经药理学。E-mail: 422390158@qq.com
黄新武(1972-),男,硕士,副教授,硕士生导师,主要研究方向为神经药理学。E-mail: hxw-lgc@163.com
2017-08-08)

