替莫唑胺对人脑胶质瘤细胞U251增殖、凋亡的影响及其机制探讨
张永森,杨利敏,杨卫泷,吕林亚,王玉峰
(1新乡医学院第三附属医院,河南新乡 453003;2新乡医学院药学院)
替莫唑胺对人脑胶质瘤细胞U251增殖、凋亡的影响及其机制探讨
张永森1,杨利敏2,杨卫泷1,吕林亚1,王玉峰1
(1新乡医学院第三附属医院,河南新乡 453003;2新乡医学院药学院)
目的观察替莫唑胺对人脑胶质瘤细胞U251增殖、凋亡的影响,并探讨其可能机制。方法取对数生长期U251细胞,分别加入0.02、0.06、0.1 g/L替莫唑胺,空白对照组不加替莫唑胺,分别培养24、48、72 h,MTT实验观察细胞增殖情况;取对数生长期U251细胞,加入0.06 g/L替莫唑胺(0.06 g/L替莫唑胺组),细胞培养48 h 后,用流式细胞技术测算细胞凋亡率,RT-PCR法、Western blotting法检测存活素(Survivin)mRNA、蛋白。结果随着替莫唑胺浓度增加及作用时间延长,U251细胞增殖抑制率越高。0.06 g/L替莫唑胺组细胞凋亡率为22.6%±2.3%,对照组为3.3%±1.1%,两组比较,P<0.05;0.06 g/L替莫唑胺组Survivin mRNA相对表达量为0.65±0.11,对照组为0.96±0.15,两组比较,P<0.05;0.06 g/L替莫唑胺组Survivin蛋白相对表达量为0.25±0.03,对照组为0.49±0.04,两组比较,P<0.05。结论替莫唑胺能有效抑制U251细胞增殖,诱导细胞凋亡,其机制可能与抑制Survivin表达有关。
替莫唑胺;人脑胶质瘤细胞U251;细胞增殖;细胞凋亡;存活素
脑胶质瘤是神经系统肿瘤的主要类型之一[1],恶性程度极高。目前,临床外科手术无法有效抑制脑胶质瘤细胞的增殖[2],而且多数脑胶质瘤对放化疗不敏感。文献[3~5]表明,三维适形放疗联合替莫唑胺能提高脑胶质瘤患者术后总体生存时间及无进展生存时间。替莫唑胺是一种口服烷化剂抗肿瘤药,能够通过失活O6-甲基鸟嘌呤-DNA烷基转移酶使DNA无法正常进行配对从而杀伤胶质瘤细胞[6,7]。存活素(Survivin)是凋亡抑制蛋白IAP家族中的一个蛋白[8],被认为是肿瘤特异性凋亡抑制因子。本研究观察了替莫唑胺对人脑胶质瘤U251细胞增殖、凋亡的影响,并探讨其可能机制。
1 材料与方法
1.1 药品、细胞及试剂 替莫唑胺由江苏天士力帝益药业有限公司提供。U251细胞由上海晶抗U251细胞专业研发公司提供。DMEM高糖培养基、特级胎牛血清购自上海诗溪化工科技有限公司,Annexin V-PE/7-AAD凋亡试剂盒购自上海研谨生物科技有限公司,RNA裂解液、逆转录试剂盒、DNA聚合酶及扩增引物、兔抗人Survivin单克隆抗体分别由TaKaRa公司、美国Abgent公司提供。
1.2 细胞培养 将U251细胞培养于含10%胎牛血清的DMEM高糖培养基(100 U/mL青霉素+100 μg/mL链霉素)[9]。培养条件为37 ℃、5%CO2、饱和湿度。倒置显微镜下监测细胞生长,当生长至铺满瓶底的70%~80%时,加入0.25%胰蛋白酶消化后进行传代,在液氮条件下冻存。选择对数生长期的细胞用于以下实验。
1.3 细胞增殖抑制率测算 取对数生长期U251细胞,以0.25%的胰酶消化,以1 000 r/min离心5 min,倾去消化液,接种于96孔板(5×104个/mL),每个孔加入100 μL培养液制成细胞悬液,后补充培养液至每孔体积达200 μL,放至孵箱内继续培养。24 h后当观察到细胞贴壁时倒掉旧培养液,并加入0.02、0.06、0.1 g/L替莫唑胺(实验组)。加入药物后分别于不同时间(24、48、72 h)停止培养,加入20 μL 5 mg/mL的MTT溶液,在培养箱内继续孵育4 h后终止培养。另设对照组(不加入药物)。然后进行MTT比色试验[5],492 nm波长检测每孔吸光度值(OD492)。细胞增殖抑制率(%)=(1-实验组OD492平均值/对照组OD492平均值)×100%。
1.4 细胞凋亡率测算 将U251细胞接种于6孔板中(5×105个/mL),加入0.06 g/L替莫唑胺处理(0.06 g/L替莫唑胺组),48 h后收集细胞,另设对照组(不加入药物)。细胞离心后加入冷磷酸缓冲盐溶液使细胞悬浮,再次离心,将所得细胞重悬于200 μL的结合缓冲液中,加入1 μL Annexin V-PE和5 μL 7-ADD于细胞悬液中混匀[5],室温闭光10 min,加入300 μL结合缓冲液。采用流式分析软件cellquest 计算细胞凋亡率。
1.5 细胞Survivin mRNA检测 采用RT-PCR法。用0.06 g/L替莫唑胺处理U251细胞(0.06 g/L替莫唑胺组),48 h后收集细胞,另设对照组(不加入药物)。TRIzol法提取细胞总RNA并将其反转录为cDNA。扩增引物:Survivin:5′-TTCAATCCATCAAAGCTACTACA-3′,Reverse:5′-CAGAGAAAGTTGAACTCTGTTGGATTC-3′,481 bp;β-actin:5′-CGCTGCGCTGGTCGTCGACA-3′,5′-GTCACGCACGATTTC-CCGCT-3′,370 bp。扩增条件[10]:先在95 ℃ 预变性5 min,后在该温度基础上依次下调37、17 ℃(即58、72 ℃),分别加热30~45 s,即95、58、72 ℃下分别加热30、30、45 s,共进行循环30次,最后在72 ℃下延伸10 min。采用PCR仪自动程序,运用2-ΔΔCt法计算基因的表达水平。
1.6 细胞Survivin蛋白检测 采用Western blotting法。用0.06 g/L替莫唑胺处理U251细胞(0.06 g/L替莫唑胺组),48 h后收集细胞,另设对照组(不加入药物)。采用RIPA细胞裂解液裂解细胞,提取出总蛋白后应用蛋白定量BCA法测蛋白浓度。取其中35 μg蛋白样品进行SDS-聚丙烯酰胺凝胶电泳。以聚偏氟乙烯膜转膜,待封闭后加入1∶1 000的Survivin抗体,在4 ℃下留置一夜。次日加入辣根过氧化物酶标记的二抗并在37 ℃下孵育1 h,后采用ECL化学发光剂显影[6],以内参为β-actin,将目的蛋白与内参比值作为目的蛋白表达相对水平。

2 结果
2.1 各组不同时间细胞增殖抑制率比较 结果见表1。由表1可知,随着替莫唑胺浓度增加及作用时间延长,U251细胞增殖抑制率越高。
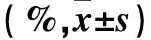
表1 不同时间实验组细胞增殖抑制率比较
注:与对照组比较,*P<0.05。
2.2 两组细胞凋亡率比较 0.06 g/L替莫唑胺组细胞凋亡率为22.6%±2.3%,对照组为3.3%±1.1%,两组比较,P<0.05。
2.3 两组细胞Survivin mRNA相对表达量比较 0.06 g/L替莫唑胺组Survivin mRNA相对表达量为0.65±0.11,对照组为0.96±0.15,两组比较,P<0.05。
2.4 两组细胞Survivin蛋白相对表达量比较 0.06 g/L替莫唑胺组Survivin蛋白相对表达量为0.25±0.03,对照组为0.49±0.04,两组比较,P<0.05。
3 讨论
神经胶质瘤是常见的颅内原发性恶性肿瘤[11]。目前,手术是挽救神经胶质瘤患者生命及延长其生存期的主要方式,但因该肿瘤恶性程度高,呈现浸润生长,常规手术不能起到彻底清除病灶的作用,因此化疗在延长胶质瘤等[12]恶性肿瘤患者生存期方面发挥重要作用。研究发现,肿瘤内的无血管区域能够阻止药物渗透到肿瘤的中心部位。
替莫唑胺是一种含有咪唑四嗪环的烷化剂类抗肿瘤前体药物[13]。替莫唑胺口服后可快速吸收,不需要经过肝脏代谢,生物利用度接近100%,此外其在血脑屏障中穿透力强,便于在颅内发挥细胞毒作用。文献[14]报道,替莫唑胺可以用于治疗成人顽固性多形性成胶质细胞瘤。本研究显示,替莫唑胺能有效抑制U251细胞增殖,并且莫唑胺浓度(40~80 μmol/L )越高,作用时间越长(24~72 h),U251细胞存活率越低。在脑胶质瘤等[15]恶性肿瘤的发病过程中,几乎都存在细胞凋亡异常。文献[16]表明,替莫唑胺能有效降低U251细胞及其干细胞中livin基因的表达,并促进细胞凋亡。本实验观察了替莫唑胺对U251细胞凋亡的影响,结果显示U251细胞经替莫唑胺干预后出现凋亡,且凋亡率明显高于对照组。证实替莫唑胺可以诱导U251细胞凋亡。
多数研究[17,18]认为,凋亡抑制基因和凋亡活化基因之间的平衡是导致细胞凋亡异常被打破的主要原因。Survivin是迄今为止发现的凋亡抑制因子中最强效因子[19],其表达产物Survivin为IAP家族新成员,Survivin C′端富含独特的疏水基团,形成的卷曲螺旋后有利于Survivin和纺锤体微管的微管蛋白结合,进而发挥抑制细胞凋亡和调节有丝分裂的双重作用,在包括脑胶质瘤[20]在内的绝大多数肿瘤的发生发展中具有重要意义。本文结果显示,替莫唑胺组Survivinm RNA、蛋白相对表达量均低于对照组。提示替莫唑胺可能通过抑制Survivin的表达起到抑制细胞增殖、诱导细胞凋亡的作用。
总之,替莫唑胺能够有效抑制U251细胞增殖,诱导U251细胞凋亡,这可能与抑制Survivin表达有关。
[1] Ostrom QT, Gittleman H, Stetson L, et al. Epidemiology of gliomas[J]. Cancer Treat Res, 2015,163:1-14.
[2] Pitskhelauri DI, Bykanov AE, Zhukov VY, et al. Review of surgical treatment of insular gliomas: challenges and opportunities[J]. Zh Vopr Neirokhir Im N N Burdenko, 2015,79(2):111-116.
[3] 黄仁华,侯艳丽,徐欣,等.脑胶质瘤术后三维适形放疗联合替莫唑胺疗效分析[J].肿瘤学杂志,2015,21(3):219-222.
[4] 段友强,张辉,刘义锋,等.替莫唑胺通过 Notch1 信号通路对胶质瘤干细胞分化、增殖、凋亡影响的研究[J].中国地方病防治杂志,2016,31(12):1330-1331.
[5] 李根华,张浩,刘阳,等.替莫唑胺对U251干细胞细胞周期及细胞增殖的影响[J].济宁医学院学报,2013,36(3):166-170.
[6] 李新茂,魏志玄,张婷,等.miR-145联合替莫唑胺对U251胶质瘤细胞恶性行为的影响[J].实用医学杂志,2016,32(3):371-375.
[7] 张文学,孙健,曹永珍,等.采用不同边界适形调强放疗结合替莫唑胺化疗治疗恶性胶质瘤的近期疗效观察[J].中华医学杂志,2015,95(31):2522-2525.
[8] Altieri DC. Survivin-the inconvenient IAP[J]. Semin Cell Dev Biol, 2015,39:91-96.
[9] 黄宁,程远.吲哚美辛增强阿霉素对胶质瘤U251细胞毒性的研究[J].中国细胞生物学学报,2013,35(5):649-654.
[10] 周任,张龙洲,王睿智.塞来昔布对胶质瘤U251细胞增殖、凋亡和Survivin表达的影响[J].癌症,2010,29(3):316-322.
[11] Wang X, Jia L, Jin X, et al. NF-κB inhibitor reverses temozolomide resistance in human glioma TR/U251 cells[J]. Oncol Lett, 2015,9(6):2586-2590.
[12] Zhou D, Wan Y, Xie D, et al. DNMT1 mediates chemosensitivity by reducing methylation of miRNA-20a promoter in glioma cells[J]. Exp Mol Med, 2015,47:e182.
[13] Li G, Zhang H, Liu Y, et al. Effect of temozolomide on livin and caspase-3 in U251 glioma stem cells[J]. Exp Ther Med, 2015,9(3):744-750.
[14] Pérès EA, Gérault AN, Valable S, et al. Silencing erythropoietin receptor on glioma cells reinforces efficacy of temozolomide and X-rays through senescence and mitotic catastrophe[J]. Oncotarget, 2015,6(4):2101-2119.
[15] Albesiano E, Han JE, Lim M. Mechanisms of local immunoresistance in glioma[J]. Neurosurg Clin N Am, 2010,21(1):17-29.
[16] 李根华,冯嵩,刘阳,等.替莫唑胺对胶质瘤干细胞抗凋亡与多重耐药基因及细胞周期的影响[J].中华神经外科杂志,2015,31(7):727-731.
[17] Tabatabai G, Tonn JC, Stupp R, et al. The role of integrins in glioma biology and anti-glioma therapies[J]. Curr Pharm Des, 2011,17(23):2402-2410.
[18] 袁玉梅,楼亚玲.羟基红花黄色素A对胶质瘤U251细胞增殖、迁移与侵袭的影响[J].中国医药导报,2016,13(27):15-18.
[19] Premkumar DR, Jane EP, Foster KA, et al. Survivin inhibitor YM-155 sensitizes tumor necrosis factor-related apoptosis-inducing ligand-resistant glioma cells to apoptosis through Mcl-1 downregulation and by engaging the mitochondrial death pathway[J]. J Pharmacol Exp Ther, 2013,346(2):201-210.
[20] Uematsu M, Ohsawa I, Aokage T, et al. Prognostic significance of the immunohistochemical index of survivin in glioma: a comparative study with the MIB-1 index[J]. J Neurooncol, 2005,72(3):231-238.
EffectsoftemozolomideonproliferationandapoptosisofhumangliomacellsU251
ZHANGYongsen1,YANGLimin,YANGWeilong,LYULinya,WANGYufeng
(1TheThirdAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang453003,China)
ObjectiveTo observe the effects of temozolomide on the proliferation and apoptosis of human glioma cells U251 and to explore its possible mechanism.MethodsU251 cells in the logarithmic growth phase were selected and then were added with 0.02、0.06、0.1 g/L temozolomide, but the cells in the blank control group were not given. These cells were cultured for 24, 48 and 72 h, respectively. MTT was applied to observe the cell proliferation. U251 cells in the logarithmic growth phase were selected, and then were added with 0.06 g/L temozolomide (as the 0.06 g/L temozolomide group). After U251 cells were cultured for 48 h with different concentrations of temozolomide, flow cytometry was used to determine the apoptosis rate, and RT-PCR and Western blotting were used to detect the expression level of survivin mRNA.ResultsThe cellular proliferation inhibition rate of U251 cells increased over the time and the increased concentrations of temozolomide. The apoptosis rates of the 0.06 g/L temozolomide group and the control group were 22.6%±2.3% and 3.3%±1.1%, respectively; the relative expression of survivin mRNA was 0.65±0.11 in the 0.06 g/L temozolomide group, and was 0.96±0.15 in the control group; the expression of survivin protein was 0.25±0.03 in the 0.06 g/L temozolomide group, and was 0.49±0.04 in the control group; the differences were significant between these two groups, allP<0.05.ConclusionTemozolomide can effectively inhibit the proliferation of U251 cells and induce the apoptosis by inhibiting the survivin expression.
temozolomide; human glioma cells U251; cell proliferation; apoptosis; survivin
10.3969/j.issn.1002-266X.2017.47.005
R651.1
A
1002-266X(2017)47-0017-03
张永森(1981-),男,学士,主治医师,主要研究方向为脑血管病及颅底。E-mail: hnzhangyongsen@126.com
2017-08-30)

