初发骨髓增生异常综合征患者血清铁蛋白水平变化及意义
刘超,秦浩人,冀虹霞,刘姚姚,杨向东
(1天津中医药大学,天津 300110;2天津中医药大学第一附属医院)
初发骨髓增生异常综合征患者血清铁蛋白水平变化及意义
刘超1,秦浩人1,冀虹霞1,刘姚姚1,杨向东2
(1天津中医药大学,天津 300110;2天津中医药大学第一附属医院)
目的探讨初发骨髓增生异常综合征(MDS)患者血清铁蛋白(SF)水平变化及临床意义。方法选取初发MDS患者50例,其中RA型6例、RARS型4例、RCMD型20例、RAEB-1型13例、RAEB-2型7例,极低危3例、低危8例、中危20例、高危15例、极高危4例。患者分别于输血前及累计输注红细胞达10、20、30 U时取血,采用放射免疫法检测血清SF水平,计算SF变化量(SFΔ);分析血清SFΔ与患者输血量、临床分型、危险分层的关系。输注红细胞达30 U时,将患者分为SFΔ≥2 000 ng/mL组和<2 000 ng/mL组,比较两组预后。结果输血前RARS、RAEB-1、RAEB-2型患者血清SF水平均高于RA、RCMD型患者(P均<0.05),高危、极高危患者均高于极低危、低危及中危患者(P均<0.05)。RAEB-1、RAEB-2型患者在输注红细胞量为20、30 U时血清SFΔ均低于其他各型(P均<0.05)。高危、极高危患者输注红细胞达30 U时血清SFΔ均低于其他危险度患者(P均<0.05)。两组均随访至2016年6月,输注红细胞达30 U时SFΔ≥2 000 ng/mL组的MDS/急性髓系白血病(AML)转化率低于SFΔ<2 000 ng/mL组(P<0.01),中位总体生存时间长于SFΔ<2 000 ng/mL组(P<0.01)。结论初发RARS、REAB-1、RAEB-2型及高危、极高危MDS患者血清SF水平均高于其他分型及危险度者;随着输血量的增加,RAEB-1、RAEB-2型及高危、极高危患者铁过载程度均高于其他分型及危险度者;血清SF水平变化对MDS患者预后有一定的预测作用。
骨髓增生异常综合征;铁蛋白,变化量;输血;急性髓系白血病
贫血是骨髓增生异常综合征(MDS)患者的主要症状,输血是其必要的支持治疗方法。铁蛋白(SF)是铁代谢的重要指标之一,可用于判断机体是否缺铁或铁负荷过量,也可作为部分血液系统疾病患者预后的评价指标[1]。临床发现,随着输血量的增加,不同亚型、不同危度分层MDS患者血清SF水平差异较大,患者预后亦存在较大不同,但研究结论不完全相同[2~4]。本研究探讨MDS患者血清SF水平变化及临床意义。
1 临床资料
1.1 基本资料 收集2010年6月~2016年6月天津中医药大学第一附属医院收治的初发MDS患者50例,男35例、女15例,年龄45~70岁、平均61岁;参照2008年WHO诊断分型标准分为RA型6例,RARS型4例,RCMD型20例,RAEB-1型13例,RAEB-2型7例;参照IPSS-R预后积分标准分为极低危3例,低危8例,中危20例,高危15例,极高危4例。纳入标准:①符合2008年WHO关于MDS的诊断及分型标准,病例资料完整;②具有输血史,输注红细胞≥30 U;③未进行去铁治疗;④生存期≥1年。排除标准:①合并长期活动性炎症、肝病、实体肿瘤、溶血、长期消化道出血、月经量多;②疑似慢性出血;③应用铁剂治疗。患者入院后给予常规促造血、调节免疫等药物治疗,主要药物为十一酸睾酮胶囊、达那唑胶囊、环孢素胶囊等;符合化疗指征患者给予静脉注射地西他滨去甲基化治疗;根据卫生部《临床输血指南》及患者病情进行输血治疗,当Hb<60 g/L时输注红细胞。
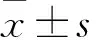
1.3 血清SF水平、SF变化量(SFΔ)检测及相关性分析 分别于输血前及累计输注红细胞达10、20、30 U时取血,离心后取血清,采用放射免疫法检测SF。血清SF正常值:女性12~120 ng/mL,男性50~19 ng/mL。计算输血前后血清SFΔ。SFΔ=SF输血后-SF输血前。
1.3.1 各型及各危险分层患者输血前血清SF水平比较 输血前RA、RARS、RCMD、RAEB-1、RAEB-2型MDS患者血清SF水平分别为(401±113)、(659±116)、(438±161)、(610±217)、(658±226)ng/mL,各型MDS患者间血清SF水平比较差异有统计学意义(P<0.01),其中RARS、REAB-1、RAEB-2型均高于RA、RCMD型(P均<0.05)。
输血前极低危、低危、中危、高危、极高危MDS患者血清SF水平分别为(476±158)、(438±155)、(485±149)、(631±162)、(662±174) ng/mL,各危险分层MDS患者间比较差异有统计学意义(P<0.01),其中高危、极高危MDS患者高于极低危、低危及中危MDS患者(P均<0.05)。
1.3.2 各型MDS患者不同输注红细胞量时血清SFΔ水平比较 各型MDS患者在输注红细胞量为10 U时血清SFΔ比较差异无统计学意义(P>0.05);在输注红细胞量为20、30 U时,各亚型MDS患者血清SFΔ比较差异有统计学意义(P<0.05),其中RAEB-1、RAEB-2型低于其他各型(P均<0.05)。见表1。

表1 各型MDS患者不同输注红细胞量时血清SFΔ比较
注:与RA型比较,*P<0.05;与RARS型比较,#P<0.05;与RCMD型比较,△P<0.05。
1.3.3 各危险分层MDS患者输注红细胞≥30 U时血清SFΔ比较 极低危、低危、中危、高危、极高危MDS患者输注红细胞≥30 U时血清SFΔ分别为(3 564±682)、(3 124±466)、(3 617±965)、(2 131±467)、(2 089±516)ng/mL,各危险分层MDS患者间比较P<0.05,其中高危、极高危MDS患者低于其他各危险分层患者(P均<0.05)。
1.4 血清SFΔ与MDS患者预后的关系 输注红细胞≥30 U时根据血清SFΔ将患者分为SFΔ≥2 000 ng/mL组(30例)及<2 000 ng/mL组(20例)。两组均随访至2016年6月,统计随访截止时两组急性髓系白血病(AML)发生例数及总体生存时间(OS),计算MDS/AML转化率。OS为自确诊之日起至随访截止日,死亡患者计算至死亡日止。
随访截止时SFΔ≥2 000 ng/mL组与SFΔ<2 000 ng/mL组分别确诊AML 6例和15例,MDS/AML转化率分别为20.0%、75.0%,确诊中位时间分别为16(9~26)个月、 7(9~22)个月;中位OS分别为36(14~48)个月、24(12~28)个月。两组MDS/AML转化率及中位OS比较,P均<0.01。
2 讨论
MDS患者造血系统的一个显著特征是无效造血,是引起患者铁代谢紊乱的基本原因[2]。杨英等[3]对38例新确诊的MDS患者研究发现,非输血依赖的MDS患者SF、转铁蛋白(Tf)、细胞内铁、细胞外铁等指标增高,说明MDS患者幼红细胞对铁的利用、储存及排出存在异常。在无效造血的病理状态下,大量幼稚红细胞会释放生长分化因子15(GDF15)和扭转原肠胚形成同系物1(TWSG1)[4,5],二者均可抑制肝脏铁调素合成,使肠道吸收铁量增加。同时,由于幼红细胞携氧能力不足,机体处于缺氧状态,促红细胞生成素(EPO)分泌增加,进一步抑制铁调素合成。MDS无效造血伴恶性克隆者其肿瘤负荷增大,可能进一步促进SF增高。部分MDS患者存在人遗传性铁色素沉着症(HFE)基因突变[6]。HFE基因C282Y突变和H63D突变可以导致肠道过度吸收铁。HFE蛋白表达于小肠上皮细胞基底侧,能够与Tf结合,将循环内的铁离子转运到上皮细胞,上皮细胞感应体内铁离子变化,从而调节小肠绒毛膜管腔侧Dcyr-b及Dmt1表达,调控肠道对铁的吸收。HFE基因变异时Tf运送的铁不能进入上皮细胞,上皮细胞内呈现铁缺乏状态,促进Dcyr-b及dmt1表达,增加铁离子吸收。Várkonyi等[7]对50例MDS患者的研究结果显示,HFE 基因C282Y突变率达10%,H63D突变率达44%,HFE基因突变率明显高于正常对照者。其后Várkonyi等[8]将病例扩大至61例,仍得出相似结论。
本研究结果显示, RARS、RAEB-1和RAEB-2型患者血清SF水平明显高于其他各型,提示不同亚型MDS患者铁代谢情况不同。Santini等[9]报道,RARS型MDS患者血清SF水平较高,肠道对铁的过量吸收可能是导致SF增高的主要原因;RAEB型患者铁调素水平最高,提示RAEB型患者血清SF增高不是由铁的过量吸收引起,可能与肿瘤负荷有关。本研究中输注相当血量后各危险度MDS患者血清SFΔ存在差异,原因可能与炎症因子尤其是TNF-α表达水平不同有关。TNF-α可通过SF转录而分泌增加,亦可促进肝细胞分泌SF导致SF增高。有研究表明,低危MDS患者尤其是RA、RCMD型患者,TNF-α表达明显高于以RAEB-1、RAEB-2型为主要组成的高危MDS患者[10,11]。因此,我们认为低危MDS患者TNF-α高表达是其SFΔ明显高于中危患者、高危患者的重要原因。
MDS是一种具有高风险向AML转化的血液系统恶性疾病,其一旦转为AML,病情往往较原发AML更为凶险,患者预后更差。本研究发现,在大量输血后高危、极高危MDS患者血清SFΔ明显低于其他危险度患者,因此我们推测大量输血后MDS患者的SFΔ与其预后具有一定相关性。基于此结果,我们以血清SFΔ为2 000 ng/mL为分割点,将患者分为SFΔ≥2 000 ng/mL组和SFΔ<2 000 ng/mL组,结果发现SFΔ≥2 000 ng/mL组MDS/AML转化率和OS均大于SFΔ<2 000 ng/mL组。MDS高危患者细胞内活性氧自由基内源性产物增加,可导致DNA双链断裂并产生错误修复,增加基因的不稳定性,导致遗传基因改变[12]。此外,不稳定细胞铁增加可使细胞内铁代谢异常,可能进一步加剧氧化应激反应,从而加剧前白血病克隆基因的不稳定性,促进MDS向白血病转化[13]。冯宝章等[14]研究认为,白血病前期或MDS转白血病均与骨髓TNF-α活性增加有关。TNF-α活性增加可在短期内促使白血病前期骨髓干祖细胞大量增殖,并达到临床诊断急性白血病的标准。杨永等[15]研究发现,过高的铁负荷也可导致毒性活性氧增加,活性氧的积累会进一步导致造血干细胞衰老和死亡,促进造血细胞相关基因突变,引起DNA损伤,进而促进MDS发生、发展,增加MDS患者转为白血病和出现各种并发症的概率,导致患者预后不良。
综上所述,初发RARS、REAB-1、RAEB-2型及高危、极高危MDS患者血清SF水平均高于其他分型及危险度者;RAEB-1、RAEB-2型及高危、极高危患者铁过载程度均高于其他分型及危险度者;血清SF水平变化对MDS患者预后具有一定的预测作用。
[1] 葛丹丹,赵芳,黄苏,等.血清铁蛋白水平—骨髓增生异常综合征预后的风险因素[J].中国实验血液学杂志,2015,23(5):1370-1374.
[2] Kikuchi S, Kobune M, Iyama S, et al. Improvement of iron-mediated oxidative DNA damage in patients with transfusion-dependent myelodysplastic syndrome by treatment with deferasirox[J]. Free Rad Bio Med, 2012,53(4):643-648.
[3] 杨英,杨波,梁志鹏.铁代谢指标在骨髓增生异常综合征无效造血中的临床研究[J].中国实验血液学杂志,2013,21(4):948-952.
[4] Tanno T, Bhanu NV, Oneal PA, et al. High levels of GDF15 in thalassemia suppress expression of the iron regulatory protein hepcidin[J]. Nat Med, 2007,13(9):1096-1101.
[5] Tanno T, Porayette P, Sripichai O, et al. Identification of TWSG1 as a second novel erythroid regulator of hepcidin expression in murine and human cells[J]. Blood, 2009,114(1):181-186.
[6] Várkonyi J, Szabó T, Sebestyén P, et al. New aspects of copper and iron metabolism in the myelodysplastic syndromes[J]. Chemotherapy, 2006,52(2):66-68.
[7] Várkonyi J, Tarkovács G, Karádi I, et al. High incidence of hemochromatosis gene mutations in the myelodysplastic syndrome: the Budapest Study on 50 patients[J]. Acta Haematol, 2003,109(2):64-67.
[8] Várkonyi J, Demeter J, Tordai A, et al. The significance of the hemochromatosis genetic variants in multiple myeloma in comparison to that of myelodysplastic syndrome[J]. Ann Hematol, 2006,85(12):869-871.
[9] Santini V, Girelli D, Sanna A, et al. Hepcidin levels and their determinants in different types of myelodysplastic syndromes[J]. PLoS One, 2011,6(8):1725-1726.
[10] 王秀丽,邵宗鸿,姚程,等.骨髓增生异常综合征患者骨髓T辅助细胞亚群的研究[J].中华血液学杂志,2005,26(12):743-745.
[11] 张越,许洪志,马春燕,等.AA、MDS和AML患者外周血T淋巴细胞相关细胞因子表达水平的对比研究[J].新医学,2016,47(6):384-387.
[12] Sallmyr A, Fan J, Rassool FV. Genomic instability in myeloid malignancies: increased reactive oxygen species (ROS), DNA double strand breaks (DSBs) and error-prone repair[J]. Cancer Letters, 2008,270(1):1-9.
[13] Pullarkat V. Objectives of iron chelation therapy in myelodysplastic syndromes: more than meets the eye[J]. Blood, 2009,114(26):5251-5255.
[14] 冯宝章,张益枝.骨髓增生异常综合征和再生障碍性贫血等骨髓TNF-α活性与白血病的关系[J].白血病·淋巴瘤,2000,9(6):334-337.
[15] 杨永,何广胜.骨髓增生异常综合征铁超负荷研究进展[J].中国实用内科杂志,2012,32(11):885-887.
Changesandsignificanceofserumferritinlevelinpatientswithmyelodysplasticsyndrome
LIUChao1,QINHaoren,JIHongxia,LIUYaoyao,YANGXiangdong
(1TianjinUniversityofTraditionalChineseMedicine,Tianjin300110,China)
ObjectiveTo investigate the changes and clinical significance of serum ferritin (SF) level in patients with primary myelodysplastic syndrome (MDS).MethodsFifty cases of newly diagnosed MDS patients were selected, including different sub-types (6 cases of RA type, 4 RARS, 20 RCMD, 13 RAEB-1, and 7 RAEB-2) and different IPSS-R classifications (3 cases of very low risk, 8 cases of low risk, 20 cases of intermediate risk, 15 cases of high risk, and 4 cases of very high risk). First of all, the blood samples were taken before and after transfusion of red blood cells at 10, 20 and 30 U, respectively, then we measured SF level in each sample by radioimmunoassay and calculates the difference of SF(SFΔ). At last, we analyzed the relationship of SFΔ level with different blood transfusion volume, different sub-type and IPSS-R classification. When the infusion of red blood cells were up to 30 U, we divided the patients into the SFΔ≥2 000 ng/mL group and SFΔ<2 000 ng/mL group, and we compared the prognosis of patients between these two groups.ResultsThe levels of SF in patients with RARS, RAEB-1, and RAEB-2 types were higher than those of patients with RA and RCMD types (allP<0.05); the levels of SF in the high-risk and very-high-risk patients were apparently higher than those in the very-low-risk, low-risk and intermediate-risk patients (allP<0.5). Serum SFΔ levels were lower in patients with RAEB-1 and RAEB-2 types than those in the other types at the blood transfusion of 20 and 30 U (allP<0.05). Serum SFΔ levels in the high-risk and very-high-risk patients with erythrocytes up to 30 U were lower than those in the other risk patients (allP<0.05). All patients were followed up to June 2016. When the infusion of red blood cells were up to 30 U, the transformation rate of MDS/AML in the SFΔ≥2 000 ng/ml group was lower than that in the SFΔ<2 000 ng/ml group, and the whole median survival time in the SFΔ≥2 000 ng/ml group was longer (P<0.01).ConclusionsThe serum SF levels in newly diagnosed MDS patients with RARS, RAEB-1, RAEB-2 types, and in high-risk and very-high-risk patients are higher than those of other sub-types and risk classifications. With the increase of blood transfusion, the level of iron overload in patients with RAEB-1 and RAEB-2 types and in high-risk and very-high-risk patients are higher than those of the other sub-types and risk classifications. The change of serum SF may predict the prognosis of patients with MDS.
myelodysplastic syndrome; ferritin; blood transfusion; acute myelogenous leukemia
国家自然科学基金资助项目(81774048)
刘超(1989-),男,硕士研究生在读,研究方向为血液病的诊断及治疗。E-mail: lkcwtf@163.com
杨向东(1977-),男,副主任医师,研究方向为老年血液病的诊断及治疗。E-mail: yxdtcm@126.com
10.3969/j.issn.1002-266X.2017.48.006
R551.3
A
1002-266X(2017)48-0019-04
2017-08-04)

