迪康凝胶对大鼠烫伤创面的治疗作用及可能机制研究*
崔博慧,李 龙,黄凌远,罗 丹,赵婵娟,孙小青,牟妍希,王志军△
1.大连大学整形外科研究所(大连 116021); 2.成都里来生物科技有限公司(成都 610000); 3.四川大学华西第二医院(成都 610000)
·论著·
迪康凝胶对大鼠烫伤创面的治疗作用及可能机制研究*
崔博慧1,李 龙1,黄凌远2,罗 丹2,赵婵娟3,孙小青1,牟妍希1,王志军1△
1.大连大学整形外科研究所(大连 116021); 2.成都里来生物科技有限公司(成都 610000); 3.四川大学华西第二医院(成都 610000)
目的探讨迪康凝胶对烫伤大鼠创面愈合的效果及作用机制。方法将SD大鼠随机分为模型组、美宝烫伤膏组、迪康凝胶组,3组均采用超级控温烫伤仪,造背部深Ⅱ度烫伤。模型组不给药,其余给药1次/d,连续21 d。连续考察21 d内创面愈合情况及创面病理组织形态。ELISA法检测组织TNF-α和IL-8及Ⅰ、Ⅲ型胶原。RT-PCR检测组织TNF-α和IL-8表达水平。结果与模型组比较,迪康凝胶组愈合时间缩短(P<0.05,P<0.01),创伤愈合率增高(P<0.05,P<0.01),差异有统计学意义。组织学观察证明,迪康凝胶具有良好的组织损伤修复作用。ELISA检测表明,烫伤后两药物组创面组织TNF-α和IL-8含量均明显低于模型组(P<0.05,P<0.01);而胶原Ⅰ、Ⅲ组织含量均高于模型组。RT-PCR检测表明,两药物组组织TNF-α mRNA和IL-8 mRNA表达水平均与其蛋白浓度水平基本一致。结论迪康凝胶能促进大鼠皮肤烫伤后创面愈合,是治疗烫伤创面的有效药物。
迪康凝胶;美宝烫伤膏;烫伤;Ⅰ型胶原;Ⅲ型胶原;TNF-α;IL-8;大鼠
1 材料和方法
1.1 材料
1.1.1 实验动物 采用清洁级雄性SD大鼠81只,体质量(220±15)g,购于成都达硕实验动物有限公司。生产许可证号:SCXK(川2013-24),使用许可证号:SYXK(川2014-189)。(25±2)℃室温下,暂养1周后开始试验,试验期间,自由采食、饮水。
1.1.2 药物 美宝烫伤膏:上海美宝生命科技有限公司;迪康凝胶:成都迪康药业有限公司。
1.1.3 主要试剂 大鼠肿瘤坏死因子(TNF-α)ELISA检测试剂盒,大鼠白介素-8(IL-8)ELISA检测试剂盒,大鼠胶原Ⅰ型、Ⅲ型ELISA检测试剂盒,购于上海鑫乐;总RNA抽提试剂(Invitrogen);多聚甲醛、伊红液、苏木素(AR级)。
1.1.4 主要仪器 Multlskan酶标仪(赛默飞世尔),实时荧光定量(RT-PCR)仪(Thermo Fisher),低温离心机C2500(湖南湘仪实验仪器),转轮式切片机(徕卡-2016,德国),BMJ-Ⅲ型包埋机(中威电子),PHY-Ⅲ型病理组织漂烘仪(中威电子),SYQ-DSX-280B压力蒸汽灭菌器(上海宜川),BN-200高精密电子天平(台湾巨林樱花)等。
1.2 方法
1.2.1 动物建模 采用8%硫化钠溶液,烫伤前1 d将大鼠背毛脱去。造模前,先用10%水合氯醛,按3 mL/kg剂量腹腔注射麻醉,再固定于超级控温烫伤仪。将大鼠背向上,采用0.5 kg压力、80 ℃,烫伤20 s,经组织病理验证深Ⅱ度烫伤造模成功,每只鼠造4个烫伤创面[9]。单笼饲养,颈部使用胶带固定,防止大鼠舔舐药物。
1.2.2 实验动物分组及处理 大鼠随机分为3组:烫伤模型组(自然愈合)、美宝烫伤膏组、迪康凝胶组,每组24只。随机分组方式为:首先将72只大鼠依次编号,在excle中输入相应编号,利用Rand函数对每个编号随机生成对应数值[10],升序排列,每24个依次的随机编号对应的大鼠作为1组。模型组不给药,使其自然愈合;药物组造模当天开始给药,连续21 d,1次/d。取健康大鼠共9只,不烫伤,分别于3、7、14 d,每个时间点处死3只,作为组织病理正常对照组。
1.2.3 大鼠创面愈合情况观察 观察创面愈合情况,包括结痂、脱痂、愈合时间及眼观伤口恢复情况。对结痂、脱痂的判定,参考杨明等[11](2014)报道方法。
1.2.4 创面愈合率的测定 造模后第1、3、7、14、21 天,每组随机取3只大鼠,采用透明膜描记称量法[12],利用描绘创面的透明硫酸纸的质量与面积比例换算,考察创面愈合率。
11月18日,亚太经合组织第二十六次领导人非正式会议在巴布亚新几内亚莫尔兹比港举行。会议的主题是“把握包容性机遇,拥抱数字化未来”。国家主席习近平出席并发表题为《把握时代机遇共谋亚太繁荣》的重要讲话。
1.2.5 病理组织学观察 造模后第3、7、14天,每个时间点分别处死“1.2.4”各组大鼠3只及组织病理正常对照组大鼠3只。取烫伤部位全层皮肤,按常规方法制备石蜡切片,HE染色,镜检观察。
1.2.6 组织TNF-α和IL-8水平 取“1.2.5”处死大鼠,收集伤口中心及周围去痂全层皮肤,称重剪碎,无菌生理盐水10倍稀释,匀浆。4 ℃,3 000 rpm离心15 min,收集上清备用,参考说明书,检测大鼠皮肤组织TNF-α和IL-8含量。
1.2.7 组织Ⅰ、Ⅲ型胶原检测 取“1.2.6”上清样本,依照鼠Ⅰ、Ⅲ型胶原ELISA试剂盒操作说明检测样本。
1.2.8 RT-PCR检测组织TNF-α和IL-8表达水平 第6、12小时和第1、3、7、14天取上述实验中所处死大鼠的创面中心处及周围皮肤组织,提取大鼠总RNA,检测A260和A280吸光度值,电泳确定RNA的完整性后,按照说明书合成cDNA第一链。设计TNF-α和IL-8上下游引物,以β-Actin作为内参基因,按照试剂盒说明,检测皮肤组织TNF-α和IL-8表达情况。
1.3 统计学方法
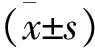
2 结果
2.1 大鼠深Ⅱ度烫伤感染模型的建立
经病理切片检查:正常组皮肤角质细胞核质呈蓝紫色,均匀,皮肤皮脂腺、毛囊等结构分明,真皮层胶原纤维排列整齐(图1A);烫伤模型大鼠的皮肤角质细胞结构不清,核聚缩,坏死,胶原纤维变性,结构模糊,细胞变性,深层部分皮肤附属器发生核聚缩(图1B),表明深Ⅱ度烫伤模型造模成功。
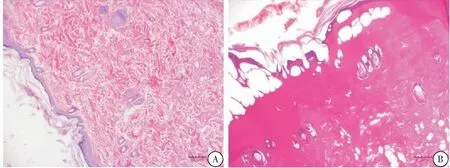
图1 深Ⅱ度烫伤感染模型注:A:正常对照组;B:模型组(HE染色,100×)
2.2 创面愈合情况
烫伤后1~2 d,模型组创面水肿最明显,迪康凝胶组和美宝烫伤膏组次之;第3~4天开始,烫伤部位逐渐开始结痂。第7天,两组药物组均未见明显分泌物,模型组部分大鼠可见痂下少许分泌物。两组药物组开始脱痂时间均较模型组早,第14天两组药物组大部分痂皮已脱落,创面均明显小于模型组,尤其迪康凝胶组可见明显新生肉芽组织。此后,各组创面进一步减小,第21天两组药物组创面基本愈合,二者无明显差异,模型组创面明显大于两组药物组(图2)。
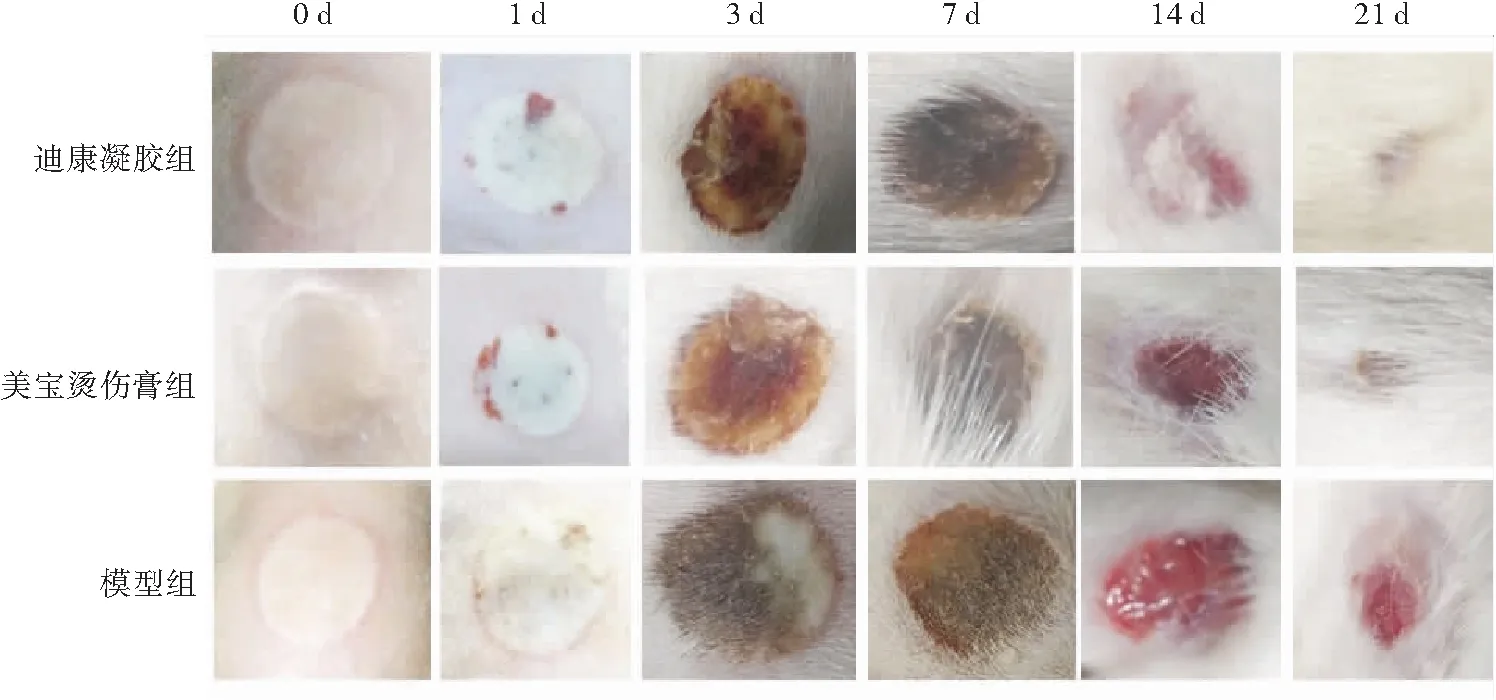
图2 烫伤后各组大鼠创面大体观察
测量统计每只大鼠背上4个烫伤创面的愈合情况,包括结痂、脱痂和创面愈合的时间。与模型组比较,迪康凝胶组完全愈合时间缩短(P<0.01)。迪康凝胶组脱痂时间缩短(P<0.05)。开始结痂时间,与模型组比较,两药物组差异均无统计学意义(P>0.05)。迪康凝胶组与美宝烫伤膏组结痂时间、脱痂时间和创面愈合时间差异均无统计学意义(P>0.05)(表1)。上述结果表明,迪康凝胶可促进大鼠烫伤创面愈合。
2.3 创面愈合率
于烫伤后1、3、7、14、21 d统计创面愈合率,结果表明,各组创面愈合率均随时间推移明显升高。烫伤后第3、7天,美宝烫伤膏组和迪康凝胶组创面愈合率均明显高于模型组(P<0.05);第14、21天,两药物组创面愈合率均高于模型组(P<0.01)。两药物组比较,差异无统计学意义(P>0.05)(表2)。

表1 各组大鼠创面愈合时间
注:与模型组比较,*P<0.05,**P<0.01

表2 不同时间点各组大鼠创面愈合率
注:与模型组比较,*P<0.05,**P<0.01
2.4 病理组织形态的影响
模型组及两药物组烫伤后早期(3 d)均可见真皮层明显充血,水肿和白细胞浸润,胶原纤维离散、肿胀。药物组比模型组炎症反应轻,且迪康凝胶组轻于美宝烫伤膏组。烫伤后7 d和14 d,模型组创面虽愈合,但烫伤处上皮分化较差,纤维增生,排列紊乱,组织结构不清晰,且炎性细胞浸润明显。两药物组创面愈合较好,镜下可见新生表皮各层分化良好,排列整齐(图3),迪康凝胶效果优于美宝烫伤膏。
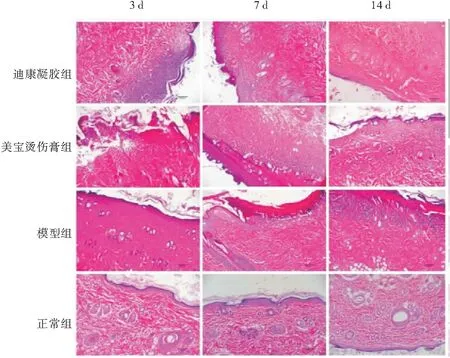
图3 烫伤后各组不同时间点创面皮肤组织病理变化(HE染色, 100×)
2.5 组织TNF-α、IL-8、Ⅰ型及Ⅲ型胶原水平
烫伤后从第1天至第21天,两药物组创面组织TNF-α和IL-8含量均低于模型组(P<0.05,P<0.01)。两药物组相比,从第7天开始,迪康凝胶组组织TNF-α低于美宝烫伤膏组,但差异无统计学意义(P>0.05);从第1天开始,迪康凝胶组组织IL-8低于美宝烫伤膏组,其中第14天差异具有统计学意义(P<0.05)(表3~4)。
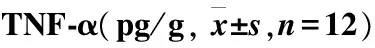
表3 各组大鼠组织
注:与模型组比较*P<0.05,**P<0.01
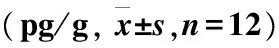
表4 各组大鼠组织IL-8水平
注:与模型组比较,*P<0.05,**P<0.01;迪康凝胶与美宝烫伤膏组比较,#P<0.05
烫伤后从第1天开始,各组胶原Ⅰ、Ⅲ组织含量均逐渐升高,且两药物组胶原含量均高于模型组,尤其第7天开始,与模型组比较差异有统计学意义(P<0.05,P<0.01)。迪康凝胶组组织胶原Ⅰ型含量从第3天开始,高于美宝烫伤膏组,但差异无统计学意义(P>0.05);迪康凝胶组组织胶原Ⅲ型含量从第3 天开始,高于美宝烫伤膏组,其中第21天时,差异有统计学意义(P<0.05)(表5~6)。
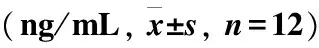
表5 各组大鼠组织Ⅰ型胶原水平
注:与模型组比较,*P<0.05,**P<0.01
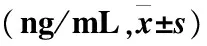
表6 各组大鼠组织Ⅲ型胶原水平
注:与模型组比较,*P<0.05,**P<0.01;迪康凝胶与美宝烫伤膏组比较,#P<0.05
2.6 组织TNF-α和IL-8表达水平
造模后的第6~12小时各组TNF-α mRNA表达水平均增加,但从第1天开始逐渐下降,直至考察结束的第14天,依然持续下降。与模型组相比,差异有统计学意义(P<0.05,P<0.01)。迪康凝胶和美宝烫伤膏组相比,差异无统计学意义(P>0.05)(表7)。

表7 TNF-α基因表达水平变化
注:与模型组比较,*P<0.05,**P<0.01
造模后的第6 小时至第1天,模型组IL-8 mRNA的表达水平持续增加,第3 天已开始减少;两药物组6~12 h IL-8 mRNA的表达水平持续增加,第1 天检测已开始下降。药物组与模型组相比,差异有统计学意义(P<0.05,P<0.01)。迪康凝胶和美宝烫伤膏相比,差异无统计学意义(P>0.05)(表8)。
表8 IL-8基因表达水平变化
注:与模型组比较,*P<0.05,**P<0.01
3 讨论
本研究表明,迪康凝胶和美宝烫伤膏均能明显改善伤口愈合,且效果优于对照,直至21 d,两药物组创面均已基本愈合,伤口愈合率在第14和21天均高于模型组,差异有统计学意义(P<0.01)。说明迪康凝胶可加快烫伤创面的愈合速度,减小创面面积,与已商品化的阳性药物美宝烫伤膏相比,眼观作用效果大致相当。组织病理考察也显示了类似结果。伤口愈合的前14 d,模型组创面虽愈合,但烫伤处上皮分化较差,纤维增生,排列紊乱,组织结构不清晰,且炎性细胞浸润明显。而两药物组创面愈合较好,镜下可见新生表皮和新生纤维分化良好,排列整齐,迪康凝胶效果优于美宝烫伤膏。
烫伤后的创伤修复初期,主要是创面局部微循环障碍和过度炎症反应,局部皮肤组织释放TNF-α、IL-8等因子显著增多[13-14]。血流不畅导致局部炎症因子和代谢产物堆积,炎症因子又加重局部炎症反应和组织水肿,压迫局部血管,加剧局部缺血缺氧,二者互为因果,恶性循环[15-16]。本试验检测表明,烫伤后两药物组创面组织TNF-α和IL-8含量均明显低于模型组(P<0.05,P<0.01)。同时,本研究亦从基因层面考察了TNF-α和IL-8在烫伤组织的表达变化,获得类似结果,表明迪康凝胶可明显改善局部微循环,减轻炎性反应。
胶原对于修复过程的完成有着极其重要的作用,除对组织提供支持和张力外,还能对细胞产生多种影响,胶原代谢的不平衡是创面愈合缓慢的原因之一[17]。胶原的类型较多,其中在创面愈合过程中,最重要的两个胶原为:胶原Ⅰ型和胶原Ⅲ型。Ⅰ型胶原蛋白发挥支架作用,而包绕支架外周的Ⅲ型胶原蛋白含量决定胶原纤维的直径大小和弹性,Ⅲ型胶原含量越高的胶原纤维越细,拉伸强度越好,瘢痕越轻。结果显示,烫伤后治疗过程中,两药物组从第7 天开始,Ⅲ型胶原含量均明显高于模型组(P<0.05,P<0.01);第21 天迪康凝胶组的皮肤组织Ⅲ型胶原含量明显高于美宝烫伤膏组(P<0.05),表明迪康凝胶对烫伤后瘢痕减少具有一定作用,与临床眼观效果一致。Ⅰ型胶原是瘢痕组织纤维化的物质基础,结果显示,第7天开始,两药物组Ⅰ型胶原含量明显高于模型组(P<0.05,P<0.01),但第21天两药物组与模型组相比,Ⅰ型胶原含量差异无统计学意义(P>0.05)。统计伤口愈合过程中,Ⅰ/Ⅲ型胶原比例显示,从第3天至第21天,迪康凝胶和美宝烫伤膏的Ⅰ/Ⅲ型胶原比值均低于模型组,表明两组药物均能促进伤口愈合,减少瘢痕生成。
综上所述,迪康凝胶对治疗烫伤伤口有明显的临床效果,可促进伤口愈合,同时减少炎性反应及组织瘢痕形成。迪康凝胶可作为临床治疗烫伤的有效药物。
[1]Zhong J, Greenspan D C. Processing and properties of sol-gel bioactive glasses[J]. J Biomed Mater Res, 2000, 53(6): 694-701.
[2]Zhong J P, Greenspan D C, Feng J W. A microstructural examination of apatite induced by Bioglass in vitro[J]. J Mater Sci Mater Med, 2002, 13(3): 321-326.
[3]Lobel K D, Hench L L. In vitro adsorption and activity of enzymes on reaction layers of bioactive glass substrates[J]. J Biomed Mater Res, 1998, 39(4): 575-579.
[4]Bedian L, Villalba-Rodríguez A M, Hernández-Vargas G,etal. Bio-based materials with novel characteristics for tissue engineering applications-A review[J]. Int J Biol Macromol, 2017, 98: 837-846.
[5]Kasseroller R G, Brenner E. A prospective randomised study of alginate-drenched low stretch bandages as an alternative to conventional lymphologic compression bandaging[J]. Support Care Cancer, 2010, 18(3): 343-350.
[6]Singla A K, Chawla M. Chitosan: some pharmaceutical and biological aspects--an update[J]. J Pharm Pharmacol, 2001, 53(8): 1047-1067.
[7]Khor E, Lim LY. Implantable applications of chitin and chitosan[J]. Biomaterials, 2003, 24(13): 2339-2349.
[8]Sashiwa H, Aiba S I. Chemically modified chitin and chitosan as biomaterials[J]. Progress in Polymer Science, 2004, 29(9): 887-908.
[9]宋必卫, 刘洁琼, 章方珺, 等. 黄蜀葵提取物对大鼠背部深Ⅱ度烫伤的治疗作用[J]. 浙江工业大学学报, 2017, 45(1): 47-50.
[10] 李琦, 柴金苗. 逍遥散对肝郁气滞证视神经炎大鼠视网膜神经节细胞凋亡的影响[J]. 山西中医学院学报, 2017, 18(1): 18-20.
[11] 杨明, 尹西拳, 李耿. 大黄白糖散对大鼠烫伤皮肤的修复作用研究[J]. 新中医, 2014, 46(2): 193-196.
[12] 刘小平, 卢金利, 陈谦, 等. 芦荟凝胶外涂对大鼠浅度烫伤创面愈合及其相关因子表达的影响[J]. 陕西医学杂志, 2006, 35(6): 646-648.
[13] 王明青, 李学川, 孙元华, 等. 早期磨痂术治疗深Ⅱ度烧伤的实验观察及机制初探[J]. 山东医药, 2002, 42(33): 5-7.
[14] 宾东华, 詹敏, 王爱华, 等. 参黄洗液对大鼠痔术后创面修复过程中血清IL-8及TNF-α的干预作用[J]. 世界中西医结合杂志, 2017, 12(5): 638-640,645.
[15] Myrianthefs P M, Baltopoulos G J. Circulating cytokines and outcome prediction of burned children with concomitant inhalation injury[J]. Crit Care, 2008, 12(3): 155.
[16] Rigamonti E, Zordan P, Sciorati C,etal. Macrophage plasticity in skeletal muscle repair[J]. Biomed Res Int, 2014, 2014: 560629.
[17] 肖秀丽, 李斌, 王振宜, 等. 祛瘀生肌中药对大鼠正常创面肉芽组织中Ⅰ型胶原和基质金属蛋白酶表达的影响[J]. 中国中西医结合杂志, 2007, 27(10): 909-911.
AStudyontheTherapeuticEffectandProbableMechanismsofDikangGelontheScaldWoundHealingofRats
CuiBohui1,LiLong1,HuangLingyuan2,LuoDan2,ZhaoChanjuan3,SunXiaoqing1,MuYanxi1,WangZhijun1△.
1.PlasticSurgeryInstituteofDalianUniversity,Dalian116021,China; 2.WestChinaSecondUniversityHospital,Chengdu610000,China; 3.ChengduLiLaiBiotechnologyCo.,Ltd,Chengdu610000,China
ObjectiveTo investigate the therapeutic effect and mechanism of Dikang Gel on the scald wound healing of rats.MethodsThe SD rats were divided randomly into the model group, Mebo Ointment group, and Dikang Gel group. The deep second-degree scald model was established with a super temperature-controlled scald apparatus in SD rats. The model group was not treated, while the other two groups were administered once a day for 21 days and the wound healing process and histopathology were monitored within 21 days. The levels of TNF-α, IL-8, typeⅠand Ⅲ collagen in tissues were detected by the ELISA method and the mRNA expression of TNF-αand IL-8 in tissues were detected by RT-PCR.ResultsThe healing time was significantly shorter (P<0.05,P<0.01) and the wound healing rate was significantly higher (P<0.05,P<0.01) in the Dikang Gel group than in the model group. The results of histological observation showed that Dikang Gel had a good effect of tissue repair. The levels of TNF-α and IL-8 in the wound tissues were significantly lower in the two administered groups than in the model group (P<0.05,P<0.01). The levels of typeⅠand Ⅲ collagen were also higher in the two administered groups than in the model group. The results of RT-PCR showed that the mRNA expression levels of TNF-α and IL-8 in the two administered groups were consistent with the levels of protein concentration.ConclusionDikang Gel can promote the scald wound healing of rats, so it is an effective drug in the treatment of the scald wound.
Dikang Gel; Mebo Ointment; Scald; TypeⅠcollagen; Type Ⅲ collagen; TNF-α; IL-8; Rat
http://kns.cnki.net/kcms/detail/51.1705.R.20171108.0840.010.html
10.3969/j.issn.1674-2257.2017.06.005
R644
A
成都市科技局科技惠民计划项目(No:2014-HM01-00274-SF)
△
王志军,E-mail:wangzhijundldx@126.com

