左乙拉西坦对癫痫患者氧化应激及炎性因子的影响*
沈 文,陈兰英,肖志娟,谷 婕,李 芳,郜 静,赵 鹏,唐进松
河北北方学院附属第二医院 神经内科(张家口 075100)
·论著·
左乙拉西坦对癫痫患者氧化应激及炎性因子的影响*
沈 文,陈兰英,肖志娟,谷 婕,李 芳,郜 静,赵 鹏,唐进松
河北北方学院附属第二医院 神经内科(张家口 075100)
目的探讨左乙拉西坦对癫痫患者氧化应激及炎性因子的影响。方法选取2015年11月至2016年10月河北北方学院附属第二医院接受治疗的癫痫患者90例为研究对象,使用随机数字表法,分为试验组和对照组,每组各45例。对照组口服卡马西平,试验组口服左乙拉西坦,两组均连续治疗6个月后进行效果评价。两组患者治疗前后抽取清晨空腹外周静脉血,采用ELISA法检测C反应蛋白(CRP)、白细胞介素-2(IL-2)、白细胞介素质-6(IL-6)和肿瘤坏死因子-α(TNF-α);流式细胞分析仪测定细胞间黏附分子-1(ICAM-1);化学比色法检测超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)和髓过氧化物酶(MPO);采用肌电/诱发电位仪行神经电生理P300电位检查,记录治疗后2、4、6个月P300电位潜伏期时长。结果两组患者治疗后潜伏期时长较同组治疗前缩短(P<0.05),而试验组治疗后2、4、6个月P300电位潜伏期时长短于对照组(P<0.05);两组患者治疗后CRP、IL-2、IL-6、TNF-α、ICAM-1低于同组治疗前(P<0.05),而试验组治疗后CRP、IL-2、IL-6、TNF-α、ICAM-1低于对照组(P<0.05);两组患者治疗后SOD、CAT、MPO低于同组治疗前,MDA高于同组治疗前(P<0.05),而试验组治疗后SOD、CAT、MPO低于对照组,MDA高于对照组(P<0.05)。结论左乙拉西坦可明显改善癫痫患者血清炎性因子的表达,改善机体氧化应激损伤,从而减轻神经组织损伤,达到更好治疗癫痫的作用。
左乙拉西坦;卡马西平;癫痫;氧化应激;炎性因子
癫痫是指因脑内神经元异常放电,引起脑部慢性疾病,发病与神经递质失衡、神经胶质细胞增生及氧化应激损伤有关,其持续状态可造成患者神经功能永久性缺失[1]。氧化应激常在降低抗氧化酶或增加氧化酶情况下出现,导致机体氧自由基过度增加及代谢失衡,造成机体损害[2]。文献[3]报道,抗癫痫药物(AEDs)可通过影响机体氧化应激系统(OSS),从而影响治疗效果。左乙拉西坦为新型AEDs,可抑制神经元高度同步化,还能够阻断N型钙通道,其口服具有广谱、起效快、患者耐受性好、吸收好、生物利用度高等特点[4]。本研究采用左乙拉西坦治疗癫痫患者,以探讨对患者氧化应激及炎性因子的影响。现报道如下。
1 资料与方法
1.1 临床资料
选取2015年11月至2016年10月河北北方学院附属第二医院接受治疗的癫痫患者90例为研究对象,使用随机数字表法,分为试验组和对照组。试验组45例,男30例,女15例;年龄26~58(41.2±5.6)岁;癫痫病程0.5~6(3.2±1.1)年;癫痫类型:原发性癫痫19例,继发性癫痫26例(包括脑外伤6例、脑卒中9例、缺氧缺血性脑病11例)。对照组45例,男29例,女16例;年龄26~58(41.4±5.5)岁;癫痫病程0.5~6(3.3±1.4)年;癫痫类型:原发性癫痫21例,继发性癫痫24例(包括脑外伤6例、脑卒中9例、缺氧缺血性脑病9例)。两组年龄、性别、癫痫病程、癫痫类型比较,差异无统计学意义(P>0.05)。入组前向患者讲明本研究目的及治疗安全性,在征得患者及家属同意并签署同意书后,进行分组治疗。
1.2 纳入、排除标准
纳入标准:入组患者癫痫诊断符合国际抗癫痫联盟制定的相关标准[5];无进行性中枢神经系统疾病及占位性病变;3个月内平均每月至少发作1次;遵医嘱配合治疗,服药依从性好,临床资料完整。排除标准:患有感染、免疫缺陷、内分泌系统、造血系统疾病和恶性肿瘤等;患有严重心、肝、肾等异常;近期使用过糖皮质激素、AEDs及影响糖、脂代谢药物;妊娠期及哺乳期妇女;与治疗相关药物过敏或耐受性差者。
1.3 方法
对照组口服卡马西平(北京紫竹药业,国药准字H11020449),起始剂量100 mg·次-1·d-1,1周后逐渐增至200 mg /次,3次/d,最大剂量不超过400 mg /次。试验组口服左乙拉西坦[优时比(珠海)制药有限公司,批准文号H20110410],起始剂量1 000 mg/d,分2次口服,每2周加量1次,每次500 mg/d,最大剂量不超过3 000 mg/d。连续治疗6个月后进行比较。
1.4 观察指标
采集两组治疗前后清晨空腹外周静脉血,经抗凝处理,离心提取上清液,置-70 ℃冰箱中待检。采用ELISA法检测C反应蛋白(CRP)、白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α),流式细胞分析仪测定细胞间黏附分子-1(ICAM-1),化学比色法检测超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、髓过氧化物酶(MPO)。采用肌电/诱发电位仪行神经电生理P300电位检查,记录治疗后2、4、6个月P300电位潜伏期时长。疗效标准:明显好转:痫样放电完全消失为正常,痫样放电减少50%以上;好转:痫样放电减少25%~49%;无变化:痫样放电无明显改变或放电增加。
1.5 统计学方法
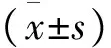
2 结果
2.1 两组治疗前后细胞因子水平比较
两组患者治疗前CRP、IL-2、IL-6、TNF-α、ICAM-1比较,差异无统计学意义(P>0.05);治疗后各指标均低于同组治疗前,差异有统计学意义(P<0.05);试验组治疗后CRP、IL-2、IL-6、TNF-α、ICAM-1低于对照组,两组间比较,差异有统计学意义(P<0.01)(表1)。
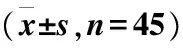
表1 两组治疗前后细胞因子水平及其变化比较
注:与同组治疗前比较,*P<0.05
2.2 两组治疗前后氧化应激水平比较
两组患者治疗前SOD、CAT、MDA、MPO比较,差异无统计学意义(P>0.05);治疗后SOD、CAT、MPO低于同组治疗前,MDA高于同组治疗前(P<0.05);试验组治疗后SOD、CAT、MPO低于对照组,MDA高于对照组(P<0.05)(表2)。
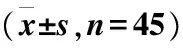
表2 两组治疗前后氧化应激水平及其变化比较
注:与同组治疗前比较,*P<0.05
2.3 两组治疗前后P300电位潜伏期时长比较
两组患者治疗前P300电位潜伏期时长比较,差异无统计学意义(P>0.05),治疗后潜伏期时长较同组治疗前缩短(P<0.05);试验组治疗后2、4、6个月P300电位潜伏期时长短于同期对照组(P<0.05)(表3)。
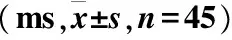
表3 两组治疗前后P300电位潜伏期时长及其变化比较
注:与同组治疗前比较,*P<0.05
2.4 脑电图有效率比较
试验组脑电图总有效率为93.33%,高于对照组的71.11%,组间比较,差异有统计学意义(P<0.05)(表4)。
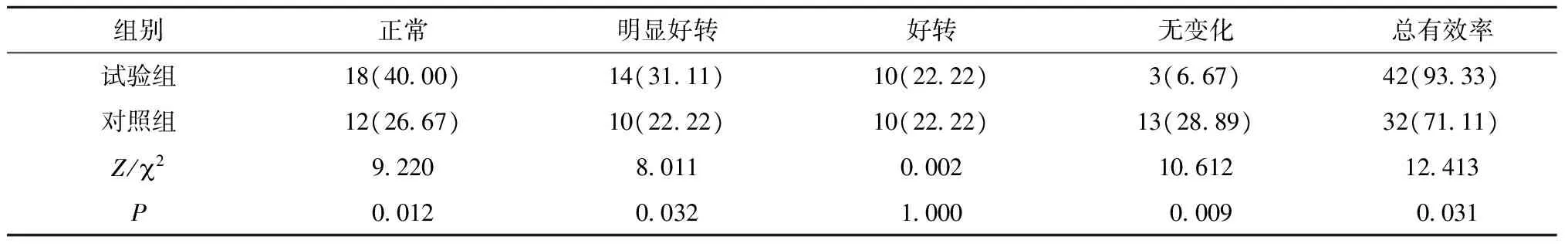
表4 两组脑电图有效率比较[n(%),n=45]
3 讨论
癫痫是常见的神经系统综合征,为脑部神经元反复发作性过度放电所致的脑功能异常,表现为反复发作的意识、情感、感觉等方面短暂异常及肌肉抽搐,长期癫痫发作可导致患者中枢神经元结构改变[6]。研究[7]认为,癫痫主要由脑神经异常放电所引起,且脑神经细胞的损伤与凋亡还会引起一系列炎症反应,进而加重癫痫症状。癫痫的治疗为长期过程,AEDs可能导致患者神经病理损害、内分泌功能异常、色氨酸酶代谢障碍等,同时,对皮层高级神经功能也有不良影响,通过加强抑制神经传递或抑制神经元兴奋而影响患者认知功能[8]。左乙拉西坦为新型AEDs,其机制可能与以下有关[9-10]:1)与脑内突触囊泡蛋白SV2A有较高的亲和力,结合后可抑制神经元异常放电;2)通过解除负性变构剂对GABA能及甘氨酸能神经元抑制,增强抑制中枢作用;3)抑制海马区CA1区锥体神经元高压电激活的N-型钙通道,阻止神经元钙内流,减少神经元活性;4)对神经元突触前神经递质释放进行阻断,抑制神经递质与神经末梢突触前膜蛋白的结合,进而达到抗癫痫作用。本研究中,两组患者治疗后潜伏期时长较同组治疗前缩短(P<0.05),而试验组治疗后2、4、6个月P300电位潜伏期时长短于同期对照组(P<0.05);试验组总有效率为93.33%,优于对照组的71.11%(P<0.05)。由此证实,左乙拉西坦治疗癫痫疗效优于卡马西平。
诸多研究[11]认为,脑细胞合成和分泌的多种炎性因子与神经元异常放电有关,在癫痫反复发作过程中,脑组织内兴奋性氨基酸释放、氧自由基生成、钙离子内流等启动细胞内凋亡程序,而神经元的凋亡会影响其功能,并造成癫痫自发性发作。CRP为非特异性炎症反应的敏感标志物,与神经功能缺损程度相关,而动物实验研究[12]发现,大鼠癫痫模型CRP水平明显升高。研究[13-14]认为,ICAM-1上调可能与癫痫发作引起脑缺血再灌注,大量炎性因子被激活有关,IL-2可增加神经元细胞内钙离子浓度及NMDAR1的表达,IL-6能改变神经元动作电位,诱导细胞膜去极化,TNF-α可增强谷氨酸兴奋性神经递质的兴奋效应,并共同作用提高神经元兴奋性。有学者[15]对癫痫患者血清和脑脊液中炎性因子含量进行分析,结果显示,癫痫患者IL-2、IL-6、TNF-α、ICAM-1水平明显高于非癫痫组。本研究中,两组患者治疗后CRP、IL-2、IL-6、TNF-α、ICAM-1低于同组治疗前(P<0.05),而试验组治疗后CRP、IL-2、IL-6、TNF-α、ICAM-1低于对照组(P<0.05),说明左乙拉西坦可改善癫痫患者炎性因子的表达,其原因可能是左乙拉西坦通过调控免疫-神经-内分泌网络系统,使炎性因子水平得到改善。
研究[16]证实,活性氧在癫痫的发病机制中起重要作用,且持续时间与氧化损伤呈正相关。有学者[8]报道,部分AEDs能够影响癫痫患者的OSS,采用抗氧化剂辅助用药,可能有助于癫痫控制。研究[17-18]显示,SOD、CAT可反映机体对氧化活性因子的清除能力和抗氧化能力,并可保护细胞膜结构与功能的完整性;MDA可直接反映机体发生脂质过氧化反应程度;MPO参与机体炎症反应,其水平高低可能影响机体神经系统病变程度。本研究中,两组患者治疗后SOD、CAT、MPO低于同组治疗前,MDA高于同组治疗前(P<0.05),而试验组治疗后SOD、CAT、MPO低于对照组,MDA高于对照组(P<0.05),提示左乙拉西坦改善癫痫患者氧化应激反应优于卡马西平。
综上所述,左乙拉西坦可明显改善癫痫患者血清炎性因子的表达,改善机体氧化应激损伤,从而减轻神经组织损伤,达到更好治疗癫痫的作用。
[1]邱文娟, 胡小伟, 张正春. 癫痫发病机制及治疗的研究进展[J]. 中华临床医师杂志(电子版), 2014, 8(10): 1920-1924.
[2]巫金娜. 姜黄素调节海马区氧化应激反应干预癫痫大鼠认知功能障碍的初步研究[J]. 深圳中西医结合杂志, 2016, 26(2): 1-3.
[3]张娜. 维生素E辅助用于癫痫中对患者血浆T-Aoc、MDA水平的影响[J]. 临床和实验医学杂志, 2016, 15(17): 1703-1705.
[4]戴德孟. 左乙拉西坦治疗难治性癫痫的临床疗效及安全性[J]. 中国医药科学, 2015, 5(20): 151-153.
[5]张忠文, 邹蓉, 戴永萍, 等. 2010国际抗癫痫联盟定义耐药性癫痫的相关危险因素分析[J]. 临床神经病学杂志, 2016, 29(3): 168-171.
[6]朱秀丽, 舒晓丹, 丁晶, 等. 老年癫痫患者脑电图检查与血清细胞因子水平及T淋巴细胞亚群的相关性[J]. 中国老年学杂志, 2014, 34(9): 2372-2374.
[7]陈宇亮, 张亚楠, 张智瑞, 等. 腺苷在癫痫发病机制中的作用以及腺苷相关癫痫治疗的研究进展[J]. 现代生物医学进展, 2014, 14(26): 5180-5183,5188.
[8]张晓玲, 丁敏, 钟水生. 左乙拉西坦联合卡马西平与托吡酯治疗难治性癫痫的临床研究[J]. 吉林医学, 2014, 35(19): 4301-4303.
[9]王莉. 左乙拉西坦对难治性癫痫患者临床预后分析[J]. 转化医学电子杂志, 2015(10): 30-31,33.
[10] 夏敏, 武士京, 孔庆霞, 等. 左乙拉西坦添加治疗成人难治性癫痫部分性发作的临床疗效和脑电图分析[J]. 中风与神经疾病杂志, 2015, 32(2): 168-170.
[11] 白启强. 复方丹参滴丸合西医常规治疗外伤性癫痫的疗效及对血清炎性指标及NO水平的影响[J]. 中医药导报, 2014, 20(11): 54-56.
[12] 彭威, 张树方, 何晓云, 等. 脑外伤性癫痫患者炎性细胞因子和C反应蛋白变化及其临床意义[J]. 临床和实验医学杂志, 2013, 12(10): 770-771,773.
[13] Dupuis N, Auvin S. Inflammation and epilepsy in the developing brain: clinical and experimental evidence[J]. CNS Neurosci Ther, 2015, 21(2): 141-151.
[14] 黄灵, 黄建敏, 李雪斌, 等. 天麻素对癫痫患者炎症因子、脑源性神经营养因子水平的影响[J]. 广西医学, 2017, 39(3): 289-290,301.
[15] 李兰. 癫痫患者脑脊液和血清中miRNAs含量检测及其对相关细胞因子的调控作用[J]. 海南医学院学报, 2016, 22(6): 611-613,616.
[16] 何小明, 胡婷婷, 王明仲. 左乙拉西坦对癫痫患者氧化应激系统的影响[J]. 中国药房, 2011, 22(18): 1703-1705.
[17] 陈剑峰, 张美胡. 丙戊酸钠缓释片对癫痫患者氧化应激系统及认知功能的影响[J]. 海南医学院学报, 2017, 23(6): 841-843.
[18] 伍丽娜, 甘彦峰, 苏炳银. 褪黑素对癫痫大鼠海马氧化应激及神经元凋亡的影响[J]. 中国康复理论与实践, 2016, 22(5): 535-539.
TheEffectofLevetiracetamontheOxidativeStressandInflammatoryCytokinesinPatientswithEpilepsy
ShenWen,ChenLanying,XiaoZhijuan,GuJie,LiFang,GaoJing,ZhaoPeng,TangJinsong.
DepartmentofNeurology,TheSecondAffiliatedHospitalofHebeiNorthUniversity,Zhangjiakou075100,China
ObjectiveTo explore the effect of levetiracetam on the oxidative stress and inflammatory cytokines in patients with epilepsy.MethodsA total of 90 epilepsy patients treated in The Second Affiliated Hospital of Hebei North University from November of 2015 to October of 2016 were included as the research objects and divided into the experiment group and the control group according to the random number table, and each group consisted of 45 cases. The patients in the control group were given carbamazepine orally, while those in the Experiment group were given levetiracetam orally. The efficacy was evaluated after 6 months of consecutive treatment. The morning fasting peripheral venous blood in the two groups was collected before and after treatment respectively. ELISA was used to detect C-reactive protein (CRP), Interleukin-2 (IL-2), Interleukin-6 (IL-6), and tumor necrosis factor alpha (TNF-α). The flow cytometry (FCM) was used to detect Intercellular adhesion molecule-1 (ICAM-1), the chemical colorimetry was used to detect superoxide dismutase (SOD), catalase (CAT), malonaldehyde (MDA), and myeloperoxidase (MPO), and the myoelectricity/evoked potential machine was used to examine the potential of nerve electrophysiology P300 and record the potential latency of P300 after 2, 4 and 6 months of treatment respectively.ResultsThe potential latency of each group was significantly shorter after treatment than before treatment (P<0.05), while the potential latency of P300 in the experiment group was significantly shorter than that in the control group after 2, 4 and 6 months of treatment respectively (P<0.05). The levels of CRP, IL-2, IL-6, TNF-α, and ICAM-1 in each group were significantly lower after treatment than before treatment (P<0.05), while those in the experiment group were significantly lower than those in the control group (P<0.05). The levels of SOD, CAT and MPO were significantly lower and those of MDA were significantly higher after treatment than before treatment in each group (P<0.05), while the experiment group had lower levels of SOD, CAT and MPO and higher levels of MDA than the control group after treatment (P<0.05).ConclusionLevetiracetam can significantly improve the expression of serum inflammatory cytokines in patients with epilepsy and reduce the oxidative stress damage, which can alleviate the neurological nerve damage and achieve better therapeutic effect on epilepsy.
Levetiracetam; Carbamazepine; Epilepsy; Oxidative stress; Inflammatory cytokine
10.3969/j.issn.1674-2257.2017.06.009
R742.1
A
河北省科学技术成果项目(No: 20162251)

